查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





来源 | 健言
撰文丨南方周末记者 袁端端
编辑丨何海宁
绝大多数医生做临床试验和研究都是兼职,不仅付出多,回报少,在医院内部无论是述职、评优、晋升没有任何优势,也无制度保障。
卫生部门希望“临床医生看好病,科研人员做好科研”,但这是和“临床科研并重”冲突的。
中国临床研究的发展已然落后于医药创新产业链的其它环节,如果没有显著提高,将至少延缓中国创新药产业发展进程五到十年。
“661个「千人计划青年人才」中医学领域只有3人,且都是基础医学,临床研究人才太不受重视了。”——国际咨询公司麦肯锡全球副董事合伙人陈波的演讲,让台下几十名临床医生和研究者感慨,该数据来源于2015年第十一批“千人计划”青年项目的人才学科分布。
2018年1月5日,7家药物研究机构共同发布了《推动临床研究体系设计与实施,深化医药创新生态系统构建》的最新研究报告(以下简称《报告》),呼吁国内各界重视临床研究和临床试验。
报告分析,中国临床研究的发展已然落后于医药创新产业链的其它环节,目前面临顶层设计、试验设计与执行、支撑机制三大层面的深层次挑战,如果没有显著提高,将至少延缓中国创新药产业发展进程五到十年。
中国临床研究水平亟待提高
“坚持用最严谨的标准来要求,使仿制药质量达到国际水平,坚持用创新推动医药产业发展已经成为中国制药产业、监管部门和全社会的共识。”此前,国家食药总局一名官员在接受南方周末记者采访时说,他们正在力图改变过去30年“不注重质量、不注重创新”的传统发展模式。
药物临床试验目的在于确定药物的疗效与安全性,它是新药审批的必备条件,也是药品上市过程中耗时最长、耗资最多的环节。
与更大范围的工业相比,中国的药物研发仍处于早期阶段。但自2015年起的药品审评审批改革,已带给行业一系列翻天覆地的改变,一些专家甚至认为,中国制药企业与国际制药巨头平起平坐只是时间问题。
不过,上述报告提醒,“健康中国2030”国家计划里提出“健康科技创新整体实力位居世界前列”的宏伟目标,但中国要依托当前的临床研究的能力和资源来实现的话,还面临诸多挑战。
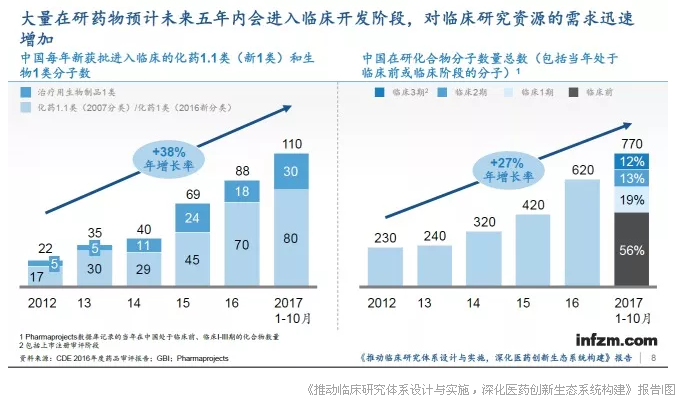
以临床研究资源为例:2017年1-10月,国内获批可以开展临床试验的项目是2014年的3倍,创新药研发的热潮使大量药物成功将进入临床试验阶段。相比之下,中国获得认证的临床试验机构数量在2014年到2016年间却没有显著变化。
三分之二的机构在过去三年中仅参与不超过20项试验,同时仅34%的机构在过去三年中承担过10项以上国际多中心临床试验。而2017年新增的168家机构也基本尚未具备规模开展创新药临床试验的能力。
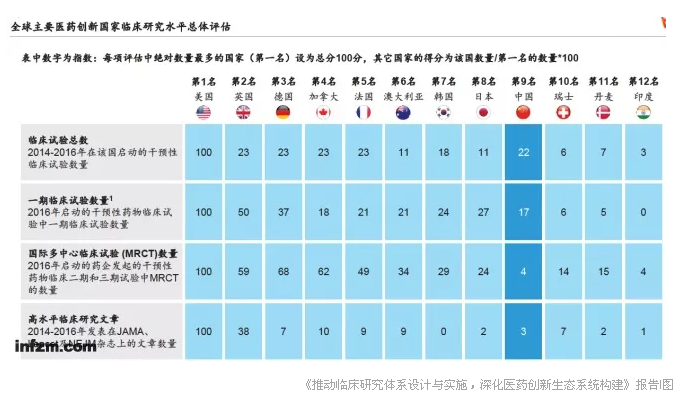
尽管参与临床研究的人逐渐增加,但好的临床研究人才和高质量成果依然稀缺,——依据2014-2016年数据对比显示,中国研究者在以临床研究为主的杂志《柳叶刀》《新英格兰杂志》及《美国医学会杂志》上发表的文章数量仅为美国的2.7%。
从国际上看,中国当前的临床研究总体水平在世界创新领先国家中排名第九,在亚洲位列日本和韩国之后,而美国在各项绝对数量都排名第一。
医生为什么没有动力做临床试验?
前述千人计划的窘境并非孤例,不少临床医学出身的研究者说,他们在申请基金、课题甚至“千人计划”等重大奖项时,屡屡碰壁。
“一评审就问成果论文原创性,说所做的临床研究项目根本没人听。”国内一位知名临床研究者向南方周末记者抱怨他和同行们的遭遇。
事实上,对于许多中国高发的严重疾病(如肝癌、胃癌、食道癌和乙肝),国际上缺少创新,急需通过临床研究收集中国人群的科学数据,制定适合的药物临床试验及诊疗方案,但衡量科技成果时,这类突破大多不被认为是“创新”。
过去15-20年,“重基础、轻临床”的现象随处可见。
首先表现在政府资金投入上,以2016年国家自然科学基金资助课题为例,在批准资助的医学科学相关的课题中,95%的课题为基础医学类,仅5%用于支持临床研究。同样,2016年国家重点研发计划启动生物医药相关项目共7大类299项,其中仅13%用于临床研究。
报告表明,医院和医生对参与临床研究缺乏动力。表面上看,这是因为高水平临床研究往往需要较大规模资金支持,试验开展周期长,对于研究者和支持团队的要求更高,因此参与者较少。但实际上,这和当前医院和医生的考评体系设定密切相关。
原因不难理解。
卫生部门管理医院主要是看中临床医疗,而非科研,即便是研究也需要拿成果说话。大的研究项目试验参与人数多达几千甚至上万,研究者众多,一些人甚至在文章中署名的机会都没有,更无法满足职称晋升所要求的文章发表数量。
而临床医生在参与临床研究和临床试验时更被视为是“分外之责”。
目前,中国的医院等级和专科评定标准中,临床研究所占比重极低。
《三级综合医院评审标准》中,总计636项条款中仅2条涉及临床试验,占比仅0.3%。国家临床重点专科评估中仅肿瘤和药学科涉及临床试验相关指标。《肿瘤科国家临床重点专科建设项目评分标准》共900分,临床试验占25分,仅0.3%。此外,卫计委尚未认可药物临床试验机构作为医院专科能力的体现,也没有相应评估标准。
“医院绝大多数人做临床试验和研究都是兼职工作,不仅付出多,回报少,在医院内部无论是述职、评优、晋升都没有任何优势,也没有制度保障。”北京大学第一医院国家药物临床试验机构主任崔一民感叹,他的另一个身份是医院药剂科主任。
这源于卫生行政部门对公立医院及医院负责人的绩效考核指标体系中,并不涉及临床试验完成量和水平;同时,科研相关指标在评定过程中对临床试验完成情况的认可度不高,如国家临床重点专科的认定、卫技人员科研项目成果的认定等。
但国家卫计委相关人员也告诉南方周末记者,他们也有难处:
「 卫生部门希望“临床医生看好病,科研人员做好科研”,但这是和“临床科研并重”冲突的。此外,现有的职称制度也无法招聘临床研究人员,“目前编制改革考虑增加这部分人员不太现实,就医生编制本身,中编办和卫计委的想法还有冲突”。」
影响临床研究发展的因素还有哪些?
报告还表示,中国临床审批依然存在一些障碍:
现阶段未实行临床试验申请默认制(临床试验申请审评时限60个工作日)的情况下,中国临床试验启动整体约需要14-20个月,而美国通常需要6-9个月时间,速度最快的韩国仅需4-6个月。
原因主要有以下三点:
其一,审批流程不尽合理:当前中国的审批流程中,临床试验申请(CTA)审批、伦理审查和遗传办审批以“串联”方式依次进行,整体流程不合理,耗时过长。
其二,多中心伦理审查效率较低:中国目前主要采用独立审查模式审查多中心临床试验,协作审查和中心审查模式尚未被广泛采用。此外,大部分伦理委员会的伦理审查流程和标准尚未统一。
其三,遗传办审批职能有所重复,且效率较低。目前,跨国企业或其它外方单位申办的在中国境内进行的药物临床试验为“国际合作”,需在开始前经科技部审批。
然而,报告认为,药物临床试验开始前,试验方案已经过了食药监总局和伦理委员会审批,方案设计的科学性和伦理性已经过充分评估,试验中要求采集的任何样本均为评估药物安全性和有效性所必须的。此外,会议现场企业代表还表示,遗传办审批步骤整体时限不确定,和医院沟通极少。
再不听取这些建议,瓶颈效应恐愈发凸显
为了进一步鼓励创新,推动临床研究能力提升,近期国家各部委出台了一系列政策:
2017年7月,科技部、卫计委、军委后勤保障部和食药监总局制定并印发《国家临床医学研究中心五年(2017-2021年)发展规划》、《国家临床医学研究中心管理办法(2017年修订)》和《国家临床医学研究中心运行绩效评估方案(试行)》三份文件,并提出了未来五年建设发展的短期目标和实施路径,这是临床研究体系建设顶层设计的重要成果。
临床研究者都期待未来政府能够进一步明确在推动战略实施过程中的角色,为能力建设和重点领域发展提供政府资金支持并建立跨部委协作机制,确保政策一致性,共同推进临床研究水平发展。
针对上述问题,报告提出了四部分具体建议:

该报告在——
中国外商投资企业协会药品研制和开发行业委员会
中国药学会药物临床评价研究专业委员会
北京大学亚太经合组织监管科学卓越中心
北京大学临床研究所
中国医药企业管理协会
中国化学制药工业协会
中国医药保健品进出口商会等机构的四十多位顾问专家的指导下共同完成。
查看更多