查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:复旦大学附属中山医院青浦分院 袁梦娇 韩辰宇
前 言
1970年日本学者Hirata报道了第一例胰岛素自身免疫综合征(insulinautoimmune syndrome,IAS),该疾病是指由血中非外源性胰岛素诱导的高浓度免疫活性胰岛素和高效价胰岛素自身抗体(IAA)所引起的以反复发作性、严重自发性低血糖为特征的一种疾病。现报道1例我院应用门冬胰岛素30后引发IAS的病例,旨在引起临床重视。
案例经过
患者男,45岁,10余年前无明显诱因出现乏力、口干,无明显多饮、多尿、体重下降、四肢麻木、视物模糊等,就诊于当地医院查餐后血糖12-13mmol/L(余结果不详),诊断为2型糖尿病,予口服格列齐特,后加用利格列汀降糖治疗。
2019年5月因血糖控制不佳,来我院内分泌科就诊,查胰岛素自身抗体阴性,空腹胰岛素4mU/L,评估病情后予加用门冬胰岛素30早12U、晚7U皮下注射。
2020年4月8日于我院内分泌科随访,查空腹胰岛素1000mIU/L、空腹C肽1.5nmol/L,抗胰岛素自身抗体阳性,故停用胰岛素,改为瑞格列奈早3mg、中1mg、晚2mg联合吡格列酮30mg qn降糖治疗至今。
入院后实验室检查:
表1 入院后监测指尖血糖
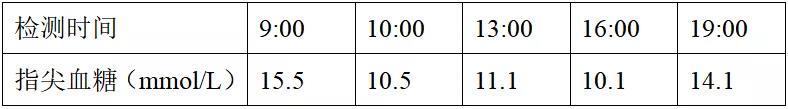
表2 OGTT延长实验及胰岛素、C肽释放试验

OGTT延长实验5h时出现低血糖,胰岛素、C肽释放实验示胰岛素、C肽均偏高,无明显5倍增长规律,且测得胰岛素自身抗体及谷氨酸脱羧酶抗体阳性,余甲状腺功能、皮质醇、肝肾功能、胰腺MRI等均无殊。综上所述,该患者诊断为胰岛素自身免疫综合征,予阿卡波糖早100mg、中50mg、晚50mg po降糖治疗。CCP19.36u/ml,Scl-70弱阳性。
随访:2020年8月2日于我院内分泌科复诊,行OGTT、胰岛素、C肽实验(如表3所示)。
表3 2020年8月2日OGTT、胰岛素、C肽实验结果
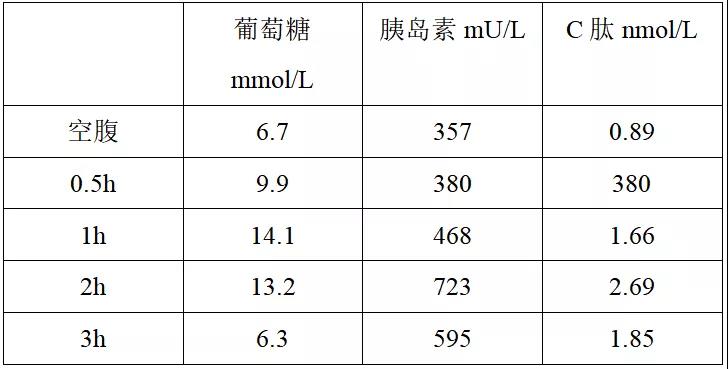
胰岛素、C肽释放实验仍示胰岛素、C肽偏高,无明显5倍增长规律,同时测得胰岛素自身抗体及谷氨酸脱羧酶抗体阳性。
案例分析
临床分析:
IAS是由于血中非外源性胰岛素诱导的高效价胰岛素自身抗体和高浓度免疫活性胰岛素所引起以反复性、严重自发性低血糖为特征的一种罕见疾病。IAS是低血糖的常见原因之一,具有低高血糖交替出现、高胰岛素血症、高胰岛素抗体的特点。
当抗体与胰岛素结合时,胰岛素不能发挥降糖作用,即出现高血糖,高血糖进一步刺激细胞释放胰岛素,后者又与抗体结合,造成了与抗体结合的胰岛素积聚。数小时后,由于亲合性低,与自身抗体结合的胰岛素-胰岛素抗体复合物发生解离,大量游离胰岛素释放而引起低血糖。
胰岛素自身抗体主要来源于1型糖尿病患者、IAS、一些自身免疫系统疾病(如Graves病、桥本氏甲状腺炎等)及应用外源性胰岛素后产生的胰岛素抗体等。
研究报道,糖尿病患者应用胰岛素连续治疗3个月以上,90%以上患者血中可检出胰岛素自身抗体,即便用高纯度或单组分或重组人胰岛素治疗者,胰岛素自身抗体的检出率也高达10%~30%。
本例患者2019年5月于我院查胰岛素自身抗体阴性,空腹胰岛素4mU/L,而应用门冬30胰岛素11个月后复查空腹胰岛素1000mIU/L、抗胰岛素自身抗体阳性,考虑是应用外源性胰岛素诱导自身抗体的产生。
检验分析:
患者OGTT延长实验、胰岛素、C肽释放试验结果提示存在明显高胰岛素血症,且5h后诱导低血糖,IAS诊断明确。测得CCP阳性、Scl-70弱阳性,考虑患者体内存在其他自身抗体。为明确胰岛素的检测是否受到自身抗体的干扰,我们用聚乙二醇(polyethyleneglycol,PEG)沉淀血清中自身抗体和结合胰岛素,具体方法如下:
配置25%PEG6000溶液:25g PEG6000与60mL蒸馏水混合,搅拌15min使完全溶解后补足蒸馏水至100mL
取2020年8月2日患者血清180μL与180μL25%PEG6000溶液1:1混合,振荡混匀10s后1500g离心15min。
利用罗氏e801仪器电化学发光法定量检测胰岛素。
计算回收率:回收率(%)=(2x处理后的胰岛素浓度/处理前胰岛素浓度)x100。若回收率<40%,说明由大分子蛋白干扰。
PEG可结合并沉淀血清中胰岛素自身抗体-胰岛素复合物,但对胰岛素这类小分子蛋白基本无影响。存在胰岛素自身抗体时,PEG沉淀后上清中胰岛素会明显低于沉淀前,从而证实胰岛素自身抗体的存在。
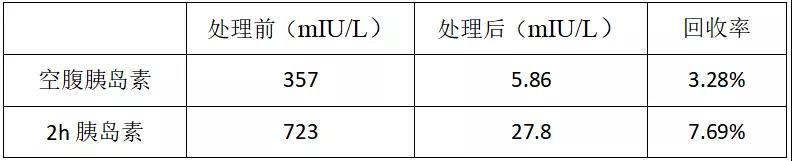
PEG沉淀法简单易行,可作为初筛试验,为诊断IAS提供证据。如表4所示,经PEG沉淀处理后两管血清胰岛素回收率仅为3.28%、7.69%,表明PEG沉淀处理可有效地排除血清自身抗体对胰岛素测定的干扰。
表4 PEG处理前后血清胰岛素
知识拓展
除PEG沉淀法,还可通过稀释试验、凝胶层析分离法等方法去除自身抗体对胰岛素检测的干扰。
稀释试验:通过以零胰岛素标准品等倍稀释血清标本,测定稀释前、后血清胰岛素水平。血清稀释会打破抗体结合胰岛素和游离胰岛素间平衡,使游离胰岛素增加,因此稀释前、后血清胰岛素呈非线性关系。该稀释实验可检测胰岛素抗体是否存在,但不能直接测定胰岛素自身抗体,其敏感性有待验证。
凝胶层析分离法:凝胶层析是按蛋白质分子质量大小进行分离的技术。由于IgG分子量大于胰岛素,若血清中存在胰岛素自身抗体-胰岛素免疫复合物,经凝胶层析柱时该复合物先于游离胰岛素洗脱出来,在大分子质量区间测的胰岛素水平为结合胰岛素水平。该方法相对复杂,对实验室技术要求较高,可作为胰岛素自身抗体的确诊和验证试验。该方法的局限是要求检测物质应有较高浓度,层析过程中导致的样品稀释会造成假阴性结果,稀释也可能引起游离胰岛素与结合胰岛素之间的稳态改变,导致最终检测的游离胰岛素和结合胰岛素水平较PEG沉淀法不同。
案例总结
血中胰岛素自身抗体不仅会干扰胰岛素的检测,还影响胰岛素的药代动力学,使胰岛素的生物效应与血糖的变化不同步,甚至抵消胰岛素的降糖作用产生类似胰岛素抵抗。本案例中检验科工作人员抽丝剥茧,通过PEG沉淀处理后测定血清游离胰岛素较好地排除自身抗体的干扰,也提醒我们平时工作中需保有存疑的态度,保证给出的检验报告是最真实、有效、无误的。
专家点评
龚倩 | 复旦大学附属中山医院青浦分院检验科主任 主任技师:本案例分析了在临床检验中容易忽视的问题,经过检验、临床分析讨论,找出影响检验结果的可能因素,是一个很好的案例分析。同时也提示临床医师平时工作中遇到与临床不符的检验结果时,需加强与检验科的沟通协作。
来源:检验医学
查看更多