查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





【食管癌规范化诊疗】专栏,意在通过邀请食管癌方向专家学者,分别从食管癌影像学诊断和疗效评估、手术治疗、放化疗、免疫治疗等方面进行梳理,探讨学术前沿,分享实践经验,提高诊疗能力,最终推进我国食管癌规范化诊疗。
今天我们邀请的是复旦大学附属肿瘤医院赵快乐教授,分享食管癌根治性同期放化疗的治疗规范及研究进展。
食管癌是我国五大恶性肿瘤之一,在全国新发恶性肿瘤中位居男性第三位,女性第五位,其致死率在所有恶性肿瘤致死率中位于第四位[1]。根治性同期放化疗是局部晚期食管癌非手术治疗的首选治疗方法,本文就食管癌根治性同期放化疗的治疗规范以及近年来的进展进行简要总结。
根治性同期放化疗中的放射治疗技术
随着放疗技术的进步及发展,如今食管癌放疗靶区的勾画应基于模拟定位CT,并应用增强造影剂,从而更好地确认靶区位置。调强放射治疗(Intensity Modulated Radiation Therapy,IMRT)是目前公认推荐应用的放疗技术,它被认为较三维适形放疗(3-Dimensional Conformal Radiotherapy,3DCRT)技术有更好的靶区适形性,并可减少重要脏器如心脏、肺等组织的受量。在食管癌的治疗过程中,正常组织的远期损伤是后期影响患者生存时间及生存质量的重要因素,因此,IMRT技术的应用为更严格的限制肺、心脏等重要脏器的剂量提供了有力的技术条件。
纵观近年来食管癌的研究,多项回顾性研究认为IMRT技术较3DCT技术可提高患者的局部控制率及生存。在IMRT技术的帮助下,局部晚期食管癌5年生存率从15%提高到44% [2]。但也有部分回顾性研究发现,两种放疗技术对患者生存并无显著影响,特别是对颈段食管癌患者,采用IMRT技术患者的总生存(OS)及无进展生存(PFS)与采用3DCRT技术的患者没有统计学差异[3]。因此,IMRT较3DCRT是否可提高食管癌或不同部位食管癌患者的疗效,目前仍存有争议。
对于新兴的质子放疗技术,目前仅有小样本的研究数据。在横向比较了37例接受质子治疗的食管癌患者的IMRT、3DCRT以及质子治疗的放疗计划后发现,质子治疗可显著降低肺和心脏的受量,这对进一步减少食管癌远期心脏损伤以及放射性肺炎的发生提供了有利的技术条件[4]。
另一项回顾性研究比较了211例采用IMRT治疗和132例采用质子治疗的食管癌根治性放疗患者疗效,结果显示质子治疗较IMRT治疗提高了患者5年OS率(41.6%比31.6%,P=0.011)和PFS率(34.9% 比20.4%,P=0.001),但在治疗相关毒副反应上两种技术并未见到显著的统计学差异[5]。质子放疗技术在食管癌的疗效和安全性方面的优势还有待前瞻性随机对照研究的证据支持。
因此,在目前的研究背景及技术条件下,有条件的单位应尽可能选择成熟的IMRT技术,这样能在确保患者疗效的前提下对正常组织有更优的保护。
根治性同期放化疗中的放射治疗剂量
食管癌根治性放化疗患者照射方式上应采用常规分割,分次剂量为1.8-2.0 Gy/次。食管癌根治性放射治疗剂量一直存在争议,根治性放疗总剂量欧美国家标准为50-50.4 Gy,而我国以及日本多采用60-70 Gy[6-7]。
RTOG9405研究中食管癌根治性放化疗高剂量组(64.8 Gy)在生存或局控上并未优于低剂量组(50.4 Gy),甚至在中位生存以及2年生存率绝对数值上劣于低剂量组[8]。除此之外,高剂量组有11例治疗相关死亡,而低剂量组仅有2例。因此,RTOG9405研究奠定了欧美国家将50-50.4 Gy作为食管癌同期放化疗标准放疗剂量的基础。然而,该剂量条件下的疗效并不乐观,2年生存率仅有36%-56%,3年生存26.9%-33%(表1)。
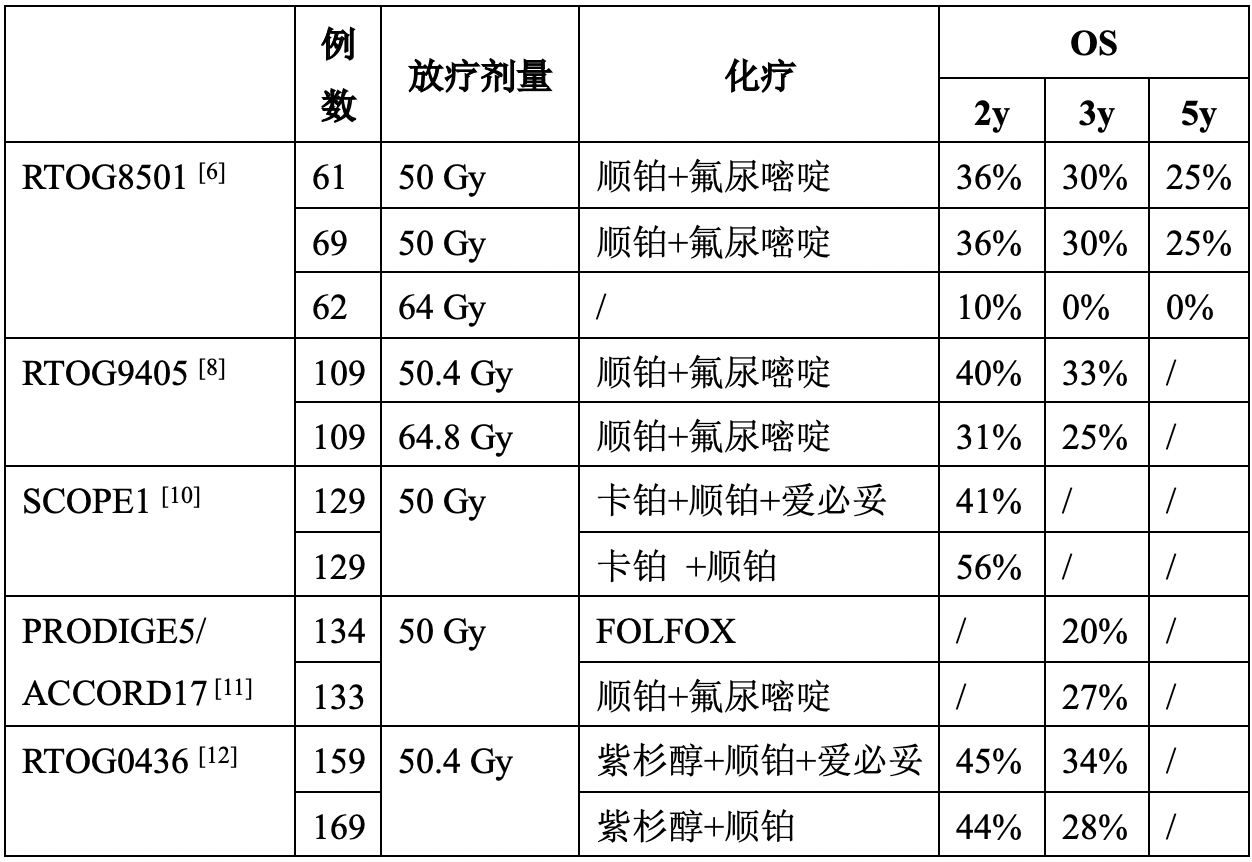
表1:食管癌高低剂量同期放化疗疗效对比
鉴于IMRT、3DCRT等三维放疗技术较二维放疗技术,优化了肿瘤受量的均匀性和对正常组织的保护,采用二维放疗技术的RTOG9405临床研究结果是否适用于当今三维调强放疗时代尚无定论。
2019年复旦大学肿瘤医院陈赟等发表的食管癌根治性同期放化疗不同化疗方案疗效对比的研究结果显示,患者采用61.2 Gy/34 Fx的放疗总剂量联合两种不同的化疗方案,3年OS均超过50%[9]。因此,在当今三维放疗技术普及的背景下,食管癌根治性放化疗采用欧美的50-50.4 Gy放疗剂量,或是我国常规的60-70 Gy放疗剂量尚需前瞻性随机对照研究证实。
目前,正在开展多项前瞻性多中心随机对照研究对比食管癌放疗高低剂量的疗效。Xu等对比了食管癌60 Gy放疗剂量与50 Gy放疗剂量的疗效,初步结果显示无论是局部控制、PFS还是OS,高低两组之间均无显著的统计学差异,与RTOG9405的研究结果相似[13]。法国正在开展的PRODIGE-26研究对比了食管癌同期加量至66 Gy放疗剂量与50 Gy放疗剂量的疗效,初步结果发现采用IMRT或VMAT技术增加放疗剂量并不会增加急性毒性反应或是损害患者的生存质量[14]。
笔者认为,不同的食管癌患者,个体所需的放疗剂量存在差异,肿瘤的体积、部位、以及放化疗反应等都是影响食管癌根治性同期放化疗疗效的重要因素,肿瘤的治疗需要量体裁衣。在此背景下,复旦大学附属肿瘤医院牵头开展了一项基于PET/CT评价疗效,对比局部晚期食管癌根治性放化疗高低剂量疗效(61.2 Gy 比50.4 Gy)的前瞻性多中心随机对照研究(ESO-Shanghai 12,NCT03790553),旨在探索最优的根治性同期放化疗剂量以及其相应的最适人群,同时探索PET/CT疗效评价对患者放疗剂量的指导意义。
综上所述,目前食管癌同期放化疗的标准放疗剂量仍然为50-50.4 Gy,我国常用剂量为60-70 Gy。但这一基于二维放疗时代的美国随机对照研究结果,在当今三维放疗时代下,尤其在我国,需要进行更多剂量优化的随机对照研究。
根治性同期放化疗中放射治疗的靶区
食管癌根治性放化疗中放疗靶区范围采用累及野照射(Involved Field Irradiation,IFI)或淋巴引流区预防照射(Elective Nodal Irradiation,ENI)一直存在争议。2010年,复旦大学附属肿瘤医院首次前瞻性设计和报道了食管癌三维适形放疗技术背景下的累及野照射技术和放疗疗效。研究发现预防照射是没有必要的,累及野放疗技术取得了较好的疗效,3年生存率为41%;野外区域淋巴结复发的概率低,仅占治疗失败患者的8%[15]。
此后,多项前瞻性研究和回顾性研究发现,IFI与 ENI的疗效基本相似[16]。Jiang等综述了多篇食管癌放化疗累及野照射与扩大野照射的对比研究,结果显示累及野照射并不会牺牲患者的总生存和局部控制率,且治疗副反应较扩大野照射明显减少[17],累及野照射的患者野外区复发的发生率只有2%-12.5%[18-19] 。
复旦大学附属肿瘤医院目前常规采用累及野照射[20]:肿瘤区(GTV)为食管原发灶+转移淋巴结;临床靶区(CTV)在食管GTV上下各勾画3 cm正常食管,转移淋巴结不外放CTV,计划靶区(PTV)为CTV向各个方向外扩1 cm。美国RTOG0113研究和英国的SCOPE1研究所采用的放疗靶区也为类似的累及野照射技术[10,21]。淋巴引流区预防照射的放疗靶区范围目前尚未统一。部分研究者主张预防整个食管癌区域淋巴结,或双侧锁骨上等食管癌淋巴结转移高危区域,或原发灶附近的淋巴结引流区。例如,RTOG0436研究中颈段食管癌采用双侧锁骨上淋巴结区预防照射,下胸段食管癌采用腹腔干淋巴结区预防照射[12]。
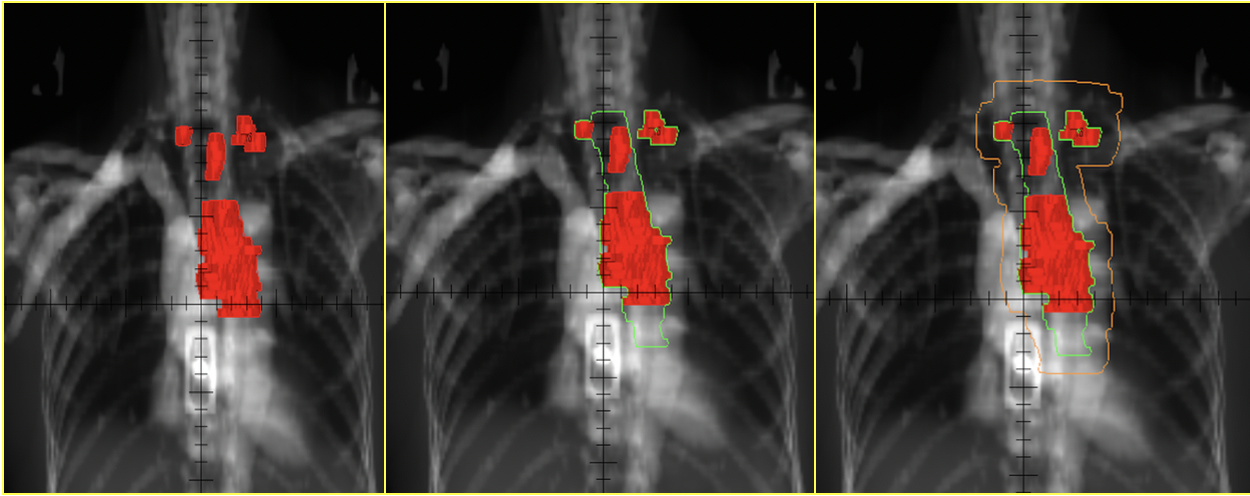
累及野照射。红色为GTV,绿色为CTV,橘黄色为PTV
由此可见,鉴于累及野放疗与淋巴引流区预防放疗有相似的疗效和野外失败率,但累及野相对较小的照射野有助于正常组织限量,降低治疗副反应,因此推荐食管癌放疗采用累及野照射。
根治性同期放化疗中同期化疗的方案
RTOG8501研究奠定了同期放化疗在食管癌非手术治疗中的地位,该研究同期化疗方案为顺铂联合氟尿嘧啶,此后,该方案一直作为食管癌根治性同期放化疗临床研究中的标准对照。然而,RTOG8501研究显示顺铂联合氟尿嘧啶方案毒副作用较显著,疗效仍不尽如人意,3级及以上严重不良反应达62.5%,5年生存率仅有20%[6]。因此,探索新的既能放射增敏又高效低毒的同期化疗方案是提高局部晚期食管癌非手术治疗患者疗效的重要途径之一。
2014年法国开展的3期多中心随机对照研究对比了食管癌根治性放化疗中FOLFOX方案与标准的顺铂联合氟尿嘧啶方案的疗效,研究结果显示两组患者总生存率和无进展生存率均无统计学差异,但FOLFOX方案用药方式较顺铂联合氟尿嘧啶方案更加便利[11]。
2019年《临床肿瘤学杂志》(J Clin Oncol)刊登了复旦大学附属肿瘤医院陈赟等的一项前瞻性随机对照3期临床研究(ESO-Shanghai 1),该研究对比了食管癌根治性放化疗患者以紫杉醇为基础的同期化疗方案与顺铂联合氟尿嘧啶同期化疗方案的疗效[9]。研究结果显示紫杉醇联合氟尿嘧啶方案较顺铂联合氟尿嘧啶方案并没有显著提高患者的3年生存率(55.4% 比51.8%),但两种同期化疗方案的副反应截然不同,紫杉醇联合氟尿嘧啶方案较顺铂联合氟尿嘧啶方案可明显减少3级及以上恶心、呕吐、厌食、疲乏、贫血及血小板减少等早期不良反应的发生率,但会增加早期3级及以上白细胞下降、放射性皮肤损伤及放射性肺炎的发生率。
该研究采用的顺铂联合氟尿嘧啶方案化疗剂量强度较RTOG8501研究及PRODIGE5/ACCORD17研究采用的低(顺铂25mg/m2 d1-3 +氟尿嘧啶 1800mg/m2 civ72h 比顺铂75mg/m2 d1+氟尿嘧啶4000mg/m2 civ96h),但放疗剂量较这两个研究高(61.2 Gy比50-50.4 Gy)[6,11]。这种“低化疗强度高放疗剂量”的中国模式疗效相较“高化疗强度低放疗剂量”的欧美模式更优(表2)。
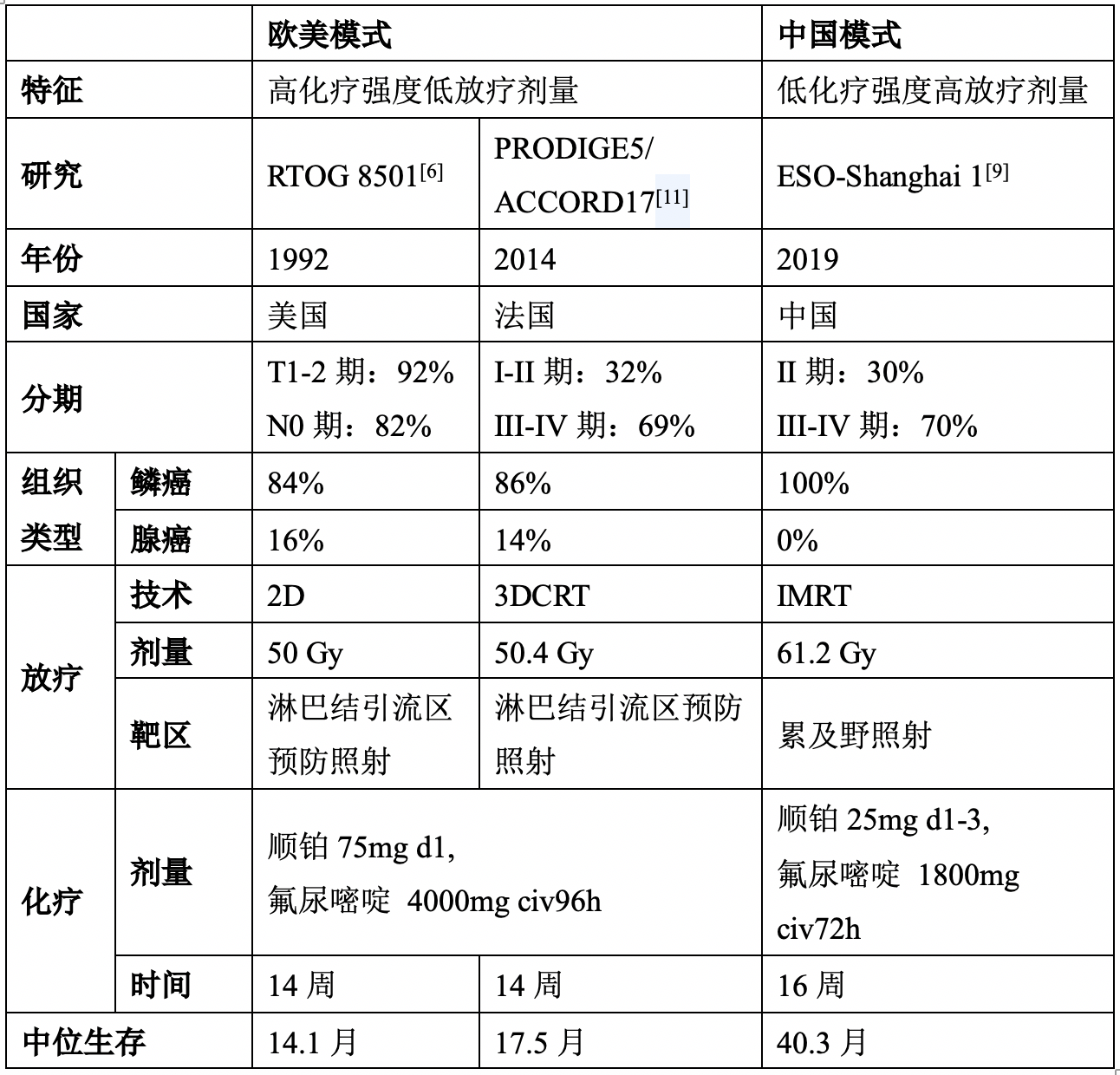
表2:食管癌根治性放化疗中国模式与欧美模式的比较
因此,顺铂联合氟尿嘧啶仍为食管癌根治性同期放化疗的标准化疗方案,FOLFOX方案以及紫杉醇联合氟尿嘧啶方案为可选择的同期化疗方案。不同化疗方案间的毒副反应差别较大,临床实践中可根据患者实际情况进行选择。
总结
根治性同期放化疗是局部晚期食管癌非手术治疗的首选治疗方法。放疗技术首选IMRT放疗技术,放疗靶区采用累及野照射,放疗剂量在欧美国家采用50-50.4 Gy,中国多采用60-70 Gy,常规分割。化疗方案可采用顺铂联合氟尿嘧啶,FOLFOX方案以及紫杉醇联合氟尿嘧啶方案。
参考文献
[1] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015. CA Cancer J Clin. 2016, 66(2):115-32.
[2] Li CC, Chen CY, Chien CR. Comparison of intensity-modulated radiotherapyvs3-dimensionalconformal radiotherapy for patients with non-metastaticesophageal squamous cell carcinomareceivingdefinitiveconcurrent chemoradiotherapy: A population-based propensity-score-matched analysis. Medicine (Baltimore). 2018, 97(22):e10928.
[3] Chen NB, Qiu B, Zhang J, et al. Intensity-Modulated RadiotherapyversusThree-Dimensional Conformal Radiotherapy in DefinitiveChemoradiotherapy for CervicalEsophageal Squamous Cell Carcinoma: Comparison of SurvivalOutcomes and Toxicities. Cancer Res Treat. 2019 Apr 30. doi: 10.4143/crt.2018.624.
[4] Hirano Y, Onozawa M, Hojo H, et al.Dosimetriccomparison between protonbeamtherapy and photonradiationtherapy for locallyadvancedesophagealsquamouscellcarcinoma. Radiat Oncol. 2018, 13(1):23.
[5] Xi M, Xu C, Liao Z, et al. Comparative Outcomes After Definitive Chemoradiotherapy Using Proton Beam Therapy Versus Intensity Modulated Radiation Therapy for Esophageal Cancer: A Retrospective, Single-Institutional Analysis. Int J Radiat Oncol Biol Phys. 2017, 99(3):667-676.
[6] Cooper JS, Guo MD, Herskovic A, et al: Chemoradiotherapy of locally advanced esophageal cancer: long-term follow-up of a prospective randomized trial (RTOG 85-01). Radiation Therapy Oncology Group. JAMA 1999,281:1623-7.
[7] Esophageal Carcinoma Cooperative Group of Radiation Oncology Society of Chinese Medical A: Treatment guideline of radiotherapy for Chinese esophageal carcinoma (draft). Chin J Cancer 2010, 29:855-9.
[8] Minsky BD, Pajak TF, Ginsberg RJ, et al: INT 0123 (Radiation Therapy Oncology Group 94-05) phase III trial of combined-modality therapy for esophageal cancer: high-dose versus standard-dose radiation therapy. J Clin Oncol 2002,20:1167-74.
[9] Chen Y, Ye J, Zhu Z, et al. Comparing Paclitaxel Plus Fluorouracil Versus Cisplatin Plus Fluorouracil in Chemoradiotherapy for Locally Advanced Esophageal Squamous Cell Cancer: A Randomized, Multicenter, Phase III Clinical Trial. J Clin Oncol. 2019, 37:1695-1703.
[10] Crosby T, Hurt CN, Falk S, et al. Chemoradiotherapy with or without cetuximab in patients with oesophageal cancer (SCOPE1): a multicentre, phase 2/3 randomised trial. Lancet Oncol. 2013, 14(7):627-37.
[11] Conroy T, Galais MP, Raoul JL, et al: Definitive chemoradiotherapy with FOLFOX versus fluorouracil and cisplatin in patients with oesophageal cancer (PRODIGE5/ACCORD17): final results of a randomised, phase 2/3 trial. Lancet Oncol 2014, 15:305-14.
[12] Suntharalingam M, Winter K, Ilson D, et al.Effect of the Addition of Cetuximab to Paclitaxel, Cisplatin, and Radiation Therapy for Patients With Esophageal Cancer: The NRG Oncology RTOG 0436 Phase 3 Randomized Clinical Trial. JAMA oncology 2017, 3(11):1520-1528.
[13] Yanjun Xu, Weiguo Zhu, Xiao Zheng, et al. A multi-center, randomized, prospective study evaluating the optimal radiation dose of definitive concurrent chemoradiation for inoperable esophageal squamous cell carcinoma.J Clin Oncol 2018 36:15_suppl, 4013-4013.
[14] Gilles Crehange, Aurelie Bertaut, Didier Peiffert, et al. Exclusive chemoradiotherapy with or without dose escalation in locally advanced esophageal carcinoma: The CONCORDE study (PRODIGE 26). J Clin Oncol 2017 35:15_suppl, 4037-4037.
[15] Li M, Zhang X, Zhao F4, et al. Involved-field radiotherapy for esophageal squamous cell carcinoma: theory and practice. Radiat Oncol. 2016, 11:18.
[16] Liyang Jiang, Xin Zhao, Xue Meng et al. Involved field irradiation for the treatment of esophageal cancer: Is it better than elective nodal irradiation? Cancer Letters 2015, 357 (1) 69–74.
[17] Zhao KL, Ma JB, Liu G, et al. Three-dimensional conformal radiation therapy for esophageal squamous cell carcinoma: is elective nodal irradiation necessary? Int J Radiat Oncol Biol Phys. 2010, 76(2):446-451.
[18] Jin-Bo Ma, Yi-Peng Song, Jin-Ming Yu et al.Feasibility of Involved-Field Conformal Radiotherapy for Cervical and Upper-Thoracic Esophageal Cancer. Onkologie 2011, 34(11):599–604.
[19]Zhang X, Li M, Meng X, et al. Involved-field irradiation in definitive chemoradiotherapy for locally advanced esophageal squamous cell carcinoma. Radiation Oncology 2014, 9:64.
[20] Zhao KL, Ma JB, Liu G, et al. Three-dimensional conformal radiation therapy for esophageal squamous cell carcinoma: is elective nodal irradiation necessary? Int J Radiat Oncol Biol Phys. 2010; 76(2):446-51.
[21] Ajani JA, Winter K, Komaki R, et al. Phase II randomized trial of two nonoperative regimens of induction chemotherapy followed by chemoradiation in patients with localized carcinoma of the esophagus: RTOG 0113. J Clin Oncol. 2008;26(28):4551-6.
作者 | 陈赟 赵快乐(复旦大学附属肿瘤医院)
编辑 | 刘婷(中国医学论坛报)
查看更多