查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





免疫治疗为恶性肿瘤治疗带来了革命性变化,但由于免疫系统的激活,活化的免疫状态可能引起靶器官免疫相关不良反应,总体而言免疫相关不良反应各个系统都有表现,任何器官和组织,都有可能受累,胃肠道及肝脏不良反应也时有发生。大多数免疫相关不良事件(irAE)为轻到中度,但有约10%严重的或危及生命的irAEs也有发生。本文参考中国临床肿瘤学会 (CSCO)指南介绍肝脏及胃肠道免疫治疗不良反应处理及管理。
主要表现为丙氨酸氨基转移酶(ALT)和/或天冬氨酸氨基转移酶(AST)升高,伴或不伴有胆红素升高。一般无特征性的临床表现,有时伴有发热、疲乏、食欲下降、早饱等非特异性症状,胆红素升高时可出现皮肤巩膜黄染、茶色尿等。症状也可来自同时发生的其他脏器毒性,如结肠炎、甲状腺炎或肺炎等。
肝毒性可发生于首次使用ICI后任意时间,最常出现在首次用药后8-12周。接受细胞毒T淋巴细胞相关抗原4(CTLA-4)抑制剂(联合或不联合程序性死亡受体1(PD-1)抑制剂)的患者出现肝毒性的时间相对更早。
肝毒性的发生率差异很大,从0.7%~16%不等,联合治疗比例发生率高。任何级别的肝毒性发生率在PD-1抑制剂中最低(0.7%~2.1%),在细胞程序性死亡-配体1(PD-L1)抑制剂和标准剂量CTLA-4抑制剂中居中 (0.9%~12%),在CTLA-4/PD-1抑制剂联合治疗(13%)和高剂量CTLA-4抑制剂(16%)治疗中最高;3/4级肝毒性的总发生率为0.6%~11%,高剂量CTLA-4抑制剂更常见。ICIs联合TKI相对ICIs单药或联合贝伐珠单抗发生肝损伤的概率和严重程度可能增加。
ICIs相关性肝毒性主要分肝细胞型(hepatitis)、胆管炎型(cholangitis)和混合型(mixed)三种类型,其中肝细胞型大约占一半。胆管炎型及混合型由于其对类固醇治疗不敏感、预后相对较差,近年来越来越被人们所重视。相比于CTLA-4抑制剂,PD-1/PD-L1抑制剂更容易发生胆管炎。
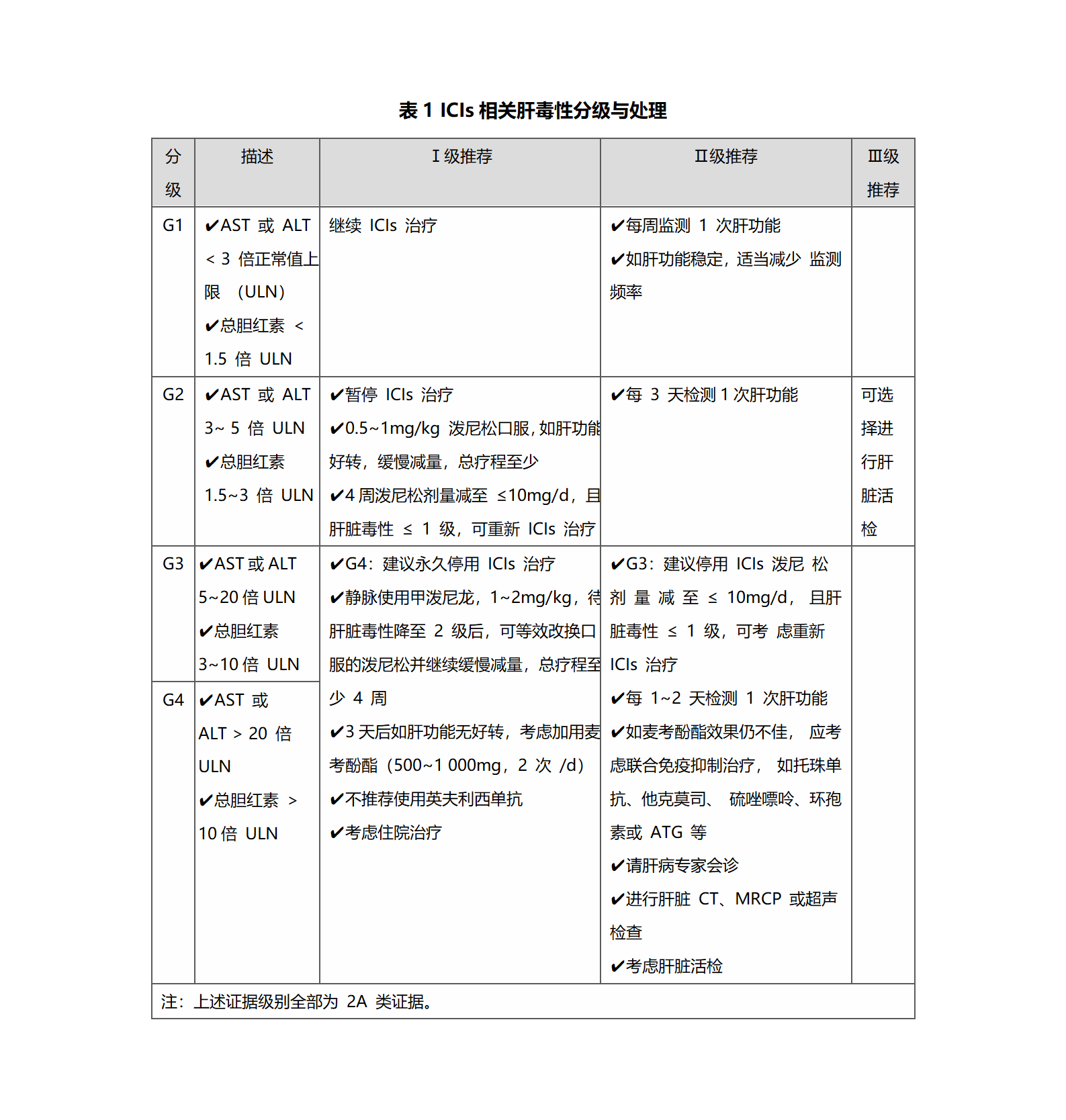
需排除活动性病毒性肝炎(HBV、HCV、CMV等)、其他疾病导致的肝脏损伤(如脂肪肝、酒精肝等)、其他药物导致的肝损伤、自身免疫性肝炎、肝脏原发肿瘤或肝转移瘤进展、各种原因引起的胆道梗阻等。初次ICIs治疗前应全面评估肝脏功能,了解排查有无基础肝脏疾病,包括病毒性肝炎、脂肪肝、酒精肝、自身免疫性肝炎等,不建议在肝移植后进行ICIs治疗。如果基线存在肝转移,可在相当于2级肝脏毒性以内的肝功能水平进行ICIs治疗;当发生肝毒性,ALT/AST升高超过基线50%,并持续1周以上,建议永久停止ICIs治疗。影像学表现取决于肝脏毒性的严重程度,一般情况下大多表现正常。在严重肝损伤的患者中,CT显示类似于其他常见病因引起的急性肝炎表现,即轻度肝肿大、肝实质减弱、门脉周围水肿和门脉周围淋巴结病等。肝脏超声可见门静脉周围回声,伴或不伴有胆囊壁水肿。胆管炎型在磁共振水成像(MRCP)及CT上的表现常见为胆管壁增厚、胆管扩张或狭窄。建议对诊断不明和≥G3的ICIs相关性肝毒性患者进行肝活检,特别在胆管炎型,用于了解肝损伤的特征和严重程度,同时排除其他原因引起的肝功能异常。根据ALT或AST水平及总胆红素上升的比例肝毒性分为四级,即G1-G4(见表1)。
肝毒性的治疗及后续处理(详见表1)
应首先需减少或停用其他可能引起肝脏损伤的药物。肝细胞型预后相对较好,通常对类固醇治疗有效,较少发生肝衰竭和死亡。大多数患者在1-3个月恢复至基线肝功能状态。胆管炎型和混合型预后相对较差,对糖皮质激素和免疫抑制剂治疗不敏感。G2肝脏毒性的患者好转后再次启用ICIs治疗,大多数不再反复。G3及以上肝损伤患者,再次启用ICIs治疗发生严重肝脏损伤的概率增加。G3肝毒性后是否再次启用ICIs治疗,需由多学科诊疗团队(MDT)讨论后决定,G4肝毒性则永久停用ICIs治疗。CTLA-4抑制剂(单药或联合 PD-1/PD-L1抑制剂)治疗后发生肝毒性者,选择PD-1抑制剂再次出现肝毒性的风险较低。类固醇激素难治性肝毒性加用麦考酚酯,也可积极尝试包括他克莫司、脉冲式类固醇冲击、托珠单抗、ATG或血浆置换等。英夫利西单抗因其自身潜在的肝毒性,建议在肝毒性患者中谨慎考虑。胆管炎型可联合熊去氧胆酸(UDCA)治疗,并且可在初始糖皮质激素治疗的同时联合免疫抑制剂,以增强缓解率。
HCC合并病毒性肝炎(携带HBV或HCV)的患者使用ICIs的管理
在全程管理病毒性肝炎的前提下,BV/HCV感染者可以安全使用ICIs。对于合并HBV感染的患者,需在HBV-DNA低于2000IU/ml后再开始ICIs治疗(临床试验中常常要求低于500IU/ml)。即使HBV-DNA定量不高,如果HBsAg(+)和/或HBcAb(+),也推荐在首次ICIs使用前给予抗病毒治疗(推荐核苷类似物,如恩替卡韦或替诺福韦酯),并定期监测HBV-DNA和HBV表面抗原和抗体;对于合并HCV感染者,无须在ICIs治疗的同时接受DAAs或干扰素抗病毒治疗,但仍需定期监测 HCV-RNA水平。
胃肠毒性包括结肠炎、胃炎、小肠结肠炎,主要为结肠炎,是ICIs治疗最常见的毒性之一,G3~4免疫相关胃肠道毒性是导致ICIs治疗中断的常见原因。
腹泻一般发生在平均三次治疗之后,此外,腹泻和/或结肠炎可在免疫治疗中止后的数月后出现,临床表现类似于慢性炎症性肠病。ICIs导致的结肠炎发生率为8%-7%。CTLA-4抑制剂导致的胃肠道毒性发生风险远远高于PD-1/PD-L1抑制剂并且可发生于治疗过程中的任意时间,甚至治疗结束后数月。PD-1/PD-L1抑制剂的胃肠道毒性发生的中位时间为用药后6-8周。以上两类药物的联合使用会显著提高胃肠道毒性的发生风险,并且导致发生时间提前。
大多数患者病变累及乙状结肠和直肠,上消化道改变罕见,内镜下多表现为黏膜红斑、糜烂、溃疡形成。临床主要表现为腹泻,还可发生腹痛、恶心、粪便带血和黏液、发热等症状,少部分患者还可表现为口腔溃疡、肛门病变(肛瘘、脓肿、肛裂)及关节疼痛、内分泌紊乱、皮肤病变等肠外表现。发生腹痛、腹泻等症状的患者要警惕免疫相关性胃肠毒性的可能。对于严重腹泻或持续的2级及以上的腹泻患者推荐弯结肠镜或结肠镜检查以进一步明确诊断。已有一些研究探索了生物标志物在诊断胃肠毒性中的作用。如钙卫蛋白(Calprotecin)和乳铁蛋白(Lactoferrin),可作为肠炎诊断和监测治疗疗效的指标,但在诊断上仍需要进一步研究确证。胃肠道毒性作用根据症状分为四级,即G1-G4(见表2)。
大部分ICIs治疗引起的胃肠毒性均能够得到很好控制。对于胃肠毒性后再次使用ICIs需要根据具体情况平衡风险,原则上G2-3暂停,毒性缓解后可以考虑再次尝试;G4永久停用(见表2)。

ICIs治疗相关肝及胃肠道不良反应比较常见;不同种类药物发生比例及时间均有差异。激素是治疗轻中度irAE的主要药物;若irAE明显需要停用ICIs治疗。
查看更多