查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





胆管细胞型肝癌是原发性肝癌中恶性程度较高、侵袭性较强、预后极差的一种类型,约占原发性肝癌的10%~15%。由于起病隐匿,临床症状不典型,多数胆管细胞型肝癌患者确诊时已属中晚期,仅有30%-40%的初诊患者可接受手术治疗。化疗是晚期胆管细胞型肝癌的主要治疗手段,近年来,免疫治疗、靶向治疗等手段的不断涌现、联合治疗模式的成功探索,为胆管细胞型肝癌带来了疗效的提升,并有望实现由无法手术到能够手术的巨大跨越。本期将分享1例晚期胆管细胞型肝癌患者的诊疗经过,患者经免疫+靶向+化疗方案治疗后,成功实现手术转化。
丁月超 教授
河南省肿瘤医院
肝胆胰外科 副主任医师
河南省抗癌协会胰腺癌专业委员会常务委员
河南省抗癌协会肿瘤消融治疗委员会副主任委员
河南省抗癌协会胰腺癌专业委员会青年委员会副主任委员
河南省抗癌协会肝癌专业委员会委员
河南省抗癌协会胆道肿瘤专业委员会委员
河南省抗癌协会胰腺癌专业委员会秘书
河南省抗癌协会重症医学专业委员会委员
河南省抗癌协会腹膜后专业委员会委员
郑鹏 教授
河南省肿瘤医院
肝胆胰外科三病区主治医师
河南省抗癌协会分子肿瘤学委员会青年委员
河南省抗癌协会胆道肿瘤专业委员会青年委员
研究方向:肝胆胰恶性肿瘤的诊治
患者女性,51岁,于2020年11月就诊。
主诉:间断发热两月,发现肝占位3天。
既往史:否认乙肝、丙肝病史。
肿瘤标志物:CEA 101.50 ng/mL;CA199 931.20 U/mL。
腹部CT:肝左叶占位(35mm×47mm),肝左静脉、门脉左支显示不清,考虑受侵;肝左内叶囊性肿块;肝门及腹膜后多发肿大淋巴结(短径20mm),局部与肝总管、胆总管分界不清;如图1所示。
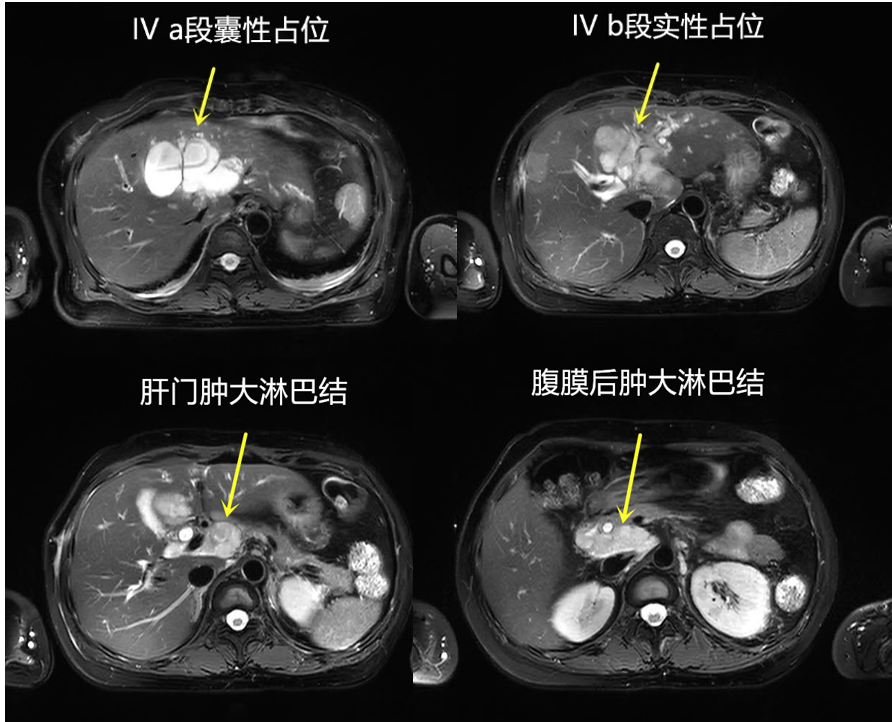
图1 治疗基线腹部CT
胃肠镜检查:慢性浅表型胃炎。
病理诊断:(肝活检)恶性肿瘤,粘附性差,倾向低分化腺癌。
免疫组化:AFP-,Arg-1-,CD10-,CD34血管+,CK19灶+,CK7-,CK8/18+,GP-3-,Hep灶+,Ki67+20%,CDX-2灶+,Vim-,CK20-。
胃肠镜检查:排除胃肠道癌肝转移。
诊断:1.胆管细胞型肝癌,T3N1M0 ⅢB期 2. 肝囊肿并感染
患者入院后反复高热,体温最高达40°C,考虑肝囊肿并发感染,穿刺置管,引流出黄褐色脓液,细菌培养肺炎克雷伯菌,敏感抗生素治疗,感染得到有效控制。
治疗方案:替雷利珠单抗+仑伐替尼+GEMOX方案(吉西他滨+奥沙利铂)。
疗效评价:患者治疗前肝脏病灶长径+淋巴结短径和67mm,3周期、6周期治疗后复查腹部CT(如图2所示),肝脏病灶长径+淋巴结短径和分别为43mm、38mm,分别缩小36%、43%;CEA及CA199均逐渐降至正常范围(图3);疗效评价为持续PR。
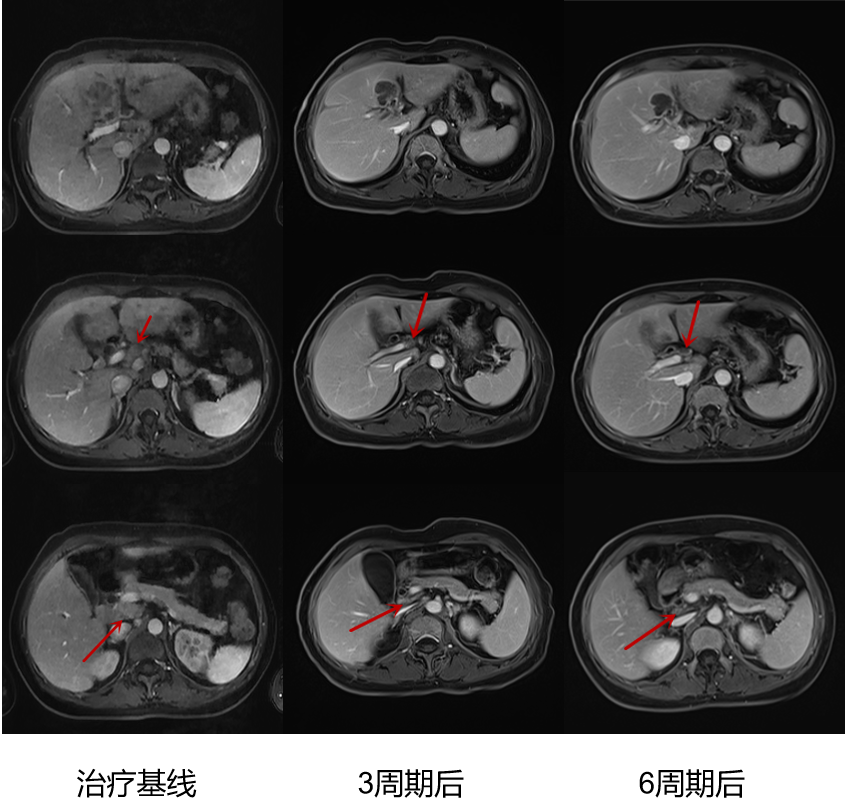
图2 患者治疗前后影像学检查
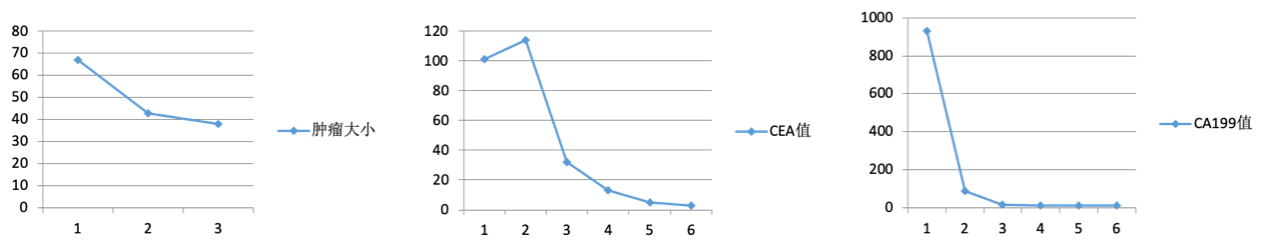
图3 治疗前后肿瘤大小、CEA、CA199变化
安全性评价:患者治疗期间曾先后出现高血压(2级)、食欲下降(1级)、骨髓抑制(2度),在可控范围内。
治疗方案:患者于2021年4月14日行左半肝切除+胆囊切除+淋巴结清扫术,术中如图4所示。
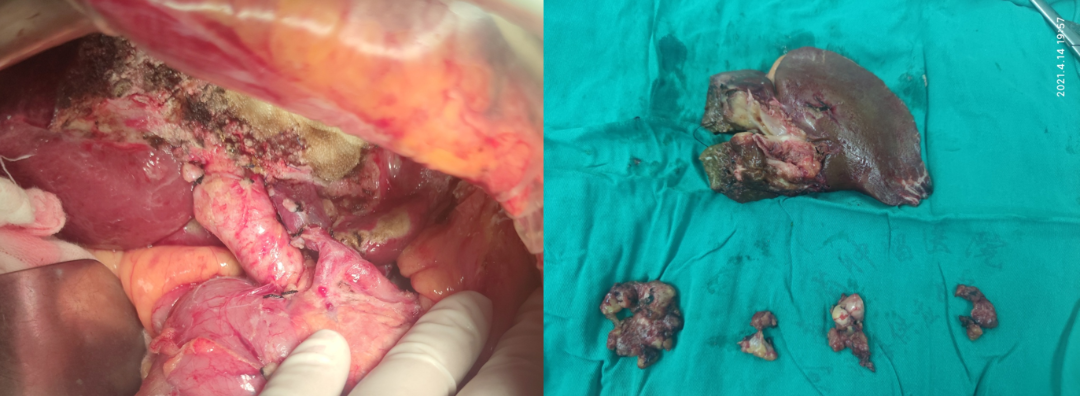
图4 患者术中与术后大体标本
术后病理:肝管内见肿物2.0×2.0×1.3cm,灰黄灰红,质中到质稍韧;组织内见严重退变的异型细胞残影及粘液湖,肿瘤退变坏死明显,符合治疗后改变,未见脉管癌栓和神经侵犯。术后病理评价为pCR。8a、8p、12a、12b、12p、13组淋巴结未见转移征象,淋巴结内见化疗反应。
疗效评价:病理学完全缓解(pCR)
本例患者因“间断发热两月,发现肝占位3天”就诊,根据穿刺活检病理结果,诊断为胆管细胞型肝癌,T3N1M0 ⅢB期。入院后因肝囊肿并发感染予穿刺置管引流及抗感染治疗,感染得到有效控制。经患者充分知情同意并签署知情同意书后,予以“替雷利珠单抗+仑伐替尼+GEMOX(吉西他滨+奥沙利铂)”联合治疗方案。治疗六个周期后复查患者CEA、CA199下降至正常,肿瘤明显缩小,根据RECIST 1.1标准疗效评价为PR。患者体能状态、肝功能及肝脏储备功能良好,影像学评估可达到R0切除,故行左半肝切除+胆囊切除+淋巴结清扫,术后病理显示肿瘤退变坏死明显,符合治疗后改变,未见脉管癌栓和神经侵犯,淋巴结阴性,疗效评价为pCR。
黄涛 教授
主任医师 博士 硕士生导师
河南省肿瘤医院肝胆胰外科三病区主任
中国抗癌协会肝癌专业委员会委员
中国医疗保健促进会胰腺分会委员
河南省抗癌协会胰腺癌专委会主任委员
河南省抗癌协会肝癌专委会副主任委员
郑州市医学会外科分会副主任委员
Hepatology中文版编委
胆管细胞型肝癌是发病率第二的原发性肝癌,占肝脏原发恶性肿瘤的10%~15%。胆管细胞型肝癌早期无明显症状,患者多因黄疸或周围压迫不适感就医,病情就已进展到中晚期,丧失手术根治的机会。根治性手术是胆管细胞型肝癌获得长期生存的治疗方式,但术后复发率高达60%~70%,5年生存率仅为30%[1]。对于晚期胆管细胞型肝癌,NCCN指南和CSCO指南均推荐吉西他滨联合铂类的化疗策略为一线治疗方案,但其应答率不高[2]。多项研究表明,GEMOX方案一线治疗晚期胆管癌患者的总生存(OS)约8~15个月[3-6],晚期胆管细胞型肝癌患者的生存获益仍有很大提升空间。
对于大部分无法直接手术切除的晚期胆管细胞型肝癌患者而言,转化治疗有望实现肿瘤降期,提高R0切除率,是目前临床关注的重点。随着对ICC基因组的深入了解和新的治疗药物的开发及组合,基于系统化疗的联合治疗策略,精准靶向治疗,免疫检查点抑制剂等显示出较好的疗效,使得部分进展期晚期胆管细胞型肝癌病人能降期转化手术,获得长期生存。近年来,针对晚期胆管细胞型肝癌的转化治疗,进行了诸多探索,但仍以小样本研究为主。
Kato等[7]发现使用吉西他滨化疗可使不可切除的22例(22/142)胆道癌病人实现肿瘤缩小降期,而其中8例病人实现了转化手术,取得了长期生存。针对PD-1单药获益率低及获益人群少,联合治疗正在不断探索[8]。前瞻性研究报道[9]PD-1抑制剂联合吉西他滨和顺铂,能为不可切除或复发胆道癌患者带来37%的客观缓解率(ORR),中位无进展生存期(PFS)和总生存期(OS)分别为4.2个月和15.4个月。另外一项研究[10]显示,在进展期胆道癌患者中使用PD-1抑制剂联合仑伐替尼的ORR为30.4%,疾病控制率(DCR)为85.7%,中位PFS为5.0个月,中位总体生存期为11.0个月,且PD-L1表达阳性的病人获益更多。
在2020年的ESMO年会上,公布了一项2期临床研究结果,该研究探索了PD-1联合靶向及GEMOX的三联四药联合方案一线治疗晚期和不可切除胆管细胞型肝癌的疗效[11],获得了令人鼓舞的效果。研究入组30例患者,结果显示,ORR高达80%,DCR达93.3%;mOS和mPFS尚未达到,6个月生存率高达90%。研究中有2例局部转移患者临床分期降级后进行了手术治疗。该研究中绝大部分的患者肿瘤有缩小,即意味着可以让更多患者由不可手术转化为可手术,为晚期胆管细胞型肝癌的转化治疗提供了新思路。
该例患者确诊为胆管细胞型肝癌,T3N1M0 ⅢB期,无法根治性切除,故先行系统治疗。考虑到患者年轻、既往体健,综合评估后为患者选择了替雷利珠单抗+仑伐替尼+GEMOX的治疗方案,以期在肿瘤缩小后有手术根治可能。患者经过6个周期的治疗,肝肿瘤明显缩小,肝门及腹膜后淋巴结由治疗前融合成团、短径20mm缩小为几乎不可见,
疗效评估为PR。因患者体能状态维持良好,具备手术条件,影像学评估可以达到R0切除,故行手术治疗。术后病理结果显示达到pCR。在整体治疗安全性方面,患者的耐受性较好,出现的不良反应均为常见的类型,且均为1-2度,对症处理后好转,并未影响治疗进程或增加手术难度。该病例证实了在晚期胆管细胞型肝癌患者中,免疫+靶向+化疗的三联四药联合方案能够为无法手术的患者提供降期切除的机会。
本例患者应用的PD-1抑制剂是由我国百济神州自主研发的替雷利珠单抗,其已在多种实体瘤中展现了值得肯定的疗效优势。替雷利珠单抗的Fab段与PD-1的结合面与PD-1/PD-L1结合面大量重叠,能够更彻底阻断PD-1/PD-L1的结合,发挥强大阻断作用[12-13]。替雷利珠单抗Fc段进行了独特改造,不介导免疫细胞交联,无论是否存在FcyR+免疫细胞,均可有效阻断PD-1信号通路,保持T细胞杀伤作用[13]。研究发现PD-1抗体的清除与患者的疗效相关,疗效获益越好的患者,抗体的清除率越低[13-14]。替雷利珠单抗的多种特点使其在免疫治疗领域更具优势。期待其在未来的持续探索中,能够不断丰富临床医学证据,为临床用药提供更多指导。
参考文献
1. Chun YS, et al. Cancer Control, 2017, 24(3):1073274817729241.
2. Valle J,et al.N Engl J Med,2010,362(14):1273-1281.
3. T André, et al. Ann Oncol, 2004, 15(9):1339-43.
4. J Harder, et al. Br J Cancer, 2006, 95:848 – 852.
5. Joung-Soon Jang, et al. Cancer Chemother Pharmacol, 2010, 65(4):641-7.
6. Manzione L, et al. Oncology, 73:311-315.
7. Kato A, et al. Ann Surg Oncol, 2013, 20(1): 318-324.
8. Wang D, et al. J Hematol Oncol, 2019, 12(1): 42.
9. Ueno M, et al. Lancet Gastroenterol Hepatolk 2019, 4(8): 611-621.
10. Lin J, et al. Ann Oncol, 2019, 30(suppl 5): 253.
11. Guoming Shi, et al. 2020 ESMO. Abstract 500.
12. Dahan R, et al. Cancer Cell. 2015;28(3):285-95.
13. Zhang T, et al. Cancer Immunol Immunother. 2018; 67(7): 1079-1090.
14. Centanni M, et al. Clinical Pharmacokinetics, 58(7):835-857, 2019.
查看更多