查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者信息:南方医科大学中西医结合医院肿瘤中心 杨子科 张军一 罗荣城 康世均;怀化市第一人民医院肿瘤中心 齐艳霞
【摘要】 目的 探讨靶向 Notch1的siRNA抑制恶性黑色素瘤 Notch通路对小鼠机体抗肿瘤免疫的影响。方法 采用RNA干扰小鼠黑色素瘤细胞B16F1 Notch1基因的表达,酶联免疫吸附实验(ELISA)法检测转染前后肿瘤细胞分泌免疫抑制因子转化生长因子-β(transforming growth factor-β,TGF-β)、白细胞介素10(interleukin-10,IL-10)和血管内皮生长因子 (vascular endothelial growth factor,VEGF)的变化 。 制作小鼠黑素瘤模型 ,在肿瘤生长过程中瘤内注射si- Notch1,记录肿瘤生长情况 ,手术切除肿瘤组织,流式细胞术检测肿瘤组织中gp100抗原特异性CD8+ T细胞的比例, ELISA法比较各组肿瘤匀浆上清中IFN-γ和免疫抑制因子TGF-β的含量变化,免疫组化法分析肿瘤组织中FoxP3+ Treg细胞的数量。结果 siNotch1转染后,成功下调了黑色素瘤细胞 Notch1基因的表达。ELISA 实验结果显示,转染后siNotch1组 、siNC组和mock组细胞上清TGF-β分泌量分别为(0.665±0.242)、(1.413±0.153)和(1.623± 0.111)ng/mL,F=40.237,P=0.000 48;VEGF的分泌量分别为(399.9±79.42)、(397.3±107.0)和 (388.6± 136.8) ρg/ mL , 差 异 无 统 计 学 意 义 ,F=0.015 ,P=0 .986 ;IL -10的分泌量为(38.93 ± 12 .45) 、 (41.84± 9.85) 和 (45.81± 9.36)ρg/mL,差异无统计学意义 ,F=0.525,P=0.604。siNotch1瘤内注射之后 ,小鼠肿瘤生长明显减慢 。 流式细胞术检测结果显示 ,siNotch1 组 、siNC 组 和 mock 组 gp100 抗 原 特 异 性 CD8+ T 细胞的比例分别为(5.54±1.68)% 、(2 .43 ± 1 .09 )% 和 (2 .57 ± 1 .16 )% ,F=12 .643 ,P=0 .00025 。 免疫组化结果显示 ,FoxP3平均阳性细胞数分别为23.13±6.75、38.63±10.68 和 41.75±12.10,F=7.802,P=0.003。 肿瘤组织匀浆ELISA结果显示 ,siNotch1组 、siNC 组和 mock组IFN-γ的浓度分别为(10.047±1.775)、(4.121±1.379)和(3.698±1.253)ng/mL ,F=45.660,P=0 .0 0 0 2 3 ; T G F -β的 浓度分别为(3.738± 1.203) 、 (7.663± 2.114) 和 (7.545 ± 2.080) ng/ mL ,F=11.687 ,P=0.00039 。 结论 siNotch1 制黑色素瘤细胞 Notch 通路后 ,可以降低其分泌 TGF-β 的含量 ,从而降低其对 淋巴细胞的抑制作用 , 增加肿瘤组织中gp100抗原特异性CD8+ T细胞的浸润,促进IFN-γ的分泌,降低Treg细胞的比例,增强机体抗肿瘤免疫功能。
【关键词】 恶性黑色素瘤,抗肿瘤免疫,siRNA 瘤内注射,siNotch1
[ABSTRACT] OBJECTIVE To value the immune efects against tumor of RNAi-mediated knowdown of Notch1in ma- lignant melanoma. METHODS siRNA targeting Notch1gene was used to transfect melanoma cel line B16F1and induce RNA interference. ELISA was performed to measure the secretion of immunosuppresive cytokines TGF-β,IL-10and VEGF in culture supernatant. We further tested the immune efects of siNotch1intratumoral injection after using mouse cel line B16F1to establish mice tumor models. The tumor growth was recorded and the growth curve was drawn. The ratios of tumor antigen specific(gp100)CD8+ T lymphocytes in tumor were examined by flow cytometry.The concentra- tions of IFN-γand TGF-βin tumor homogenate supernatant were examined by ELISA,and immunohistochemistry was used to evaluated the number of FoxP3+ Tregs. RESULTS Transfection with a smal interfering RNA targeting Notch1 sucesfuly downregulated Notch1expresion in melanoma cels. As shown in ELISA esays,the secretions of TGF-βin siNotch1,siNC and mock groups were respectively (0.665±0.242),(1.413±0.153)and (1.623±0.111)ng/mL.The diferences were statisticaly significant(F=40.237,P=0.000 48). The secretion of VEGF in thre groups were respec- tively (399.9±79.42),(397.3±107.0)and (388.6±136.8)ρg/mL. There was no diference in thre groups (F= 0.015,P=0.986). The secretions of IL-10in thre groups were respectively (38.93±12.45),(41.84±9.85)and(45.81±9.36)ρg/mL. The secretion of IL-10had no significant diference in thre groups (F=0.525,P=0.604). si- Notch1intratumoral injection sucesfuly down-regulated the expresion of Notch1and suppresed tumor growthin vivo. Flow cytometry analysis showed that the ratios of tumor antigen specific CD8+ T lymphocytes in thre groups were respectively (5 .54 ± 1 .68 )% , (2 .43 ± 1 .09 )% and (2 .57 ± 1 .16 )% . The dif ferences were statistical ly significant (F=12.643,P=0.000 25). Immunohistochemical analysis showed that the mean number of FoxP3positive cels in tumor in thre groups were respectively 23.13±6.75,38.63±10.68and 41.75±12.10. The diferences were statisticaly signifi- cant(F=7.802,P=0.003). The secretions of IFN-γin tumor in thre groups were respectively (10.047±1.775),(4.121±1.379)and (3.698±1.253)ng/mL. The diferences were statisticaly significant(F=45.660,P=0.000 23).
The secretions of TGF-βin tumor in thre groups were respectively (3.738±1.203),(7.663±2.114)and (7.545± 2.080)ng/mL. The diferences were statisticaly significant(F=11.687,P=0.000 39). CONCLUSIONS Knockdown of Notch1expresion by RNA interference can down-regulate the expresion of TGF-β,which may promote more CD8+ T lymphocytes infiltrating and higher IFN-γrelease in tumor tisue. It can also reduce the ratio of Treg cels in vivo. Inhibi- tion of Notch1expresion may potentialy enhance immune responses against tumor and represent a novel immunotherapy for melanoma.
[KEYWORDS] malignant melanoma;immunotherapy;siNotch1inntratumoral injection;siNotch1
黑色素瘤的免疫治疗在恶性黑色素瘤综合治疗中 占有重要地位,免疫治疗早期效果好,但肿瘤细胞具有免疫逃逸功能,阻碍了免疫治疗疗效的有效发挥,成为恶性黑色素瘤免疫治疗方案急需跨越的最后障碍。[1]。 研究表明,肿瘤细胞可通过自分泌或者旁分泌的方式 分 泌 转 化 生 长 因 子-β(transforming growth factor-β,)和 血 管 内 皮 生 长 因 子 (TGF-β vascular endothelial growth factor,VEGF),白 细 胞 介 素-10(interleukin- 10,IL-10)等 [2-3]。 这些免疫抑制因子使肿瘤局部形成一个深度免疫抑制区,不仅使身在其中的免疫细胞功能受到严重抑制,甚至功能正常、活化的免疫细胞, 一旦进入此环境也将成为免疫功能抑制的“沉默”细胞, 是肿瘤免疫逃逸的重要机制之一。 本研究采用si-Notch1转染小鼠黑色素瘤细胞株,观察转染前后其分泌免疫抑制因子的变化,后对荷瘤小鼠行siNotch1瘤内注射,并采用流式细胞术、酶联免疫吸附实验 (ELISA )及免疫组化等方法检测相应的免疫指标 ,观 察siNotch1抑制黑色素瘤 Notch通路对机体抗肿瘤 免疫的影响。
1 材料与方法
1 .1 材 料
C57BL/6小鼠, 24只,雌性,6~8周龄,体质量18 ~ 22g,购自南方医科大学动物实验中心,合格证明号:44002100003459,SPF级环境中饲养。小鼠MM细胞株购自武汉大学保藏中心。 Prime Script○R RT reagent试 剂 盒 、SYBR○RPremix Ex TaqTM 试 剂 盒 、 Notch1及β-actin引物购自 TaKaRa公司,Notch1和β-actin抗体购自 Santa Cruz 公司 ,TGF-β1、IL-10、 VEGF-A ELISA 和 IFN-γ ELISA试剂盒来自美国 ebioscience 公司 ,Trizol 和 Lipofectamine2000 购自Invitrogen 公司 ,PVDF膜和化学发光液购自 Pierce公司 ,胎牛血清和高糖 DMEM 培养基购自美国 Hy- Clone 公司 ,siNotch1 Oligo 及阴性对照购自上海吉玛生物公司,HRP标记的山羊抗兔二抗试剂盒购自北京中衫金桥,小鼠 CD8a-FITC 及同型对照抗体购自德国美天旎公司 ,gp100 M HC tetramer 由美国beckman coulter 公司设计合成 。
1 .2 细胞学实验
1 .2 .1 细胞培养 B16F1细胞株用含10%胎牛血清的高糖DMEM培养液培养,置于37°C、5%CO2 的细胞培养箱内,倒置显微镜下观察细胞生长情况,每2~ 3d行传代培养。
1.2.2 siRNA的设计与合成靶向Notch1基因的siRNA(siNotch1)的设计合成由上海吉玛生物公司完成,前期从预先设计的6对序列中选出1对作为目的 siRNA,序 列 为 siRNA-Notch1-mus-4650,正 义 链 为 5′-GCAACCUGCAGUGUAAUAATT-3′,反 义 链 为 5′-UUAUUACACUGCAGGUUGCTT-3′。 同时选取与 Notch1 mRNA及其他基因均无同源性的siRNA(siNC)作为阴性对照 。
1.2.3 细胞瞬时转染 用 Lipofectamine2000转染技术转染细胞。转染前1d,消化收集 B16F1细胞,接种至6孔板中。第2天,当细胞达30%~50%融合时, 分别将 siNotch1 及 siNC 转染入 B16F1 细胞中。 细胞转染后于温箱内无血清培养4h,更换完全培养基,用于后续实验 。 细胞分为 siNotch1 组 、siNC组和只加转染试剂对照的mock组 。
1.2.4 细胞 Notch1 mRNA 及蛋白表达检测转染后24 h ,T RIzol 提取总 R N A ,计算各组 R N A浓度和纯度 ,总 RNA (1 μg)在 20 μL 体系中去除基因组DNA,进行逆转录反应 :42 °C 反应 60 min,95 °C 5 min,4 °C 5 min。 荧光定量 PCR:将反应管置入 LightCycler480 RT-PCR 系统中 ,反应条件为 95 °C 3 0 s ,9 5 °C 5 s + 6 0 °C 2 0 s (4 0 个 循 环 ) , 监测荧光信号 ,相对定量结果参考ΔΔCt方法计算 。 Notch1 引物正义链为 5′-TCAATGTTCGAGGACCAGATG -3′,反义链为 3′-TCACTGTTGCCTGTCTCAAG-5′。 转染后72h采用蛋白质印迹法检测各组 Notch1 蛋白表达。提取细胞蛋白质采用BCA 法定量,计算总蛋白浓 度;蛋白质凝胶电泳后转膜;室温封闭1h,加山羊抗 小 鼠 Notch1 抗 体 ,4 °C 孵 育 过 夜 ,加入二抗 ,室温孵育 1h;采用化学发光检测 Notch1蛋白表达并进行灰度分析。该实验独立重复3次。
1 .2 .5 TGF-β和IL-10及VEGF分泌量检测 接种B16F1细胞至6孔板 ,转染后48 h后 ,吸取培养上清, 9 000r/min(r=6cm)离心10 min去沉淀 。为排除完全培养基血清中细胞因子的影响,增加2孔完全培养基作为对照。ELISA 实验操作按美国ebioscience公 司的操作说明书进行,将稀释好的样品及标准品100μL加入预先包被抗体的酶标板孔中,37 °C孵箱中反应 90 min ,加入生物素标记的抗体 100 μL ,37 °C 孵 箱 中 反 应 90 min,0.01 mol/L PBS 液洗涤3次 ,加入亲和素-过氧化物酶复合物 (ABC)工 作 液 ,37 °C 反 应30 min,0.01 mol/L PBS液洗涤5次 ,加入TMB显色液 37°C反应30min,加入TMB终止液,于450nm酶标仪上测定 A 值,绘制标准曲线,计算样本中 TGF-β、IL-10及 VEGF的浓度。该实验独立重复5次。
1 .3 动物实验
1.3.1 小鼠 MM 肿瘤模型制作 实验动物用24只C57BL/6 雌性小鼠 ,取 B16F1 细胞于每只小鼠皮下注射100μL细胞悬液(1×106 个/mL)。待肿瘤体积达 90~110 mm3 后 ,随 机 分 为 siNotch1 组 、siNC 组和mock组 ,每组8只 ,分别进行 siNotch1、siNC 和 PBS (2 5 μ L / 只 ) 瘤内注射 , 每周 2次,共7次。观察各组肿瘤生长情况并测量体积(V)绘制肿瘤生长曲线。第30天断颈处死小鼠,取肿瘤标本比较各组肿瘤体积及进行相应的免疫学分析。V=ab2/ 2 (a为肿瘤长径;b为肿瘤宽径)
1.3.2 流式细胞术检测黑色素瘤gp100 抗原特性 CD8+T细胞无菌手术切除小鼠黑色素瘤组织,剪碎,研磨 ,过200目细胞筛网 ,制成单细胞悬液 ,调整细胞数至 1×106 mL-1 。 取1 mL 细胞悬液 ,加入 gp100 tetramer 和 CD8a-FITC,用流式细胞仪检测肿瘤组织中 gp100tetramer 和CD8双阳性细胞的比例。 另 取 1mL细胞加入同型对照抗体,流式检测排除非特异性荧光的影响。
1.3.3 肿 瘤 组 织 病 理 学 观 察 及 Notch1 和 FoxP3 蛋白表达测定 4%多聚甲醛固定上述3组肿瘤组织,常规制成石蜡切片,HE染色观察病理改变;同时切片予脱蜡 、水化 、抗原修复 。 Notch1 表达于细胞质和细胞膜 ,SP 染色呈棕黄色染色为Notch1蛋白阳性表达 , AEC染色呈红褐色的为FoxP3蛋白阳性表达 。结果采用双盲法判定 ,Notch1 阳性细胞的计数 :每张切片随机选择5个高倍镜视(400×),每个视野计数100个细胞 ,计算阳性细胞所占百分比 。 FoxP3 阳性细胞的计数:每张切片选取5个阳性细胞数最多的视野 (200 × ),计数阳性细胞数,求平均值 ,计算每个样本的平均阳性细胞数。
1.3.4 TGF-β 和 IFN-γ 的浓度检测 采用ELISA试剂盒测定。手术切除小鼠黑色素瘤组织,称取肿瘤组织重量,加入等比体积的无菌PBS缓冲液,剪碎,匀浆1min,在4°C低温条件下 9000r/min(r=6cm)离心10min后取上清液 。ELISA检测上清液中TGF-β 和IFN-γ的浓度,ELISA 实验操作按美eBioscience 公司的操作说明书进行。
1 .4 统 计 学 方 法
采用SPSS13.0进行统计学处理。定量数据结果用x-±s表示,对于Notch1RT-PCR及蛋白质印迹法检测数据,采用非参数Kruskal-WallisH检验,组间两两比较采用Nemenyi法检验。对于ELISA数据、肿瘤体积、流式结果和免疫组化数据,如果符合正态分布,方差齐性,采用单因素方差分析,组间两两比较采用Bonferroni检验;如果不符合正态分布或方差不齐,则用校正的F检验,其中正态性检验采用Shapiro-Wilk检验,方差齐性检验采用Levene检验。检验水准α=0.05。
2 结果
2.1 细胞实验
2.1.1 细胞Notch1基因及蛋白表达水平 siNotch1转染B16F1细胞后48h,采用PCR法验证沉默效率,siNotch1组、siNC组和mock组Notch1mRNA的相对表达量分别为0.142±0.011、0.952±0.035和1.00±0.034。3组均数差异有统计学意义,HC=6.489,P=0.039;siNotch1组Notch1mRNA的相对表达量较mock组明显减少,χ2=6.423,P=0.040;siNC组和mock组相比,差异无统计学意义,χ2=1.094,P=0.579。
如图1所示,β-actin作为内参,siNotch1组Notch1蛋白相对表达量为0.325±0.019,siNC组为0.968±0.013,mock组为1.016±0.030,3组均数差异有统计学意义,HC=7.200,P=0.027;siNotch1组Notch1蛋白相对表达量明显低于mock组,差异有统计学意义,χ2=7.20,P=0.027;siNC组Notch1蛋白相对表达量与mock组相比,差异无统计学意义,χ2=1.8,P=0.410。提示,siRNA干扰成功下调B16F1细胞Notch1基因及蛋白表达。

2.1.2 siNotch1转染后B16F1细胞上清TGF-β和IL-10及VEGF的浓度 siNotch1转染B16F1细胞后72h,siNotch1组、siNC组和mock组细胞培养上清TGF-β含量分别为(0.665±0.242)、(1.413±0.153)和(1.623±0.111)ng/mL。正态性检验,WsiNotch1=0.973,P=0.891;WsiNC=0.971,P=0.880;Wmock=0.969,P=0.867;方差齐性检验,F=0.913,P=0.428;3组均数差异有统计学意义,F=40.237,P=0.00048;两组间比较Bonferroni检验结果显示,siNotch1组细胞培养上清TGF-β含量明显低于siNC组(t=0.748,P=0.00069)和mock组(t=0.958,P=0.00058),差异有统计学意义;siNC组与mock组相比,差异无统计学意义,t=0.210,P=0.259。
siNotch1组、siNC组和mock组细胞培养上清VEGF分泌量分别为(399.9±79.42)、(397.3±107.0)和(388.6±136.8)ρg/mL。正态性检验,WsiNotch1=0.920,P=0.533;WsiNC=0.933,P=0.615;Wmock=0.851,P=0.197;方差齐性检验,F=1.633,P=0.236;三组均数比较差异无统计学意义,F=0.015,P=0.986。
siNotch1组、siNC组和mock组细胞培养上清IL-10含量分别为(38.93±12.45)、(41.84±9.85)和(45.81±9.36)ρg/mL。正态性检验,WsiNotch1=0.908,P=0.456;WsiNC=0.978,P=0.922;Wmock=0.952,P=0.754;方差齐性检验,F=0.699,P=0.516;三组均数比较差异无统计学意义,F=0.525,P=0.604。
2.2 肿瘤生长情况
图2所示,siNC组及mock组肿瘤生长曲线较为一致,且生长速度明显快于siNotch1组;从成瘤的第17天开始,siNotch1组生长速度明显慢于siNC组和mock组,第17天时siNotch1组、siNC组和mock组肿瘤体积分别为(549.94±94.96)、(769.71±117.03)和(731.33±106.53)mm3。正态性检验,WsiNotch1=0.971、P=0.905;WsiNC=0.935,P=0.564;Wmock=0.911,P=0.360;方差齐性检验,F=0.098,P=0.907;3组均数间差异有统计学意义,F=10.185,P=0.001;两组间比较Bonferroni检验结果显示,si-Notch1组生长速度明显慢于siNC组(t=219.77,P=0.001)和mock组(t=194.39,P=0.005),siNC组与mock组肿瘤体积差异无统计学意义,t=25.88,P=1.000。
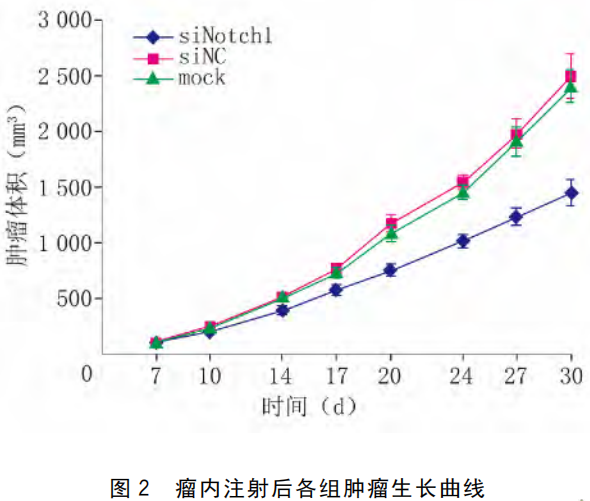
第30天处死小鼠测量肿瘤体积,siNotch1组、siNC组及mock组肿瘤体积分别为(1454.14±278.41)、(2496.32±377.88)和(2406.54±345.29)mm3。正态性检验,WsiNotch1=0.850,P=0.096;WsiNC=0.921,P=0.435;Wmock=0.889,P=0.227;方差齐性检验,F=0.341,P=0.715;3组均数差异有统计学意义,F=23.576,P=0.00043。两组间比较Bonferroni检验结果显示,siNotch1组的肿瘤体积明显小于siNC组(t=1 042.17,P=0.000 11)和mock组(t=952.40,P=0.0038),siNC组与mock组之间差异无统计学意义,t=89.77,P=1.000。
2.3 gp100抗原特异性CD8+T细胞的比例
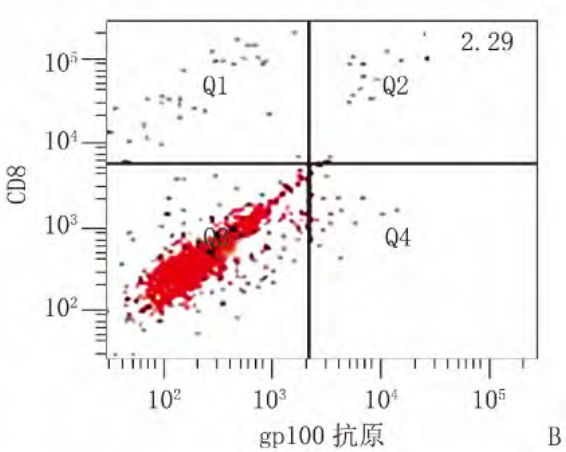
图3所示,成瘤后第30天,siNotch1组、siNC组和mock组gp100抗原特异性CD8+T细胞的比例分别为(5.54±1.68)%、(2.43±1.09)%和(2.57±1.16)%。正态性检验,WsiNotch1=0.876,P=0.172;WsiNC=0.905,P=0.317;Wmock=0.913,P=0.373;方差齐性检验,F=2.232,P=0.132;3组均数间差异有统计学意义,F=12.643,P=0.00025;两组间比较Bonferroni检验结果显示,siNotch1组的gp100抗原特异性CD8+T细胞比例明显高于siNC组(t=2.985,P=0.00065)和mock组(t=2.843,P=0.0011),siNC组与mock组之间差异无统计学意义,t=0.143,P=1.000。


2.4 肿瘤组织病理学变化及Notch1和FoxP3蛋白表达
图4所示,FoxP3表达于Treg细胞质和细胞膜,成瘤后第30天,采用HE染色的siNotch1组肿瘤组织镜下见明显增多的淋巴细胞浸润,siNC组和mock组浸润淋巴细胞数较少。siNotch1组、siNC组和mock组Notchl蛋白阳性细胞百分率分别为(48.63±9.64)%、(79.63±12.77)%和(82.00±9.91)%。正态性检验,WsiNotch1=0.900,P=0.290;WsiNC=0.887,P=0.219;Wmock=0.927,P=0.487;方差齐性检验,F=0.561,P=0.579,3组均数差异有统计学意义,F=23.492,P=0.00044;两组间比较Bonferroni检验结果显示,siNotch1组Notch1蛋白阳性细胞百分率明显低于siNC(t=31.000,P=0.00035)组和mock组(t=33.375,P=0.000 13),siNC组与mock组相比差异无统计学意义,t=5.433,P=1.000。
siNotch1组、siNC组和mock组FoxP3阳性细胞数分别为23.13±6.75、38.63±10.68和41.75±12.10。正态性检验,WsiNotch1=0.900,P=0.290;WsiNC=0.887,P=0.219;Wmock=0.927,P=0.487;方差齐性检验,F=2.341,P=0.121;3组均数差异有统计学意义,F=7.802,P=0.003;siNotch1组FoxP3阳性细胞数明显低于siNC组(t=15.500,P=0.0170)和mock组(t=18.625,P=0.004),siNC组与mock组对比差异无统计学意义,t=3.125,P=1.000。

2.5IFN-γ和TGF-β的浓度
成瘤后30d,siNotch1组、siNC组和mock组肿瘤组织中IFN-γ分泌量分别为(10.047±1.775)、(4.121±1.379)和(3.698±1.253)ng/mL。正态性检验,WsiNotch1=0.953P=0.740;WsiNC=0.894,P=0.254;Wmock=0.901,P=0.297;方差齐性检验,F=0.965,P=0.397;3组差异有统计学意义,F=45.660,P=0.00023;siNotch1组肿瘤组织IFN-γ分泌量明显高于siNC组(t=5.926,P=0.000 26)和mock组(t=6.349,P=0.00084),siNC组与mock组之间差异无统计学意义,t=0.423,P=1.000。 siNotch1组、siNC组和mock组TGF-β分泌量分别为(3.738±1.203)、(7.663±2.114)和(7.545±2.080)ng/mL。正态性检验,WsiNotch1=0.948,P=0.694;WsiNC=0.887,P=0.221;Wmock=0.839,P=0.073;方差齐性检验,F=2.963,P=0.074;3组均数比较差异有统计学意义,F=11.687,P=0.00039。两组间比较Bonferroni检验结果显示,siNotch1组TGF-β分泌量明显低于siNC组(t=3.926,P=0.0011)和mock组(t=3.808,P=0.0015),siNC组与mock组之间差异无统计学意义,t=0.118,P=1.000。
3 讨论
肿瘤在机体可直接诱导产生免疫抑制细胞,同时还可以自分泌和旁分泌TGF-β、IL-10、VEGF和PGE2等多种免疫抑制因子抑制调节性细胞因子的分泌,下调免疫效应细胞的活性,从而使免疫系统的功能受到抑制,保护肿瘤细胞免受特异性CTL的杀伤,为其生长提供一个良好的微环境[4]。TGF-β是介导肿瘤免疫逃逸最有效的免疫抑制分子,可抑制各种免疫细胞在肿瘤组织中的浸润、增殖、分化和活化,并通过下调Bcl-2mRNA表达而诱导免疫活性细胞凋亡;抑制瘤细胞表面靶细胞识别抗原的表达,诱导HLA-II类分子、B7-1、细胞间黏附分子低表达或不表达[5]。Treg细胞是机体维持自身耐受的重要组成部分,但在肿瘤免疫逃逸中却发挥着重要的作用,它可通过多种途径使机体处于免疫无能状态,从而参与了肿瘤的免疫逃避过程,促进肿瘤的生长[6-7]。因此,未来或许可以通过抑制TGF-β的产生或阻断其信号传导,抑制Treg细胞在肿瘤组织的富集,从而逆转肿瘤细胞介导的免疫抑制,增强机体的抗肿瘤免疫功能。
1916年,Morgan等首次发现Notch信号蛋白,因其部分丧失功能的突变体可在果蝇翅膀的边缘造成缺(Notch)而得名,人们在1983年也成功克隆出果蝇的Notch基因[8]。Notch家族是一组进化上高度保守的跨膜蛋白,可以广泛调节细胞的发育和分化。研究表明,Notch信号通路与细胞分化和肿瘤的发生发展密切相关,可能扮演着原癌基因的角色[9]。Notch通路激活是通过Notch受体与相邻细胞表面的配体结合,引起Notch受体细胞外结构的改变,导致γ-分泌酶复合体切割,释放Notch受体胞内区(NICD)进入细胞核,NICD与CSL蛋白结合导致共抑制复合物解离,并募集共活化分子MAML1组成共三聚体,从而启动下游基因的转录[10]。
有研究发现,Notch信号通路可以通过调节多种免疫细胞的发育和功能来调节机体的免疫功能[11]。Notch1在免疫细胞中的表达对造血干细胞、巨噬细胞、树突状细胞、肥大细胞、T和B淋巴细胞的发育和功能的发挥都有重要的调节作用,并参与病毒感染、炎症反应和自身免疫疾病等相关疾病的发生[12-15]。近年来有研究发现,Notch信号通路可以通过调节CD4+T细胞来调节IL-10的产生量,通过调节CD8+T来调节IFN-γ和IL-17的产生量[16]。另外,效应T细胞上的Notch被激活后,还可以通过上调TGF-β增强Treg细胞的免疫抑制功能[17]。上述研究充分说明Notch通路的活化对免疫细胞的功能具有重要的调节作用,但大多数研究在体外针对特定的免疫细胞进行,没有对肿瘤微环境进行相关的研究,黑色素瘤细胞表达Notch1在黑色素瘤细胞诱导的免疫抑制微环境及肿瘤免疫逃逸中的作用,尚不明确。
本研究结果表明,转染后肿瘤细胞分泌TGF-β的含量减少,而VEGF和IL-10的含量无明显变化; 另一方面,本研究采用Notch1siRNA对荷瘤小鼠进行瘤内注射,结果表明,siNotch1瘤内注射之后,可以成功下调Notch1蛋白的表达,增加肿瘤组织中CD8+T细胞的浸润,促进IFN-γ的分泌,降低Treg细胞的比例,有效地增强了小鼠机体的抗肿瘤免疫功能,可作为恶性黑色素瘤免疫治疗的候选靶点。
参考文献
[1] Stewart TJ,Smyth MJ.Improving cancer immunotherapy by targe- ting tumor-induced immune suppresion[J].Cancer Metastasis Rev, 2011,30(1):125-140.
[2] Sun LX,Lin ZB,Duan XS,et al.Suppresion of the production of transforming growth factor beta1,interleukin-10,and vascu- lar endothelial growth factor in the B16F10cels by Ganoderma lucidum polysacharides[J].J Interferon Cytokine Res,2014,34(9):667-675.
[3] Li Z,Zhang LJ,Zhang HR,et al.Tumor-derived transforming growth factor-beta is critical for tumor progresion and evasion from immune surveilance[J].Asian Pac J Cancer Prev,2014,15(13):5181-5186.
[4] 侯清玉,杨秀萍.肿瘤免疫逃逸的研究进展[J].中华肿瘤防治杂志 ,2010,17(3):228-232. [5] Yang L,Pang Y,Moses HL.TGF-beta and immune cels: an important regulatory axis in the tumor microenvironment and progresion[J].Trends Immunol,2010,31(6):220-227.
[6] 樊敏,霍介格.调节性 T细胞与肿瘤免疫逃逸相关性及中医药 治 疗 研 究 进 展 [J ] . 浙 江 中 医 药 大 学 学 报 , 2 0 1 3 ,3 7 (6 ) : 8 2 6 -829.
[7 ] 冯素玲 ,李建国,罗泽如,等 . 肺癌患者外周血 CD4 ~ + CD25 ~+调节性 T 细胞检测的临床意义[J].中华肿瘤防治杂志, 2009,16(19):1474-1476.
[8] Lai EC.Notch signaling:Control of cel cornunication and cel fate[J].Development,2004,131(5):965-973.
[9] Li D,Masiero M,Banham AH,et al.The notch ligand JAG- GED1as a target for anti-tumor therapy[J].Front Oncol,2014, 25(4):254-267.
[10] Guruharsha KG,Kankel MW,Artavanis-Tsakonas S.The Notch signaling system:recent insights into the complexity of a conserved pathway[J].Nat Rev Genet,2012,13(9):654-666.
[11] Radtke F,Fasnacht N,Macdonald HR.Notch signaling in the immune system[J].Immunity,2010,32(1):14-27.
[12] Zhang Q,Wang C,Liu Z,et al.Notch signal suppreses Tollike receptor-triggered inflammatory responses in macrophages by inhibiting extracelular signal-regulated kinase 1/2-mediated nuclear factor kappaB activation[J].J Biol Chem,2012,287(9):6208-6217.
[13] Nakano N,Nishiyama C,Yagita H,et al.Notch signaling confers antigen-presenting cel functions on mast cels[J].J Alergy Clin Immunol,2009,123(1):74-81.
[14] Lewis KL,Caton ML,Bogunovic M,et al.Notch2receptor sig- naling controls functional diferentiation of dendritic cels in the splen and intestine[J].Immunity,2011,35(5):780-791.
[15 ] Radtke F , M acDonald H R , Tac chini-Cot tier F . Regulation of innate and adaptive immunity by Notch[J].Nat Rev Immunol, 2013,13(6):427-437.
[16] Sauma D,Ramirez A,Alvarez K,et al.Notch signaling regulates cytokine production by CD8+and CD4+ T cels[J].Scand J Immunol,2012,75(4):389-400.
[17] Hue S,Kared H,Mehwish Y,et al.Notch activation on efector T cels increases their sensitivity to Treg cel-mediated sup- presion through upregulation of TGF-betaRII expresion[J]. Eur J Immunol,2012,42(7):1796-1803.
查看更多