查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





编者按
同时性结直肠癌(Synchronous colorectal carcinoma, SCRC/syCRC)是指在患者最初进行结直肠癌(CRC)诊断的时候发现两枚或以上原发性结直肠癌病灶,是一种特殊和少见的肠癌类型。
日前,北京大学肿瘤医院团队整理了一例经治的双原发并携带不同基因突变的结直肠癌病例,并就相关文献进行简要回顾。现将精华内容呈现如下,以飨读者。
作者简介
王晰程
北京大学肿瘤医院

北京大学肿瘤医院消化内科副教授、副主任医师
中国临床肿瘤学会(CSCO)青年专家委员会常委
中国抗癌协会大肠癌专委会内科学组/遗传学组委员
北京癌症防治学会结直肠癌专委会常委
《Annals of Oncology》中文版编委

葛赛
北京大学肿瘤医院
北京大学医学部肿瘤学博士
北京大学肿瘤医院 消化肿瘤内科青年医师
赴美国Baylor College of Medicine访学1年
主持国家自然科学青年基金1项,发表SCI论文若干
主要研究方向:消化道肿瘤多组学研究、肿瘤免疫微环境相关分子探索
病例梳理
患者男性,65岁,出现排便里急后重感半年,后体检发现癌胚抗原(CEA)升高(2018年11月升至32.8 ng/ml),行PET-CT提示乙状结肠高代谢,就诊北京大学肿瘤医院。于2018年12月行肠镜检查。患者无癌症或遗传性肠道疾病家族史,否认腹痛、腹胀,无恶心、呕吐、便血,每日排便1~2次。体格检查无明显异常。
肠镜发现距肛门50 cm可见山田Ⅲ型息肉,表面光滑,充血水肿,无分叶,约0.7×0.6 cm (图1A), 距肛门30 cm可见肿物,表面凹凸不平、糜烂、坏死、质脆、触之易出血,大小约2×3 cm (图1B), 病理提示:高级别上皮内瘤变,至少为黏膜内局灶癌变;距肛门13 cm可见巨大溃疡,约占1/2肠壁,表面有污苔、糜烂、坏死,溃疡周围呈环堤样不规则隆起(图1C),病理:中分化腺癌(图1D)。
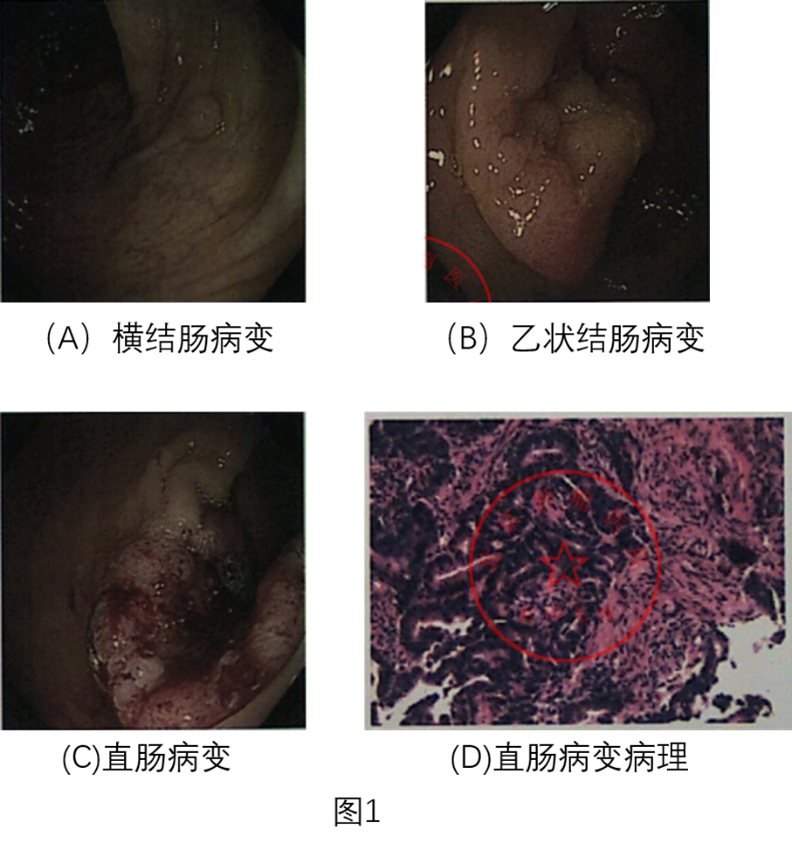
患者完善胸腹盆CT无远处转移征象,于2018年12月13日在北京大学肿瘤医院行全麻下腹腔镜辅助直肠癌低位前切除术。术后病理提示直肠病变为溃疡型中分化腺癌,大小2×2×1 cm,侵犯至直肠旁脂肪(pT3N2bM0),乙状结肠病变(距离直肠肿物约15.5 cm处)为溃疡型中分化腺癌,背景为管状腺瘤,大小1.5×1×0.8cm,(pT2N2bM0),区域淋巴结转移情况为:直肠上血管根部0/1,肠周8/15,癌累及淋巴结被膜外。两肿物间肠壁另见一管状腺瘤,I-II级,直径0.5 cm。
对直肠肿物行免疫组化示:HER2(0),MLH1(+),MSH2(+),MSH6(+),PMS2(+)。行一代测序(ARMS-PCR)基因测序提示:KRAS、NRAS、BRAF全野生型。
术后行8周期XELOX方案辅助化疗,显示出良好的耐受性和依从性,末次治疗时间为2019年6月。2019年9月复查无明显复发征象,CEA 1.42 ng/ml,CA199 10.31 U/ml。
2020年3月复查肿瘤标志物示:CEA 17.71 ng/ml,CA199 6173 U/ml。肝脏MRI提示多发转移(图2 A~C),肝实质内见多发稍长T1稍长T2信号结节灶,数目大于10,左右叶均有分布,较大者位于S2,约23x20 mm(SE4 IM10),增强扫描呈环形低强化,DWI信号增高。吻合口未见增厚及异常强化。直肠上动脉走行区见肿大淋巴结,约22x18 mm(图2D)。胸部CT无转移征象。

考虑患者病灶主要集中在肝脏,且肝脏转移为潜在可切除病灶,盆腔淋巴结可行局部放疗达到NED(No evidence of disease)状态。
故于2020年4月开始行第1周期FOLFOXIRI+西妥昔单抗转化治疗,同时完善NGS基因检测,血液:BRAF V600E(14.47%),TP53拷贝数缺失,TMB 3.99 Muts/Mb,MSS;直肠病灶:NRAS p.Q61H错义突变(44.34%),APC移码突变(23.41%),TP53 5号外显子错义突变(26.97%),CCNE1基因拷贝数扩增,TMB 6.98 Muts/Mb,MSS。PD-L1 TPS 0。
根据基因检测结果,第2周期更换治疗方案为FOLFOXIRI+贝伐珠单抗转化治疗,并立即送检乙状结肠病灶二代测序(NGS)检测。末次化疗时间2020年5月12日。3周期后评效疾病进展(PD,肝S2新发病灶1枚,余病灶部分增大,部分缩小,盆腔淋巴结较前略缩小), 化疗期间监测CA199有小幅下降(最低降至10883 U/ml),后再次升至14687 U/ml。
乙状结肠病灶NGS结果回报:BRAF V600E突变(9.3%),TMB 4.99 Muts/Mb,MSS。尝试行肝转移灶活检行NGS检测但因穿刺组织肿瘤成分过少,检测失败。
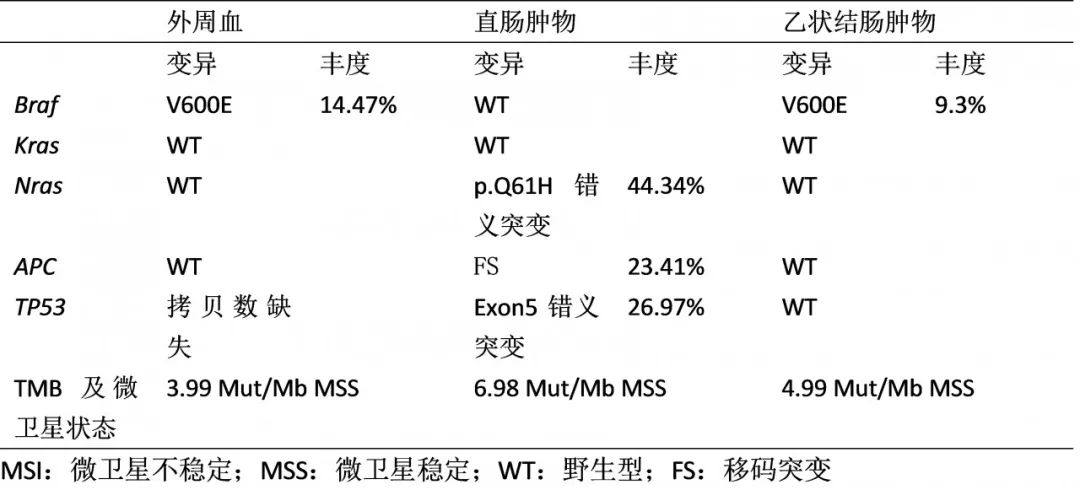
表1:NGS结果总结
患者未从全身治疗中获益,考虑此时病灶仍主要在肝脏,建议行肝动脉灌注化疗结合全身靶向治疗。
于2020年6月3日和2020年7月13日行肝动脉灌注FOLFOX治疗,联合口服呋喹替尼5 mg qd全身治疗,查CA199第一周期后降至9469 U/ml后,第二周期治疗后再次升至18609 U/ml,2020年8月复查肝脏病灶较前进展。
因患者乙状结肠病灶为BRAF V600E 突变,且血液中检测到高频该突变,考虑肝脏转移灶为BRAF突变病灶。三线治疗选择曲美替尼、达拉非尼、西妥西单抗三联治疗, 具体方案为:曲美替尼2 mg qd、达拉非尼150 mg bid、西妥昔单抗800 mg q14d。2020年8月28日开始至今已行7周期治疗,3、6周期后评效疾病稳定(SD缩小),查CA199由2020年9月最高的21393 U/ml迅速降至2020年11月的2222 U/ml,体重逐渐回升,出现的不良反应包括间断发热、全身散在皮疹、轻度口腔溃疡及尿蛋白增高等。
病例讨论
1
SCRC的临床特征
目前最常用的SCRC定义为满足以下三个条件:
1)每个病灶均被证明为恶性病灶;
2)病灶必须是彼此分开,间距大于4 cm,且排除其中有病灶是由另一枚转移造成的;
3)病灶需同时诊断,或诊断时间距离不超过6个月。
文献报道SCRC占所有结直肠癌患者的1.1%-8.1%,一项纳入超过11万例患者的荟萃分析分析报道SCRC占全部CRC约4%,男女比例为1.8:1.0,比例高于孤立性CRC,平均年龄为63岁,这和孤立CRC患者基本类似。SCRC最常见的发病部位是乙状结肠和直肠,发生在相同部位或较为靠近的部位的比例较高。病理提示存在黏液成分的比例更高。
已知有更高患SCRC风险的人群包括:炎症性肠病、遗传性非息肉病性大肠癌(HNPCC)/林奇综合征(LS)、家族型腺瘤性息肉病(FAP)和锯齿状/增生状息肉等。
文献报道在108例同时患有炎症性肠病和CRC的患者中(其中95例患有溃疡性结肠炎,13例患有克罗恩病),高达20%的患者患有SCRC。
在比较持续吸烟者和从不吸烟者的多因素分析提示,患有SCRC的风险比(HR)高达5.27 (95% CI, 2.08-13.40),而患有孤立性CRC的HR仅为0.97(95%CI,0.83-1.14)。
戒烟≥10年可能会降低发生SCRC的风险(HR=0.42;95%CI,0.19~0.95)。此外,高血压(P<0.001)和肝硬化(P=0.024)被提出为SCRC的独立危险因素,与孤立CRC相比,SCRC患者患有贫血、低蛋白血症异常CEA的比例均显著升高。
近期的研究普遍支持SCRC为独立的预后不良因素,不论是总生存期或无病生存期均有显著的统计学差异。分期来看,多因素分析显示sCRC是不论在I期(HR=1.86; P<0.001),Ⅱ期(HR=1.65; P<0.001)和Ⅲ期(HR=1.40; P<0.001)的肠癌患者中均为独立预后不良因素。
2
SCRC的分子特征
多篇全外显子测序水平的探索均指出SCRC不同病灶间共存的突变数量非常少,支持病灶来自不同克隆起源。2016年一项针对10例SCRC患者20个病灶及配对癌旁组织的全外显子组测序提示,同一患者的两个病灶间几乎全部非同义突变和染色体改变(CNV)均不相同。进一步通过克隆数目的计算后得出结论为,两枚病灶即使有相同位点的非同义突变存在,其发生时间也大大不同,也就是说即使出现同样位点的突变,也分别为单独事件。
针对同时性结直肠癌不同原发病灶的分子特点,既往报道提示同一病例不同病灶间MSI-H、KRAS突变、BRAF突变的一致性分别为9%~30%、11%~40% 和 0~33%。文献总结如表2所示。由于涉及到抗EGFR靶向药物的治疗选择以及免疫检查点抑制剂的选择,两个原发病灶不同的KRAS/BRAF基因突变、MSI-H的状态对于治疗决策有巨大影响,这也提示我们在临床治疗中一旦确定为SCRC患者应立即对每个病灶行分子生物学检查以指导治疗。
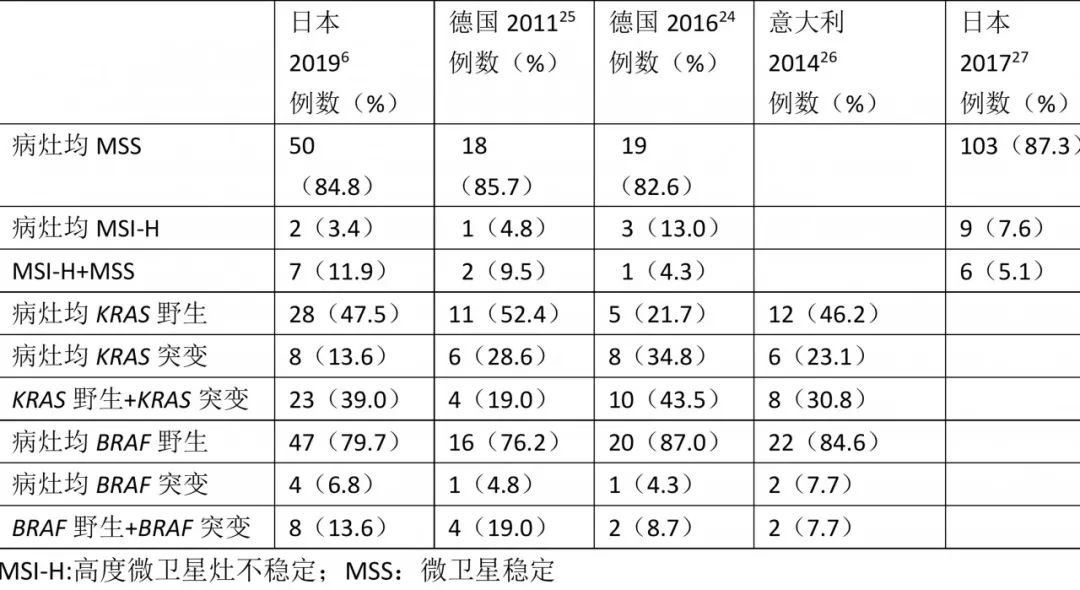
表2:相关文献总结
3
临床启示
本病例及相关文献回溯均提示SCRC不同原发病灶间分子特征相关性很低,在实际临床应用中对我们的提示:
01
全结肠镜的运用,发现全部结直肠癌患者中约占比4%的同时性结直肠癌患者,尤其是有LS、FAP、炎症性肠病及锯齿状息肉病史,以及尚未戒烟的男性,术前应积极完善全结肠镜以尽早发现SCRC的诊断,如因急诊手术、肠梗阻等原因无法术前完成全结肠镜检查,可选择手术后3~6月内尽快完成肠镜检查。
02
确诊同时性结直肠癌患者需对每一个病灶行RAS/RAF及MSI状态检测,以利于后续治疗决策的制定及肿瘤生物学行为推断。从基因诊断角度,与一代测序相比,二代测序技术可能在低频突变、测序深度及精准度等方面提供更好的分子生物学结果。
03
患SCRC的患者预后更差,临床中应注意警惕高危人群并早期诊断、精确检测、施行规律的随访,帮助改善这一类患者的预后。
编辑 中国医学论坛报 王淳
查看更多