查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





美国旧金山当地时间1月19日上午,2019 ASCO GI会议上进行口头报告交流的加拿大研究CCTG CO.26,是第一项在微卫星稳定(MSS)型转移性结直肠癌中取得阳性结果的大型II期临床研究,细胞毒T淋巴细胞相关抗原4(CTLA-4)单抗联合PD-L1单抗延长了MSS型难治性转移性结直肠癌(mCRC)患者的总生存(OS),那么,这个传统的“冷肿瘤”领域,真的取得了突破了吗?首先,我们来看看研究的详细情况

陈功教授
研究名称
(摘要号481) CCTG CO.26研究: durvalumab (D)联合tremelimumab (T)和最佳支持治疗(BSC)对比单纯BSC治疗晚期难治性CRC患者的II期随机对照研究 (The CCTG CO.26 trial: A phase II randomized study of durvalumab plus tremelimumab and best supportive care (BSC)versus BSC alone in patients (pts)with advanced colorectal carcinoma (CRC)refractory to standard therapies.)
背景知识
CTLA-4单抗的作用对象是外周淋巴结中的初始T细胞,CTLA-4单抗阻断了CTLA-4与B7-1/B7-2分子的结合,故不能传递抑制信号,从而维持T细胞的激活状态。分化成熟的效应T细胞移出淋巴结后进入肿瘤发生的部位,产生杀伤肿瘤的作用。CO.26研究使用的CTLA-4单抗tremelimumab,由阿斯利康公司开发,是选择性全人源化IgG2抗体(另外一种CTLA-4单抗ipilimumab为IgG1型抗体)。
PD-L1在多种肿瘤细胞中均有上调表达,它与T细胞上的PD-1结合,抑制T细胞增殖和活化,使T细胞处于失活状态,最终诱导免疫逃逸。PD-L1单抗可阻断PD-1和PD-L1的结合,上调T细胞的生长和增殖,增强T细胞对肿瘤细胞的识别,激活其攻击和杀伤功能,通过调动人体自身的免疫功能实现抗肿瘤作用。CO.26研究使用的PD-L1单抗durvalumab,由阿斯利康公司开发,是具有高亲和力的人源化IgG1抗体。
试验设计
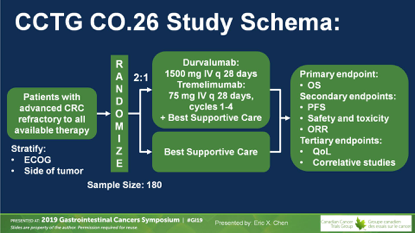
研究选取晚期难治性结直肠癌患者,按2:1随机分配到D+T组或BSC组。前期治疗包括D 1500 mg D1 和T 75 mg D1,每28天1疗程,共4疗程,联合最佳支持治疗措施。
统计学考量
主要研究终点为OS时间,假定OS从对照组的4.5个月延长到研究组的6.9个月,HR=0.65,双侧检验P<0.1认为差异有统计学意义,80%的检验效力。需要样本数180例,终点事件150例。

目标人群
入组180例难治性mCRC患者,难治性的定义就是既往接受过所有可获得的标准治疗且失败,包括全部细胞毒药物5-FU、伊立替康、奥沙利铂,如果是RAS野生型患者则必须使用过EGFR抑制剂,抗血管生成抑制剂贝伐单抗/阿柏西普和瑞戈非尼必须使用过;TAS-102未在加拿大上市,所有患者未使用。
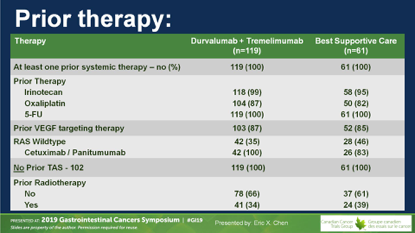
人群的基因特征,右半比例26%,80%为RAS突变,7%为BRAF突变,98%为MSS型。
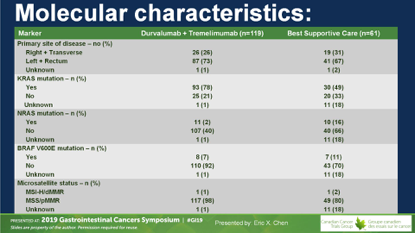
有效性结果
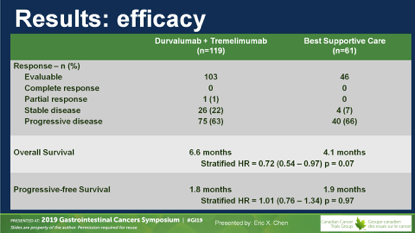
D+T组有1例ORR,DCR为23%;对照组无ORR,DCR7%。两组间的PFS无差别。研究达到主要终点,OS从4.1个月延长到6.6个月,未调整的HR=0.70(0.53~0.92),P=0.03。
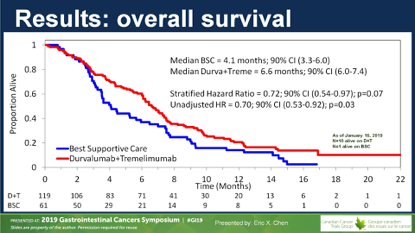
亚组分析显示OS改善在各亚组间的趋势比较一致,包括PS状况、年龄、性别、原发瘤部位、RAS、BRAF及MSI基因状态;
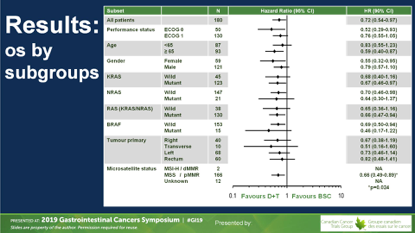
治疗组仅有1例ORR,是MSS/KRAS突变结肠癌双肺转移,原发灶未切除,DT治疗后肺转移明显缓解。
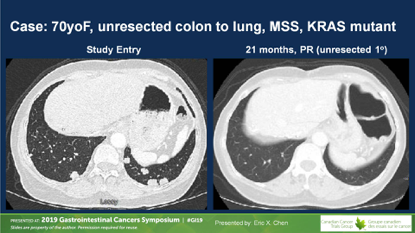
D+T治疗后DCR显著改善,OR=4.16。
治疗毒性
D+T组所有患者均出现治疗毒性,3度以上64%,显著高于对照组的20%,提示双抗IO治疗的毒性值得临床思考。最常见的3度以上毒性是疲乏和腹痛,无治疗相关死亡。
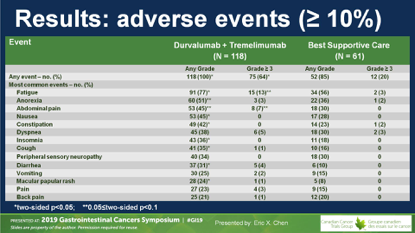
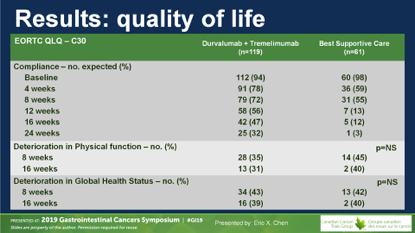
研究组比较了两组间的生活质量,尽管D+T组患者有更多的主诉,但在机体功能和总体健康状态上,D+T治疗并未带来显著不良影响。
研究结论
研究者认为这是第一个大型研究展示了免疫检查点抑制剂治疗MSS型mCRC患者的有效性,能显著延长OS。

讨论及解析
1.研究结果讨论:
正如笔者所言,CO.26是第一项在MSS型mCRC患者中取得成功的临床研究,但这真的可以称为突破吗?真是为该类“冷肿瘤”患者找到一个有效的免疫治疗手段了吗?从现场嘉宾讨论发言、以及笔者对该领域专业知识有限的了解来看,情况远远没有这么乐观,MSS型mCRC免疫治疗应该说还是限于深深的困境中。
首先可以肯定的是,这肯定是一个阳性的临床研究,统计学上达到了研究终点。但细究来看,很多临床问题依然没解决。OS虽然延长,但这样的改善是有限的,仅2.5个月,不符合其他瘤种/MSI-H型肿瘤中免疫治疗一旦有效,OS延长较多的普遍规律。另外就是,ORR率太低,PFS无延长,这些指标也不支持免疫治疗有效这一观点。
那么,和对照组相比这统计学上显著延长的2.1个月如何解释呢?讨论者认为这可能与两组间在研究进展后的治疗、BSC、随访等方面不均衡有关,D+T组的后续治疗评估、BSC更好。


2. MSS型mCRC的免疫治疗困局:
既往的临床研究经验,在该领域全部都是失败的,也让人质疑CO.26研究中CTLA-4单抗+PD-L1单抗能逆转冷肿瘤的发现。
1)CTLA-4/PD-1双抗免疫治疗对MSS无效。
CheckMate 142研究证实CTLA-4单抗+PD-1单抗能进一步改善MSI-H肿瘤的疗效,但对于MSS型,依然无法突破,尽管病例数很少,仅有20例,但ORR、PFS等指标均与CO.26研究很相似。
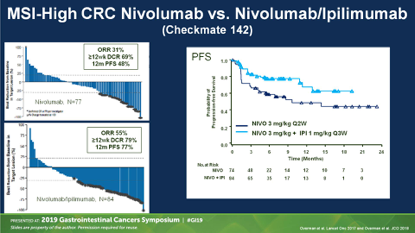
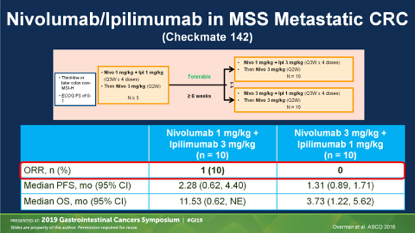
而在早期结直肠癌的CTLA-4/PD-1双抗免疫新辅助治疗的NICHE研究中也发现,MSS型肿瘤几乎没有病理缓解。

2)在MSS型mCRC中失败的其他免疫治疗手段:
曾经被寄予厚望的是MEK抑制剂Cobimetinib,早前的Ib期研究显示它能部分程度逆转MSS肠癌对Atezolizumab的耐药,带来了20%的ORR,罗氏也很快启动了III期研究,遗憾的是,2018年6月,罗氏已经宣布该研究已经失败,未达研究终点。
MEKi可上调MHC-I类抗原来增加癌细胞免疫源性。
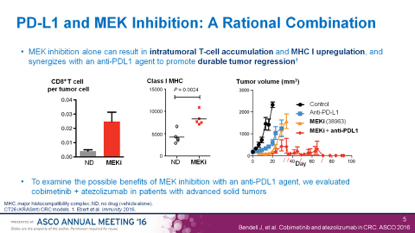
早期的Ib期研究取得令人鼓舞的结果,ORR20%
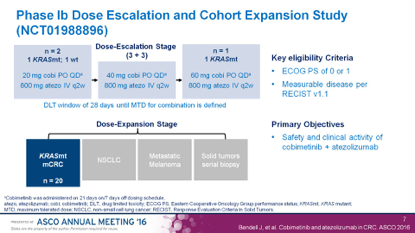
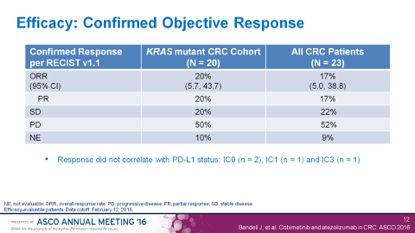
罗氏失败的III期研究IMBLAZE 370,MEKi+PD-L1单抗对MSS型mCRC无效。
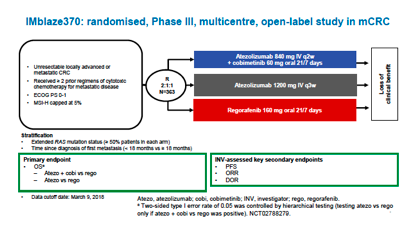
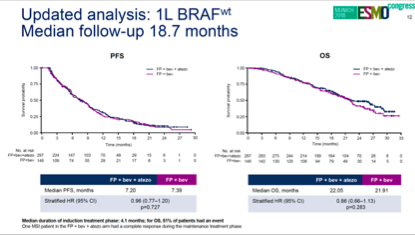
化疗/抗血管生成治疗+PD-LI单抗治疗MSS型mCRC也是失败的。美国MODUL研究选取MSS/BRAF野生型mCRC一线接受FOLFOX+贝伐珠单抗(Bev)治疗3-4月,按1:2接受氟化嘧啶(FP)+Bev对比FP/BEV+PD-L1单抗atezolizumab维持治疗。结果为阴性,两组间PFS(7.39对比7.20个月,HR=0.96,P=0.727)和OS(21.9对比22.0个月,HR=0.86,P=0.283)均无差异,PD-L1单抗加入维持治疗并未给MSS型mCRC带来生存获益。
结语
总之,有必要进行更多研究来验证CO.26研究的发现,目前下结论认为CTLA-4单抗+PD-L1单抗能有效治疗MSS性mCRC也许为时尚早。
2015年以来,业界尝试了很多方法,来将MSS型肠癌这种对免疫治疗抗拒的冷肿瘤变为对免疫治疗有效的“热肿瘤”(Hot tumor),核心内容就是通过与其他治疗手段联合,来增加肿瘤的免疫原性,包括抗血管生成治疗、各种靶向药物(如MEK抑制剂)、化疗、放疗、局部毁损治疗(如RFA)。现在看来,结果并不理想,在肠癌领域,还未曾看到任何成功的曙光,MSS型肿瘤背后的免疫耐受机制并不是我们理解的那么简单。
真的能将冷肿瘤变为热肿瘤吗?目前还在研究中的方法,又能有几成胜算?正如癌症免疫治疗先驱、华人科学家陈列平教授说的那样,“癌症免疫治疗能走多远,取决于人类免疫基础研究能走多远”,看来要解决MSS免疫耐受这个问题,只得依靠像陈教授一样潜心于基础研究的科学家做出突破,希望哪一天不要太远。
撰稿 | 陈功 (中山大学肿瘤防治中心)
编辑 | 贾春实(中国医学论坛报)
本文为中国医学论坛报官方APP“壹生”平台独家刊登,未经许可,请勿转载!
查看更多