查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





病例提供者:浙江大学医学院第一附属医院 徐莹
点评专家:重庆医科大学附属第三医院 刘重阳
病例简介
患者女性,31岁。
主诉
泡沫尿伴关节酸痛7年,肢端疼痛1年,加重1月。
病史
现病史
患者7年前无明显诱因下出现泡沫尿,四肢关节、腰背酸痛,口腔溃疡,日照后颜面部不适,无胸闷气急,无颜面部红斑,无头晕乏力,无尿量及尿色变化,查尿蛋白2+,红细胞2+,抗核抗体1:320,抗dsDNA抗体阳性,于我院肾穿刺活检诊断狼疮性肾炎(Ⅳ-S)。予泼尼松+霉酚酸治疗后尿蛋白控制在“±~+”,血肌酐波动在60~70 μmol/L。
6年余前患者蛋白尿复发,停霉酚酸,改泼尼松联合环磷酰胺冲击,累计6 g后,以泼尼松+硫唑嘌呤维持治疗,蛋白尿+,肾功能正常。
5年前患者蛋白尿加重,伴癫痫发作,血肌酐最高至132 μmol/L,予泼尼松+他克莫司及抗癫痫治疗后好转,门诊定期随访,血肌酐控制在100~110 μmol/L之间,尿蛋白持续3+。
4年前患者治疗方案改为泼尼松+他克莫司+霉酚酸,2013年5月肌酐上升至186 μmol/l,予停用他克莫司,改为泼尼松+霉酚酸+雷公藤,患者血肌酐逐渐下降至100~110 μmol/l,尿蛋白2+~3+。
3年前患者停用雷公藤,再次加用他克莫司,泼尼松+霉酚酸+他克莫司持续治疗,血肌酐维持70~90 μmol/L,尿蛋白1+~2+。
1年前患者出现手指指端疼痛,以右侧食指和中指明显,伴局部瘙痒,后逐渐出现局部组织发黑,疼痛加剧,并伴左侧无名指、右侧大脚趾局部点状发黑,遂来我院就诊,考虑手指指端坏疽。查肺动脉压30 mmHg,予停他克莫司,泼尼松5 mg qd+霉酚酸 0.5 bid、羟氯喹控制狼疮活动,阿司匹林肠溶片、氯吡格雷抗血小板,前列地尔改善微循环,波生坦控制肺动脉高压,手指坏疽好转,血肌酐维持70~80 μmol/L,尿蛋白2+。
1月前患者感肢端疼痛、发黑较前加重,伴有头晕乏力,恶心,偶有呕吐,双下肢浮肿,晨轻暮重,无尿量及尿色异常,无胸闷气急,无咳嗽咳痰等,至我院门诊复查,尿蛋白3+,尿红细胞448.3/μl,血白蛋白22.5 g/L,血肌酐172 μmol/L,予停用霉酚酸,改泼尼松30 mg口服qd,环磷酰胺针0.6 g静滴1次。2周后(2017-9-24)复查血肌酐244 μmol/L,再次予环磷酰胺针0.6 g静滴1次。近几日患者感气急,四肢肢端发黑、疼痛加重,无胸痛,无发热,为求进一步治疗,门诊拟“系统性红斑狼疮,狼疮性肾炎”收治入院。
既往史
有高血压病病史7年,血压最高180/100 mmHg左右,目前服用硝苯地平缓释片、氯沙坦钾片、美托洛尔缓释片联合降压,近期血压控制不佳。
既往无糖尿病、心脏病等病史,无手术外伤史。
已婚已育,无类似疾病家族史。
体格检查
体温36.6℃,心率98次/分,呼吸18次/分,血压182/135 mmHg。神志清,精神可,颜面部无皮疹,口唇、双足趾端紫绀,右侧食指和中指、左侧无名指皮肤色黑,右手远端指间关节可见小溃烂。听诊两肺呼吸音清,未及干湿啰音,心律齐,腹软,无压痛,移动性浊音阴性,双下肢无浮肿,双侧巴氏征阴性。
辅助检查
血常规:白细胞计数 9.8×109/L,血红蛋白 87 g/L,血小板194 ×109/L。
尿检:蛋白质 +++(3.0 g/L),红细胞228.7/μl,白细胞177.2/μl;24小时尿蛋白5.27 g。
血生化:血白蛋白 25.5 g/L,血肌酐 328 μmol/L,eGFR 15.31 ml/min。
血免疫球蛋白+补体测定: IgA 216 mg/dl,IgG 722 mg/dl,IgM 22 mg/dl,补体C4 15.0 mg/dl(7~49),补体C3 83.0 mg/dl(58~160)。
C反应蛋白 :8.9 mg/L。
血沉: 45 mm/h。
抗核抗体系列:ANA +1:320 ,可溶性核蛋白抗体、Ssa、Ssa52、抗SSB、抗Scl-70、核小体抗体(+)、抗双链DNA抗体阴性,抗Sm抗体阴性。
APS相关抗体:正常范围。
心脏超声:左室射血分数67%,左心房增大伴左室饱满,二尖瓣关闭不全(中度+),主肺动脉增宽,肺动脉高压(PASP 60 mmHg),心包积液(少量)。
腹部B超:肝胆脾胰未见异常。双肾实质回声增强,皮髓质境界不清,慢性肾病考虑。
肺部CT:两肺弥漫性间质炎症伴纤维化。左下肺钙化灶。心包、两侧胸腔少量积液(图1)。
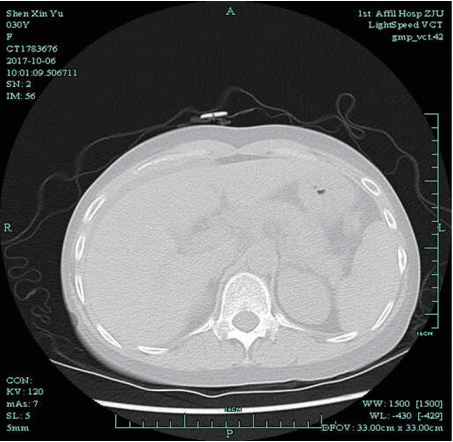 图1 2017-10-6肺部CT
图1 2017-10-6肺部CT
诊断结果
1、重叠综合征
系统性红斑狼疮(SLE)
狼疮性肾炎
慢性肾病伴急性肾损伤
肾性贫血
系统性硬化症
系统性硬化症肾危象
2、恶性高血压
3、间质性肺病(ILD)
4、肺动脉高压
治疗方案及理由
患者恶性高血压,且血压控制不佳,因此首先予以降压治疗。恶性高血压治疗应将舒张压迅速降至安全水平,因此血压控制目标为120~130/80~90 mmHg。使用尼卡地平静脉降压;同时选用抑制肾素,但不影响或能增加肾血流的药物控制血压,联合用药方案为:卡托普利片 12.5~25 mg q6h、可乐定150 μg q8h、非洛地平缓释片5 mg q8h、硝苯地平片10 mg q8h、多沙唑嗪缓释片 4 mg qn、比索洛尔片 5 mg q12h,
患者合并SLE及系统性硬化症,并累及肾、肺等器官。因此入院后予以泼尼松快速减量至15 mg qd,环磷酰胺0.8 g静脉冲击治疗,波生坦加量至125 mg bid,低分子肝素 4100 U qd皮下注射抗凝,前列地尔静推改善微循环。多次复查补体均正常范围,尿常规蛋白3+,隐血+~++,血沉46~68 mm/h。
入院第3周患者出现左足拇趾发红,伴有胀痛,疼痛评分 4 分,余趾端疼痛同无明显改善,伴发热,查双下肢血管彩超无殊。予抗感染止痛对症治疗。左足拇趾逐渐进展至发黑、坏疽。考虑远端坏疽可能,疼痛科会诊予西乐葆、曲马多片止痛。手外科会诊暂不考虑手术,予加用西地那非33 mg tid口服,止痛效果不佳,坏疽无明显好转,疼痛剧烈影响血压控制。
入院第4周患者出现胸闷气急,端坐呼吸,鼻导管吸氧下氧饱和度下降至80%,监测血压144/105 mmHg,心率90次/分,无发热。
动脉血气:二氧化碳分压pCO2 48.7 mmHg,氧分压pO2 63.0 mmHg,实际碱剩余4.2 mmol/L。
血常规:白细胞计数 11.2×109/L,血红蛋白 52 g/L。
血生化:白蛋白29.9 g/L,肌酐366 μmol/L。
血补体正常;超敏C反应蛋白46.90 mg/L,血沉>140mm/h,G试验、GM试验阴性。
2017年11月8日肺部CT:两肺弥漫性间质炎症伴纤维化,对比2017年10月6日CT图像进展;左下肺钙化灶;心包、两侧胸腔少量积液(图2)。
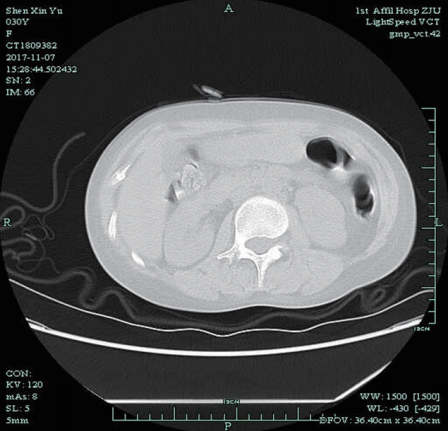 图2 2017-11-8胸部CT
图2 2017-11-8胸部CT
复查心脏超声:左心增大,二尖瓣关闭不全(中度+),主肺动脉增宽,三尖瓣关闭不全(中度-),肺动脉高压(PASP 65 mmHg),左室舒张功能减退,心包积液(少量),左足拇趾持续坏疽,疼痛明显,止痛效果不佳,血压波动110~150/70~110 mmHg。
患者疾病进展且肾功能急剧恶化,调整治疗方案,予改面罩吸氧,输血,促红素针加量,头孢哌酮舒巴坦+卡泊芬净针抗感染,降压药加量,血压控制在120/80 mmHg以下,加强利尿减轻肺水肿,西地那非加量至50 mg tid。疼痛科会诊后于2017年11月21日行B超+CT引导下双侧腰交感神经阻滞+脉冲射频术。
患者肾功能较前好转,肺动脉压力较前下降,调整治疗方案为吗替麦考酚酯250 mg qd,泼尼松10 mg qd、贝那普利10 mg qd、厄贝沙坦150 mg qd、非洛地平5 mg bid、比索洛尔5 mg qd、波生坦 125 mg bid、西地那非 50 mg tid、贝前列素那 40 μg tid、羟氯喹 100 mg bid、骨化三醇0.25 μg qd。
治疗效果
出院后2月随访ANA系列:ANA +1:320 ,可溶性核蛋白抗体、Ssa、Ssa52(+)、抗SSB、抗Scl-70、核小体抗体、抗双链DNA抗体阴性,抗Sm抗体阴性。APS相关抗体:正常范围。
出院后9月随访血常规:白细胞计数 6.9×109/L,血红蛋白 93 g/L,血小板169×109/L。尿检:蛋白质 +(0.7 g/L),红细胞2.9/μl,PH 6.0,比重1.012;尿蛋白肌酐比值1.54 g/g,24小时尿蛋白2.16 g。血生化:血白蛋白 39.7 g/L,血肌酐 166 μmol/L,eGFR 34.64 ml/min。血补体:C4 20 mg/dl(7~49),补体C3 82mg/dl(58~160)。 C反应蛋白 :2.6 mg/L;血沉: 50 mm/h。
病例思考
该患者青年女性,病程7年,SLE诊断明确,在7年的疾病治疗过程中存在病情反复活动,对多种治疗方案效果欠佳,需要定期复查以期达标治疗。
患者本次住院存在肢端疼痛加重(肢端坏疽)、急性肾损伤(血肌酐升高,恶性高血压)、肺部间质病变及肺动脉高压等多系统表现,需要重新评价疾病情况。以急性肾损伤为线索,按照肾前性/肾性/肾后性等可能因素进行分析,该患者最可能为肾性原因所致,而狼疮是最可能的原因。但仔细评估患者补体、抗双链DNA抗体等提示狼疮活动指标均不高,狼疮活动的证据相对欠缺。同时,追寻指端溃疡、肺间质病变、肺动脉高压、急性肾衰,查体似面具样面容,口唇、鼻翼皮肤发紧变硬,抗Scl-70持续阳性等线索最可能的原因为合并系统性硬化症肾危象的可能。而此后患者病情并未随治疗调整而改善,随着患者憋气,肺部病变进展等线索,考虑合并感染的证据越来越充分,因此该患者本次病情反复为SLE合并系统性硬化症肾危象及感染的综合结果。
该患者为诊断明确的SLE患者,而狼疮为多系统受累的疾病并且有合并其他结缔组织病的可能,加之长期激素及免疫抑制剂的应用,使每次症状出现时,病情评估相对复杂。因此在每次对患者进行评估时,须结合详细的病史,查体及实验室检查综合判断。
专家点评 重庆医科大学附属第三医院 刘重阳
SLE的治疗原则
该患者青年女性,病史多年,以肾脏病变为首发表现,有关节表现,口腔溃疡表现,结合患者肾脏穿刺病理结果,抗核抗体、抗dsDNA抗体阳性,SLE诊断明确。从患者的病情方面来看,该患者的治疗过程异常艰辛,在缓解-复发-调整方案的循环中不断摸索新的治疗方案。
SLE患者的治疗目标是保证长期生存,实现尽可能低的疾病活动度,预防器官损伤,最大程度地减少药物毒性,提高生活质量,并教育患者自身在疾病管理中发挥的作用。相关的治疗药物包括糖皮质激素及免疫抑制剂,而这些药物通常为双刃剑。在治疗疾病的同时,也使患者的感染风险增加。如何基于循证医学基础上进行个体化治疗,是每个医生及患者的目标及需要,准确的判断病情才能有良好的预后。
SLE复发的预测指标
预测SLE加重(特别是狼疮性肾炎)最有用的实验室检测是抗dsDNA抗体血清滴度开始升高和低补体血症开始发生(特别是CH50、C3和C4)。此外, IgG水平升高以及补体分解和活化产物的升高也可提示疾病恶化。血清补体C1q水平的持续低下也与狼疮性肾炎的活动性有关。虽然目前的文献推荐了一些预测疾病复发的指标,但相关指标的临床应用却有限,就像这例患者,当一些指标变化不明显时,如何决策,是每一位医生面临的挑战。该患者在本次就诊及治疗的过程中,肾功能、肺动脉压力等指标一度恶化确实值得深思。从患者的治疗效果倒推,感染在上述症状及指标的恶化中起着推波助澜的作用,而感染既可以导致SLE原发病活动又给后续药物的治疗增加了难度。而作者准确抓住患者存在喘憋等难以解释的症状,及时进行肺CT等检查明确了感染的存在,并及时给予了抗感染治疗,使患者的病情再次得到控制。整个诊治过程,逻辑清晰,值得学习。
查看更多