查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





2023年欧洲肿瘤内科学会(ESMO)大会于10月20日至24日在西班牙马德里召开。作为全球最具影响力的肿瘤学会议之一,ESMO官方近日公布了包括LBA在内的所有摘要。默沙东医学部第一时间携手泌尿外科领域专家:来自西安交通大学附属第一医院的吴开杰教授和陕西省人民医院的任伟教授,精选转移性尿路上皮癌重磅摘要,抢先了解大会盛况,利用[泌见ESMO]栏目,以飨读者。

吴开杰 教授
医学博⼠ 副主任医师 研究员 博⼠⽣导师
⻄安交通⼤学第⼀附属医院党委⻘⼯部部⻓、团委书记
美国德州⼤学⻄南医学中⼼访问学者
欧洲泌尿外科学会会员
美国癌症学会会员
美国基础泌尿外科学会会员
国家⾃然科学基⾦⼀审专家
中国研究型医院学会泌尿外科学专委会⻘年委员
中华医学会泌尿外科分会⻘年委员会转化学组秘书
中国抗癌协会泌尿男⽣殖系肿瘤专业委员会精准医学学组委员
陕⻄省⻘联常委
陕⻄省性学会⻘委会副主委
核⼼期刊《现代泌尿外科杂志》主编助理
核⼼期刊《中华肿瘤防治杂志》、《现代肿瘤医学》、《国际泌尿系统杂志》、《中国医学伦理学》等中⻘年编委

任伟 教授
主任医师 医学博士 教授
陕西省医师协会泌尿分会委员
西安市医学会泌尿分会委员
西安市医学会结核分会常委
陕西省保健学会泌尿生殖学会委员
陕西省保健协会结核病防治委员会常务委员
主要从事前列腺疾病及泌尿系肿瘤的研究。发表相关论文二十余篇,sci论文多篇,主持省级科研课题三项,参与国家及省级科研研究5项。获陕西省科技进步二等奖一项
尿路上皮癌(UC)临床结局与所处疾病阶段密切相关,5年生存率在非肌层浸润性膀胱癌(NMIB)、肌层浸润性膀胱癌(MIBC)和转移性尿路上皮癌(mUC)分别为90%、50-82%和5%,提示mUC阶段存在巨大未被满足的需求[1]。目前含铂化疗方案作为局部晚期或转移性(la/mUC)的标准一线治疗虽有效,但部分患者无法耐受,且存在复发风险,二线化疗疗效欠佳,亟需更好的治疗方案[2]。
图1. 尿路上皮癌治疗路径
基于UC肿瘤细胞多高表达PD-L1,有较高的基因突变负荷,新生肿瘤抗原较多,免疫治疗为UC带来了新的治疗策略[3]。UC也是所有泌尿系肿瘤中发生基因突变最多的肿瘤[4],可精准分型,靶向治疗因FGFR突变抑制剂的获批实现突破[5]。ADC药物在肿瘤领域蓬勃发展,临床研究不断深入,国内外已有ADC药物获批用于治疗mUC,但获批适应证均为后线[6]。如何通过不同药物的联合以及新药的研发满足患者需求是亟须解决的问题。根据不同的生物学特征采用不同的治疗方案以及结合相关靶点和患者特征制定相关治疗策略是研究探索方向之一。
摘要LBA6-EV-302/KEYNOTE-A39研究:Enfortumab Vedotin联合帕博利珠单抗vs化疗治疗未经治疗的不可切除的局部晚期或转移性尿路上皮癌的开放性、随机、Ⅲ期研究
EV-302/KEYNOTE-A39: Open-label, randomized phase Ⅲ study of enfortumab vedotin in combination with pembrolizumab (EV+P) vs chemotherapy (Chemo) in previously untreated locally advanced metastatic urothelial carcinoma (la/mUC)
以铂类为基础的化疗是局部晚期或转移性尿路上皮癌(la/mUC)的标准治疗(SOC)。由于长期结局不佳,仍然存在未满足的临床需求。EV-302研究是一项全球、开放性、随机、Ⅲ期临床研究,旨在评估Enfortumab Vedotin(EV)联合帕博利珠单抗(P)在符合接受顺铂或卡铂化疗条件且既往未经治疗的la/mUC患者中的疗效[7]。
将既往未经治疗的la/mUC患者(无论PD-L1表达如何)以1:1比例随机分组。EV+P组患者在第1天和第8天接受EV(1.25 mg/kg;IV)和在第1天接受P(200 mg;IV)治疗,每3周为1个周期。化疗组患者则接受吉西他滨联合顺铂或卡铂治疗。研究主要终点为盲态独立中心审查(BICR)基于RECIST 1.1标准评估的无进展生存期(PFS)和总生存期(OS)。次要终点包括总缓解率(ORR)和安全性。
图2. EV302/Keynote-39研究设计
研究共纳入886例患者(EV+P组:442例;化疗组:444例),两组之间的患者基线特征均衡。数据截止时,中位随访时间为17.2个月。
表1. EV302/Keynote-39研究中患者基线特征
疗效结果显示,相比化疗组,EV+P组患者PFS 显著延长,疾病进展或死亡风险降低55%(中位 PFS 分别为12.5 个月vs 6.3 个月;HR=0.45,95%CI:0.38-0.54;P<0.00001)。
图3. EV302/Keynote-39研究中BICR评估的无进展生存期(PFS)结果
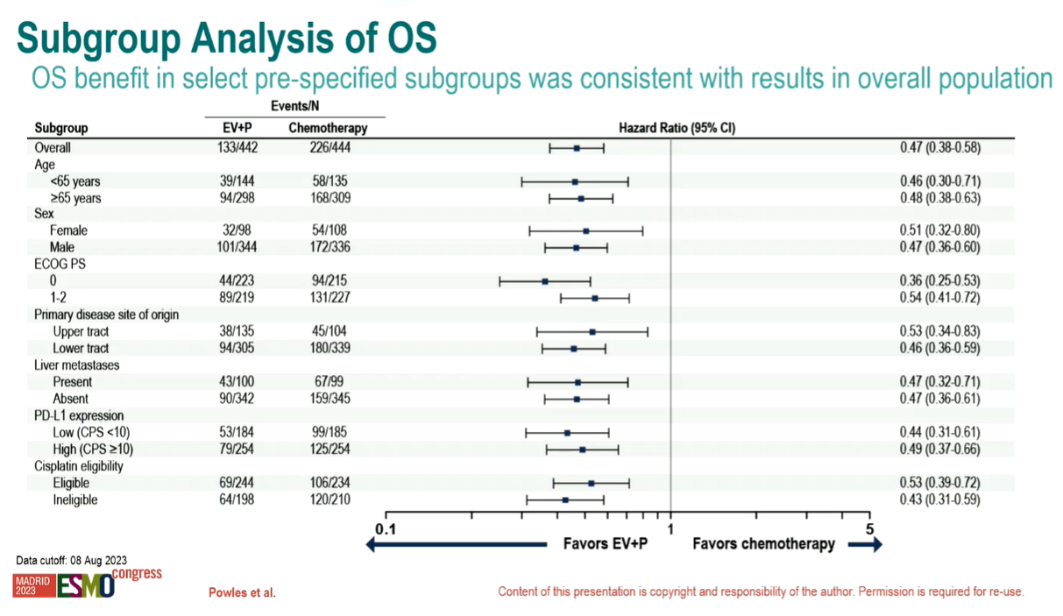
相比化疗组,EV+P 组OS 同样显著延长,患者死亡风险降低达53%(中位 OS 分别为31.5个月vs 16.1个月;HR=0.47;95%CI:0.38-0.58; P<0.00001)。EV+P 组和化疗组确认的ORR 分别为67.7% 和44.4%(P<0.00001)。
图4. EV302/Keynote-39研究中总生存期(OS)结果
安全性方面,EV+P组和化疗组≥3级治疗相关不良事件(TRAE)发生率分别为55.9%和69.5%;EV+组最常见≥3级TRAE包括斑丘疹(7.7%)、高血糖症(5.0%)和中性粒细胞减少症(4.8%),化疗组最常见≥3级TRAE包括贫血(31.4%)、中性粒细胞减少症(30.0%)和血小板减少症(19.4%)。EV相关特别关注最常见(≥5%)≥3级TRAE包括皮肤反应(15.5%)、周围神经病变(6.8%)和高血糖症(6.1%)。P相关特别关注最常见(≥5%)≥3级治疗期间出现的AE(TEAE)包括严重皮肤反应(11.8%)。
图6. EV302/Keynote-39研究中治疗相关不良事件发生情况(TRAE)
Enfortumab Vedotin联合帕博利珠单抗显著改善既往未经治疗la/mUC患者的临床结局,与化疗方案相比,EV+P组患者中位PFS和OS几乎增加了一倍。联合方案安全性可控,没有发现新的安全性信号。以上结果支持EV+P联合方案作为 la/mUC患者新的一线标准治疗。
摘要LBA7- CheckMate 901研究:纳武利尤单抗联合吉西他滨-顺铂与吉西他滨-顺铂单独治疗既往未经治疗的不可切除或转移性尿路上皮癌的Ⅲ期临床研究
Nivolumab plus gemcitabine-cisplatin versus gemcitabine cisplatin alone for previously untreated unresectable or metastatic urothelial carcinoma: Results from the phase Ⅲ CheckMate 901 trial
几十年来,以顺铂为基础的化疗已成为符合顺铂治疗条件的不可切除或转移性尿路上皮癌(mUC)患者的一线标准治疗,既往多种改善这种治疗策略的尝试均以失败告终。本次报告了在 CheckMate 901中纳武利尤单抗(NIVO)联合吉西他滨-顺铂(GC)或GC方案治疗的结果[8]。
CheckMate 901(NCT03036098)研究是一项全球、开放性、随机、Ⅲ期临床研究。研究共纳入608例顺铂耐受且既往未经治疗的不可切除或转移性UC患者。患者被随机分组,分别接受NIVO(360mg,D1)+ GC治疗,每3周1个周期,最多6个周期,随后接受NIVO单药治疗(480 mg),每4周1个周期,直至疾病进展/不可接受的毒性或最多24个月,或仅接受GC治疗,每3周1个周期,最多6个周期。研究分层因素包括PD-L1表达水平和肝转移情况。研究主要终点为BICR评估的OS和PFS。探索性终点为BICR评估的客观缓解率(ORR)。
图7. CheckMate 901研究设计
中位随访时间为33.6个月。NIVO+GC组相比GC组OS (HR=0.78;95% CI:0.63-0.96;P= 0.0171)和 PFS(HR=0.72;95%CI:0.59-0.88;P=0.0012)均显著改善。NIVO+GC 组 ORR 和完全缓解率(CR)分别为57.6% 和21.7% ,GC 组则为43.1% 和11.8% 。NIVO+GC组CR中位持续时间为37.1个月(95%CI:18.1个月-不可估计),GC组13.2个月(95%CI:7.3个月-18.4个月)。
图8. CheckMate 901研究中总生存期(OS)结果
安全性方面,≥ 3级TRAE发生率分别为61.8%(NIVO+GC组)和51.7%(GC组)
图9. CheckMate 901研究中不良事件发生情况
摘要2359O- THOR研究:厄达替尼(erda)vs 帕博利珠单抗(pembro)治疗携带选择性FGFR变异(FGFRalt)且既往接受过治疗的晚期或转移性尿路上皮癌的Ⅲ期临床研究
Phase Ⅲ THOR study: Results of erdafitinib (erda) vs pembrolizumab (pembro) in pretreated patients (pts) with advanced or metastatic urothelial cancer (muc) with select fibroblast growth factor receptor alterations (FGFRalt)
THOR研究是一项开放性、随机、Ⅲ期临床研究,研究共纳入了两个独立研究队列。队列1评估了携带FGFR变异且既往至少接受过一线治疗(包括PD-(L)1单抗)后进展的mUC患者中厄达替尼对比化学治疗的疗效。队列2评估了既往接受至少一线治疗(不包含PD-(L)1单抗)后进展的mUC患者接受厄达替尼相比帕博利珠单抗治疗的疗效。本次报道了THOR研究队列2数据[9]。
厄达替尼是一种口服泛FGFR酪氨酸激酶抑制剂,获批用于治疗含铂化疗后进展的易感FGFR3/2变异局部晚期或mUC患者。FGFR变异肿瘤富含lum1亚型,抗PD-(L)1治疗临床获益可能有限。在随机化、开放性、Ⅲ期THOR研究(NCT03390504)队列2中评估了厄达替尼 vs 帕博利珠单抗在既往未经PD-(L)1单抗治疗的mUC患者中的疗效。
研究中患者入组标准包括年龄≥18岁的不可切除晚期或mUC患者,携带选择性FGFR3/2变异,ECOG PS评分为 0-2分,既往1线治疗后疾病进展且为PD-(L)1单抗初治。所有符合条件患者随机以1:1比例分别接受厄达替尼 8mg 每天1次(在药效学指导下增加至9mg)或帕博利珠单抗200mg 每3周1次治疗。研究主要终点为OS。次要终点包括PFS 、ORR和安全性。
图10. THOR研究设计(队列2)
截至2023年1月15日数据截止时,中位随访时间为33.2个月。意向治疗集包括厄达替尼组175例患者和帕博利珠单抗组176例患者。研究主要终点OS未到达,治疗组之间的OS无统计学显著差异。相比帕博利珠单抗,厄达替尼组PFS更长,ORR更高,但缓解持续时间更短。
图11. THOR研究(队列2)中总生存期(OS)结果
安全性结果显示,厄达替尼组中任何级别的最常见TRAE 包括高磷血症(73%),口腔炎(45%),腹泻(45%)和口干(35%);帕博利珠单抗组最常见TRAE包括瘙痒症(12%),乏力(10%),甲状腺功能减退(10%)和疲劳(10%)。厄达替尼组中3-4级TRAE 和严重 TRAE 发生率分别为43% 和13% ,帕博利珠单抗组分别为12% 和10% 。两组TRAE导致死亡的发生率分别为2% 和0% 。因TRAE中止治疗的患者比例分别为15%(厄达替尼组)和5%(帕博利珠单抗组)。
表2. THOR研究(队列2)中TRAE发生情况
摘要2362MO- THOR研究:厄达替尼(erda)vs 化疗(chemo)治疗携带选择性FGFR变异(FGFRalt)的晚期或转移性尿路上皮癌:亚组分析结果
Erdafitinib (erda) vs chemotherapy (chemo) in patients (pts) with advanced or metastatic urothelial cancer (mUC) with select FGFR alterations (FGFRalt): Subgroups from the phase Ⅲ THOR study
THOR研究探索了厄达替尼在携带选择性FGFR变异的晚期或mUC患者中的疗效。本篇摘要介绍的是THOR研究中队列1的数据[10]。
约20%的mUC患者中存在FGFR变异。厄达替尼作为一种口服泛FGFR酪氨酸激酶抑制剂获批用于治疗含铂化疗后疾病进展的易感FGFR 3/2变异的局部晚期或mUC患者。THOR(NCT03390504)研究是一项随机、Ⅲ期临床研究,在队列1中研究旨在评估相比化疗,厄达替尼在既往接受一至二治疗(包括PD-(L)1单抗)后进展的mUC患者中是否带来OS获益。
研究纳入了≥18岁,携带选择 FGFR3/2a变异(突变/融合)的不可切除晚期或mUC患者,ECOG PS评分为 0-2分,具有足够的器官功能,既往接受包括PD-(L)1单抗在内的一至二线系统治疗后疾病进展。患者随机以1:1比例分别接受厄达替尼(8mg,药效学指导增加至9mg,每天1次)或研究者选择的化疗(多西紫杉醇或长春氟宁,每3周1次)治疗,直到疾病进展或出现不能耐受的毒性。研究主要终点是 OS。次要终点包括PFS 、ORR和安全性。
图12. THOR研究设计(队列1)
研究结果显示,共纳入266例患者,136例患者接受厄达替尼治疗,130例接受了研究者选择的化疗,患者中位年龄67岁。中位随访时间为16个月。研究达到了主要终点:厄达替尼 vs化疗的中位OS为12.1个月 vs 7.8个月(HR=0.64;95%CI:0.47-0.88;P=0.005)。各亚组均可观察到OS获益。与化疗相比,厄达替尼改善了中位PFS(6个月 vs 3个月)和ORR(46% vs 12%)
图13. THOR研究(队列1)中总生存期(OS)结果
厄达替尼组最常见的TRAE包括高磷血症(79%)、腹泻(55%)和口腔炎(46%),化疗组最常见的TRAE包括贫血(28%)、脱发(21%)和恶心(20%)。各组均有46%的患者发生了3/4级TRAE。厄达替尼组和化疗组分别有1例和6例患者因TRAE导致死亡。
表3. THOR研究(队列1)中TRAE发生情况
本次ESMO大会mUC主要进展分享如上文,可见目前主要研究方向为ADC类药物联合免疫治疗、免疫治疗,以及精准靶向治疗对比化疗或作为化疗后线的治疗方案。
参考文献
[1] Fenton SE, et al. Front Oncol. 2023 Jan 4; 12:1069356.
[2] Sternberg CN, et al. Eur J Cancer. 2006 Jan; 42(1):50-4.
[3] Jain RK, et al. Curr Treat Options Oncol. 2018 Dec 15;19(12):79.
[4] Alexandrov LB, et al. Nature. 2013 Aug 22; 500(7463):415-21.
[5]https://www.fda.gov/news-events/press-announcements/fda-approves-first-targeted-therapy-metastatic-bladder-cancer
[6] Lattanzi M, et al. Expert Rev Anticancer Ther. 2020 Jul; 20(7):551-561.
[7] Powles T, et al. 2023 ESMO. LBA6.
[8] van der Heijden M, et al. 2023 ESMO. LBA6.
[9] Siefker-Radtke A, et al. 2023 ESMO. 2359O.
[10] Loriot Y, et al. 2023 ESMO.2362MO.
声明:
本资讯由默沙东医学团队编辑提供,旨在用于医学专业人士间的学术交流,请勿随意转发或转载。文中相关内容不能以任何方式取代专业的医疗指导,也不应被视为治疗建议。医学专业人士对文中提到的任何药品进行处方时,请严格遵循该药品在中国批准使用的说明书。默沙东不承担相应的有关责任。
审批号:MI-PD1-5164-CN
Expiration Date:2024-11-1
查看更多