查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





(一)MMR和MSI是什么?
MMR,MisMatch Repair,错配修复,是重要的DNA修复机制之一。在DNA在复制或重组过程中,即使存在着精细的调控,但此过程中仍会产生碱基错配,缺失或插入等错误。而对于这些时有发生的碱基突变,长期积累,有的致病甚至致癌,不过,机体也存在着一套自我修复系统,错配修复(MMR)基因所表达的错配修复蛋白,就像“修理工”一样对存在错配的碱基进行修复。
微卫星( microsatellite,MS) 是指基因组中以少数几个核苷酸( 多为 1-6个) 为单位串联重复的 DNA 序列。其实,微卫星是机体的一种常见的基因变异类型。在基因组中已知的微卫星位点约为一千九百万个。微卫星的重复序列在DNA复制过程中固有不稳定性,也就是说微卫星序列长度或碱基组可能会“时多时少”,而在正常细胞中DNA错配修复系统可以快速修正这种错误。但如果上面我们说的MMR系统存在缺陷, 就会引起重复单位插入或缺失导致微卫星长度改变,从而表现为MSI,即微卫星不稳定性(microsatellite instablility)。
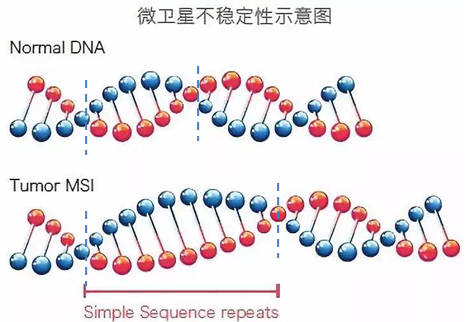
(上图可见肿瘤组织微卫星碱基重复增多表现MSI)
(二)MMR与MSI如何检测?
通过上面介绍,我们知道无论是错配修复系统(MMR),还是微卫星(MS)都是基因中很常见的形式。如存在异常,怎样检测出来更重要。
MMR的检测:通过免疫组化(IHC)检测MMR蛋白(MLH1、MSH2、MSH6、PMS2)的表达情况,如果四个蛋白全部阳性表达,则错配功能正常(proficient mismatch repair,pMMR);若任一蛋白表达缺失(阴性),则错配修复功能缺陷(deficient mismatch repair,dMMR)。
对于MMR四种蛋白的检测,IHC染色多表现为下述表格中的模式。因为这4 种 MMR 蛋白通常会形成 2 个异二聚体复合物发挥功能, 即 MLH1-PMS2 和 MSH2-MSH6。因此,MLH1 突变时常常表现为 MLH1 和 PMS2同时表达缺失,而 MSH2 突变则常常引起 MSH2和 MSH6 同时表达缺失。然而,还有少数情况下,由于 MLH1 和MSH2 还可以可以与其他蛋白质形成异二聚体;不与PMS2及MSH6搭伴。因此,当 PMS2 或 MSH6突变时,MLH1 和 MSH2仍然可以稳定存在,表现为染色正常。

目前认为产生MMR缺陷即dMMR状态原因有三点:
(1)MMR基因(MLH1、MSH2、MSH6、PMS2)发生胚系或体系致病突变(无论胚系还是体系突变后MMR基因不能表达相应MMR蛋白);
(2)EPCAM基因缺失导致MSH2启动子高度甲基化引起的MSH2基因表达沉默;
(3)MLH1启动子区高甲基化引起MLH1表达缺失;
MSI的检测:上面我们说到基因组中已知的微卫星位点有很多,所以在MSI 诊断中,检测位点(Panel)的选择是关键,如果位点选择错误会导致假阳性或者假阴性率增高。
(1)检测位点:
1997年美国癌症中心(NCI)基于金标准方法对待检的微卫星位点选择进行了统一,即“NCI Panel ”,包括5个微卫星位点, 由2个单核苷酸位点(BAT-25和BAT-26)和3个双核苷酸位点(D2S123、D5S346 和 D17S250)组成,也被称作「2B3D NCI Panel」。同时,也统一了该Panel的诊断标准:若这5个微卫星位点中有2个或2个以上的微卫星不稳定,则判定为微卫星高度不稳定(MSI-high,MSI-H);若有1个微卫星不稳定,则判定为微卫星低度不稳定(MSI-low,MSI-L);若5个微卫星位点均稳定,则为微卫星稳定(Microsatellite stable,MSS)。目前《NCCN遗传和家系风险评估指南》对于MSI进行检测也是推荐了2B3D NCI Panel和5个单核苷酸的Panel。

(2)MSI检测方法:
1.多重荧光PCR毛细管电泳法是MSI检测“金标准”,推荐采用5个微卫星(MS)位点检测,比较肿瘤细胞与正常细胞的PCR检测结果,以确定肿瘤细胞MSI状态为MSI-H、MSI-L、MSS中的哪一种。
2.二代测序(NGS):采用目标区域NGS对肿瘤组织中多个MS位点进行检测。
检测方法优劣比较:
MMR-IHC检测:优点是省时、经济,容易开展,可反映功能缺失的错配修复蛋白是哪一个。MSI-PCR检测:优点是采用标准化的检测流程,结果易判读,能够直接反映肿瘤的MSI状态,缺点是相对复杂,需正常对照,费用相对较高,不能确定突变基因是哪个,且需一定含量的肿瘤细胞才能保证结果的准确性。MSI-NGS检测:优点是通量大,可同时检测分析基因组上大量的微卫星序列而具有高灵敏度,且能同步检测肿瘤靶向用药相关基因突变以及TMB等,能极大提高分子诊断效率,有利于降低样本量。缺点是费用高,对分析技术要求高。
(三)MMR与MSI关系?
在生物过程上来讲,dMMR是因,MSI-H是果,正是由于错配修复蛋白的功能异常,才导致了DNA复制过程中随机产生的错误无法被正常修复,从而出现了MSI-H的现象。简言之就是MMR修复机制出现了故障,dMMR 表现为高频度微卫星不稳定(MSI-H)。pMMR 表现为低频度微卫星不稳定(MSI-L)或微卫星稳定(MS-S)。
大量的临床试验证实分子水平的MSI检测与蛋白水平MMR检测具有高度关联性,其中在结直肠癌两者的一致性约为92%,在子宫内膜癌两者的一致性是高达94%。
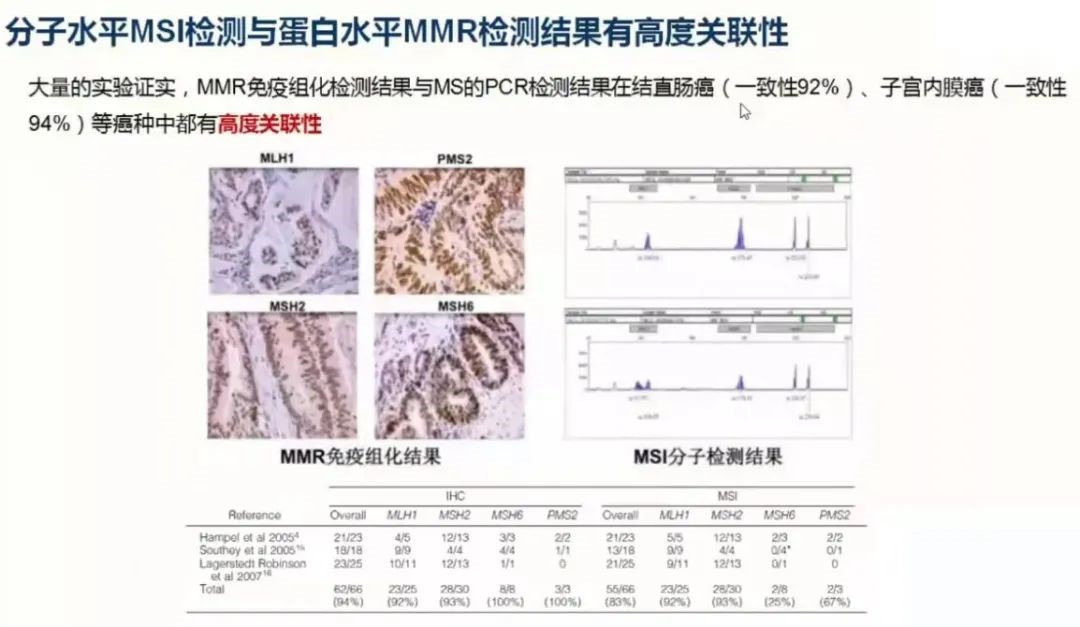
在实际的临床工作中,大概有1%-10%的患者发生MMR与MSI检测不一致的情况。
MMR与MSI检测不一致情况主要有以下两种类型:
♦ dMMR vs MSS,其发生的原因可能为:
①某些MMR蛋白的缺失,被功能代偿
②MLH1启动子甲基化导致的肿瘤异质性,从而影响结果判断。
♦ pMMR vs MSI-H,其发生的原因可能为:
①某些MMR蛋白发生错义突变,但仍存在相应抗原而被IHC检测所识别为正常表达。但实际上蛋白功能已经丧失,导致错配修复功能的缺陷,已经导致发生MSI。即pMMR假阳性。②由四种基因以外的其他基因引起的MSI,如POLE、POLD。
(四)检测MMR/MSI有何意义?
这里仅局限在妇科肿瘤,讨论检测MMR/MSI的意义
(1)对遗传性子宫内膜癌(林奇综合征表现形式之一)的筛查。
子宫内膜癌大多数属于散发,一小部分则具有家族遗传性,这部分病例属于林奇综合征。林奇综合征(Lynch syndrome,LS)是一种常染色体显性遗传性癌症易感性疾病,由于错配修复基因的胚系突变引起。MLH1、MSH2、MSH6和 PMS2胚系突变导致LS。此外, EPCAM(epithelial cell adhesion molecule)基因的胚系突变可以引起MSH2 基因的启动子甲基化,从而引起 MSH2 蛋白质的表达缺失,进而引发 LS(这种情况结直肠癌多见,内膜癌少见,内膜癌筛查林奇综合征可以不检测EPCAM有无胚系突变)。LS 患者患多种癌症的风险显著增加,包括结直肠癌、子宫内膜癌、胃癌、卵巢癌、胰腺癌、输尿管癌、肾盂癌、胆道癌和脑肿瘤等。虽然现在林奇综合征,在结直肠癌中讨论的最大,但其实子宫内膜癌也不少,而且很多林奇综合征,首发表现为子宫内膜癌,有学者认为子宫内膜癌是林奇综合征的“前哨癌”。

(这是我们一例子宫内膜癌病例,术后病理提示MMR蛋白缺失,抽血再进行MMR胚系检测发现MSH6存在致病变异,诊断林奇综合征)
我们知道MMR胚系突变可引起dMMR,但也存在一种情况: MMR蛋白缺失,并非有MMR蛋白胚系突变引起,体系的突变也会导致MMR蛋白缺失,这种属于林奇样综合征(LLS, Lynch like syndrome)。林奇样综合征(LLS):IHC免疫组化结果显示为 dMMR,但是却没有检测到 MMR 基因或 EPCAM 基因的胚系突变。如果肿瘤检测结果为 MLH1 表达缺失,则还需要排除 MLH1 启动子甲基化。林奇样综合征的发生率很高,大约占 dMMR 病例的 56%~71%。引起LLS可能原因有:IHC结果读片错误,未用最新检测手段来检测 MMR 基因的胚系突变,普通的二代测序难以检测出 PMS2 的突变。少见的其他基因的胚系突变也可引起 MSI,如双等位基因 MUTYH 突变,体细胞镶嵌等。
对于遗传性子宫内膜癌,免疫组化检测MMR及PCR检测MSI都可以,不推荐同时检测,因为免疫组化一般病理科都可以开展,一般把IHC检测MMR蛋白作为初筛,最终诊断林奇综合征,MMR基因的胚系检测作为“金标准”。
(2)指导妇科肿瘤治疗
微卫星不稳定性(MSI)-->无法修复的基因在各种外在环境影响下开始突变,越来越多,肿瘤突变负荷(TMB)增加,进而产生了相关新抗原-->淋巴细胞受到调动,形成更多肿瘤浸润淋巴细胞-->PD-1/PD-L1抑制剂更有效,--> 免疫治疗的获益人群。NCCN指南已推荐对于复发或晚期宫颈癌,子宫内膜癌,如果MSI-H/dMMR状态,考虑用免疫治疗(帕博利珠单抗)。
(3)对子宫内膜癌的预后判断
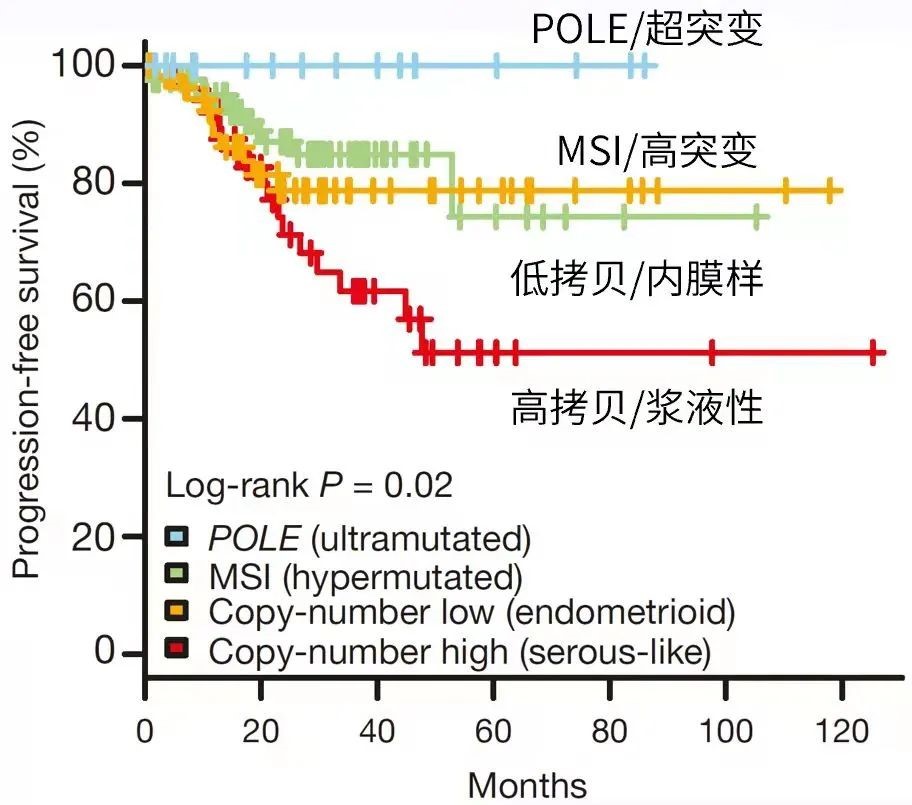
2013年 TCGA通过多组学联合分析,将子宫内膜癌基于分子特征进行重新分类① POLE突变型,占比7%,预后最好;② 高频微卫星不稳定型,占比28%;③ 低拷贝数型,占比39%;④ 高拷贝数型,主要为浆液性癌,占比26%。分子分型检测作为组织分型的补充,可准确提示患者预后,其中POLE突变型最好,MSI-H次之,高拷贝数型最差。
查看更多