查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





2019年第20届世界肺癌大会(WCLC)在西班牙巴塞罗那盛大召开,今年的会议主题是“Conquering Thoracic Cancers Worldwide”。目前已有4个不同的PD-1/PD-L1抑制剂被批准用于肺癌领域的治疗,包括PD-1抑制剂纳武利尤单抗(Nivolumab)和帕博利珠单抗(Pembrolizumab),以及PD-L1抑制剂阿特珠单抗(Atezolizumab)和德瓦鲁单抗(Durvalumab)。本届WCLC大会上,我们也欣喜的看到国产PD-1抑制剂开始闪亮舞台,带来了源自中国肺癌临床研究的声音。如今大会已落下帷幕,会上又有哪些免疫治疗领域的重要临床进展呢?
一、 NSCLC
1、晚期二线
1) CheckMate 017/057研究5年生存数据更新:显著提高长期生存达5倍
CheckMate 017和CheckMate 057研究是Nivolumab两项关键大型开放随机的III期研究,也是免疫抑制剂开启NSCLC治疗大门的经典研究。该研究主要评估Nivolumab(3mg/kg,q2w)与标准治疗多西他赛(75mg/m2,q3w)在既往含铂双药化疗期间或之后进展的晚期NSCLC患者中的疗效和安全性,对照组进展后允许交叉。两项研究的主要研究终点均为OS。
2015年ASCO首次报道了CheckMate 017/057的1年生存率结果,在鳞癌组中,nivovs多西他赛为42% vs 24%,死亡风险降低41%;非鳞癌组为51% vs 39%,死亡风险降低27%。基于这两项研究结果,Nivolumab成功获得了单药二线治疗晚期NSCLC的适应证。
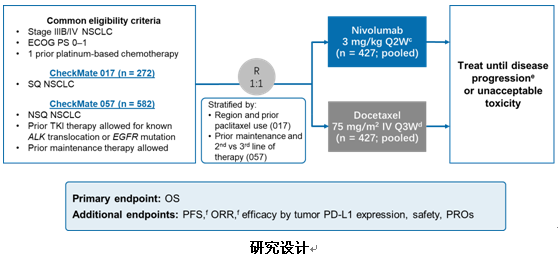
本次WCLC大会公布了这两项研究的5年生存数据结果,经过5年随访,接受nivo治疗的患者有50例存活,接受多西他赛治疗的患者有9例。nivovs多西他赛5年OS率为13.4%vs 2.6%(HR=0.68 [95%CI,0.59-0.78]),同时在治疗有效的患者中,32%接受nivo治疗的患者在5年时依旧应答,而多西他赛组中已无应答患者,两组中位DOR分别为19.9个月vs5.6个月。5年生存数据显示,nivo较多西他赛显著提高长期生存达5倍,免疫治疗一旦起效疗效持久,验证了免疫治疗长期生存的优势。
2) 卡瑞利珠单抗单药二线治疗不同PD-L1表达水平的晚期/转移性NSCLC的创新性Ⅱ期伞式研究
SHR-1210-II-201是由广东省人民医院吴一龙教授牵头的一项前瞻性II期伞式研究,在既往接受过治疗的中国晚期或转移性NSCLC患者中,探索了不同PD-L1表达水平患者接受卡瑞利珠单抗单药治疗的疗效和安全性。研究纳入在铂类双药化疗期间或之后进展的EGFR和ALK突变阴性的NSCLC患者,基于PD-L1表达水平分配到4个亚组中。对于EGFR或ALK突变阳性的患者,如果其接受过至少一线TKI治疗、且肿瘤PD-L1表达≥50%,也可纳入到研究中。所有患者均接受卡瑞利珠单抗200 mg q2w治疗,直至无临床获益。该研究的主要研究终点是客观缓解率(ORR),其他研究终点包括无进展生存期(PFS)、总生存期(OS)和安全性等。
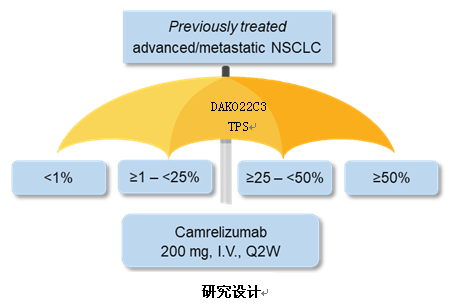
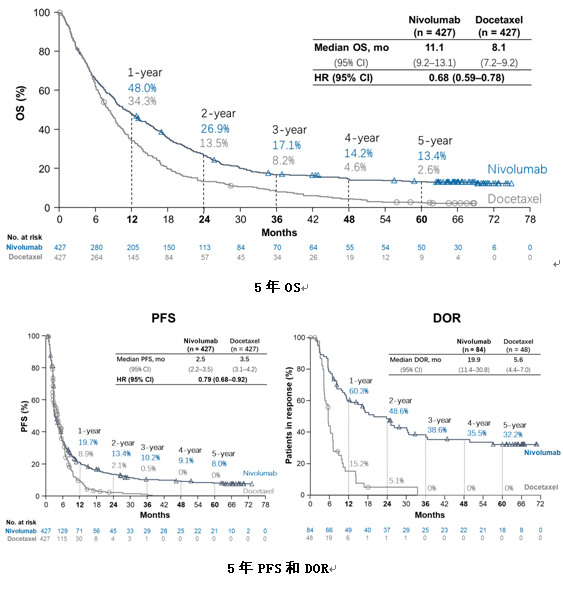
在所有接受筛查的259例患者中,229例患者可进行病理评估。在PD-L1表达方面,47.6%(109/229)患者PD-L1<1%,27.1%(62/229)患者PD-L1≥1%~<25%,8.7%(20/229)患者PD-L1≥25%~<50%,16.6%(38/229)患者PD-L1≥50%。
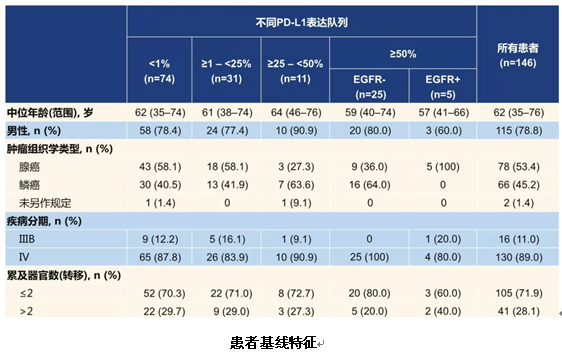
研究最终共纳入了146例患者,ITT人群的ORR为18.5%[95%可信区间(CI) 12.6%~25.8%]。亚组分析显示,PD-L1表达与疗效呈正相关;在EGFR突变的患者中未观察到疾病缓解。此外,应答患者具有长久的持续缓解,其中位缓解持续时间(DoR)为15.1个月(95%CI 5.5个月~NR)。所有患者的中位PFS为3.2个月(95%CI 2.0个月~3.4个月),中位OS为19.4个月(95%CI 11.6个月~NR)。
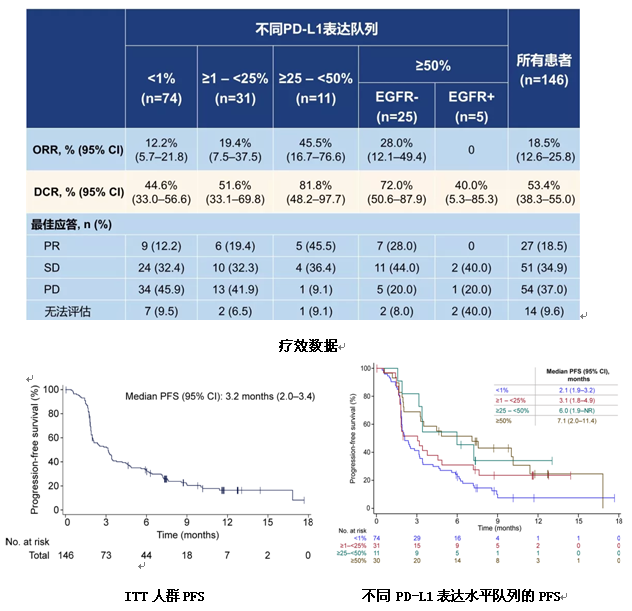
在安全性上,任意级别的治疗相关不良事件(TRAEs)发生率为87%,其中≥3级TRAEs发生率为17.1%,13.7%患者出现严重TRAEs,13.7%患者因TRAEs导致剂量调整或中断,4.8%患者因TRAEs导致治疗停止。
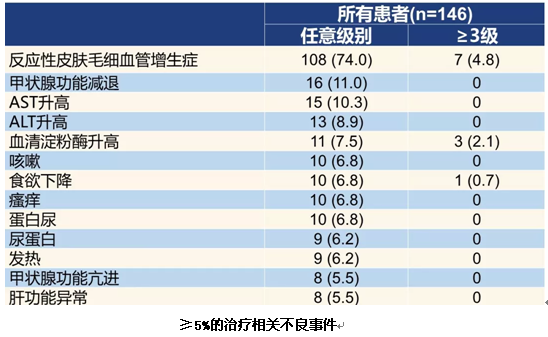
这是第一个国产PD-1抑制剂在既往接受过治疗的中国晚期/转移性NSCLC患者中的研究数据,与二线化疗的既往数据相比,卡瑞利珠单抗在ORR、PFS和OS上都有所提高。其中,PD-L1<1%的患者疗效与二线单药化疗相似,而PD-L1表达越高的患者,越能从卡瑞利珠单抗治疗中获益。PD-L1≥25%的患者的ORR、PFS和OS均与一线双药化疗相当。同时,卡瑞利珠单抗耐受性良好。
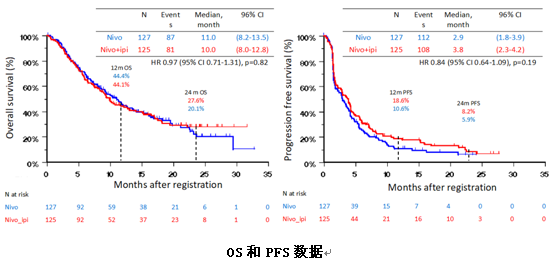
3) S1400I研究:Nivolumab联合Ipilimumab对比Nivolumab单药治疗未能改善晚期二线肺鳞癌患者总生存
S1400I研究是第一个在晚期肺鳞癌二线治疗中对比免疫单药治疗(Nivolumab)和免疫联合治疗(Nivolumab+Ipilimumab)的随机III期临床试验。研究共纳入252例患者,其中联合组125例,单药组127例,nivo剂量为3mg/kg,q2w,ipi剂量为1mg/kg,q6w。无论患者PD-L1表达水平如何均可入组。研究的主要终点为OS,次要研究终点是研究者评估的PFS及ORR。
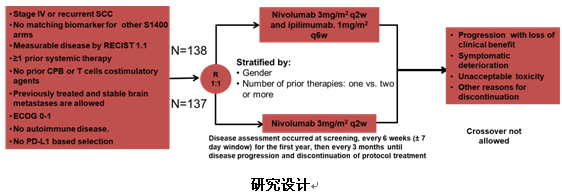
很遗憾这项研究在中期分析时因无效而终止。联合组和单药组的mOS为10.0 个月vs11.0个月(HR=0.97,P=0.82),mPFS为3.8 个月vs2.9 个月(HR=0.84, P=0.19),两组并无统计学上的差异。两组的ORR分别为18%vs17%。不同TMB表达水平及PD-L1表达水平的患者,其疗效不存在显著差异。仅仅在TMB≥10,PD-L1表达为0的患者中,联合治疗可以改善患者的生存(HR 0.39,P=0.004)。两组之间3级及以上不良反应发生率分别为39%和31%,分别有25%和16%的患者因药物相关的不良反应导致停药。
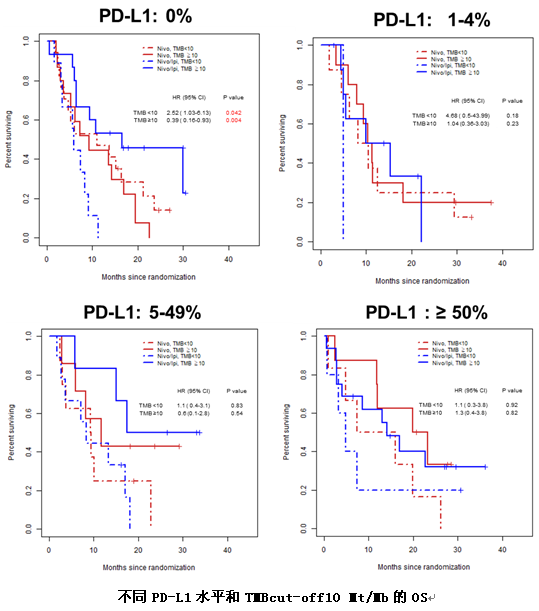
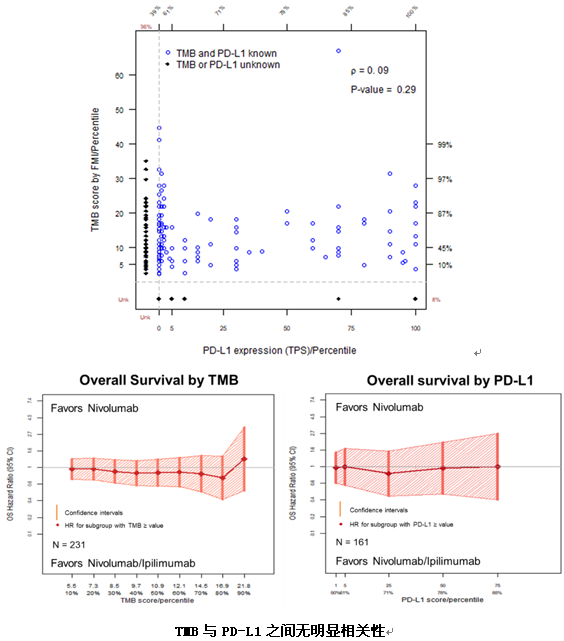
同时研究发现,作为单一的生物标志物,无论是PD-L1或是TMB均不能很好的区分nivo联合ipi和nivo单药治疗的疗效。
4) 免疫联合化疗二线治疗NSCLC显著提高ORR和PFS
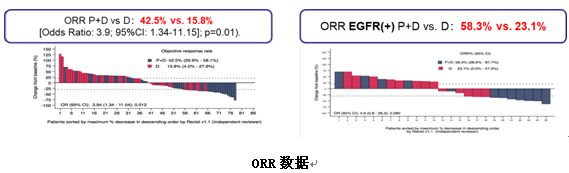
本次会议上报道了一项Pembrolizumab联合多西他赛对比多西他赛二线治疗晚期NSCLC的前瞻性II期研究结果。研究纳入了78例既往治疗进展的晚期NSCLC,二线接受pembro+多西他赛vs多西他赛单药治疗。
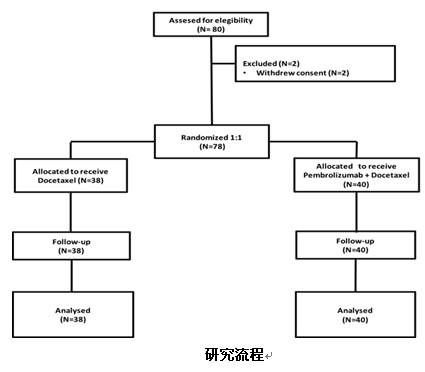
结果显示,联合组ORR提高了接近20%(42.5% vs 15.8%,P=0.01)。同时欣喜的发现,对于EGFR突变患者,联合组亦有疗效,ORR高达58.3%,而多西他赛组只有23.1%。
另外,联合治疗组较多西他赛组mPFS也显著延长(9.5个月vs 3.9个月,P<0.001)。PFS获益同样见于EGFR突变的患者(6.8 vs 3.5个月,P=0.037)。
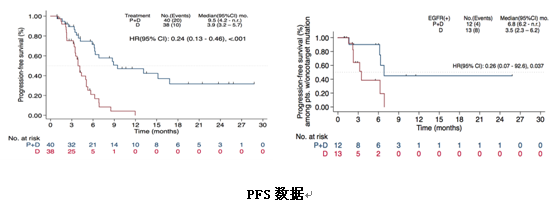
Keynote010研究中pembro单药二线治疗PD-L1≥1%的晚期NSCLC的ORR为18%,PFS为4个月,而该研究将pembro联合多西他赛后,ORR和PFS均提高了超过一倍,并且不需检测PD-L1表达水平,同时对于EGFR阳性患者也有效。
另一项回顾性研究分析了148例二线及以上NSCLC患者接受免疫治疗的疗效,其中32例患者接受免疫联合化疗治疗,116例患者接受免疫单药治疗。结果显示,在二线及以上晚期患者中,免疫联合化疗较免疫单药治疗可显著延长患者的PFS(6.1个月vs 2.5个月,P=0.008),同时亦可提高ORR(28.1%vs 13.8%,P=0.055)。
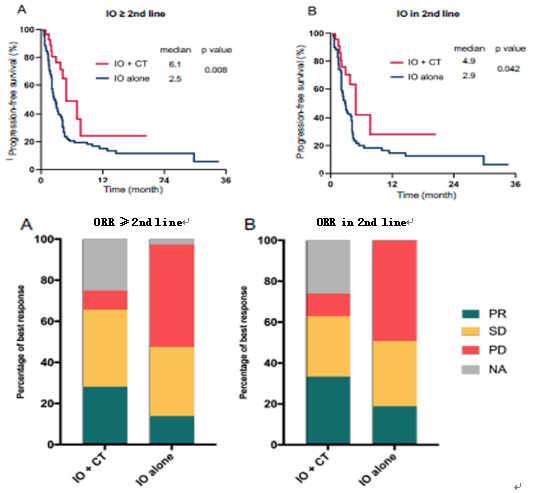
两项研究均提示了在晚期NSCLC二线治疗中,免疫联合化疗较免疫单药显示出更好的疗效,值得未来做进一步大样本研究的探索。
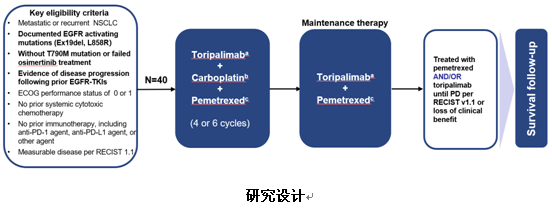
5) 特瑞普利单抗联合化疗用于先前接受EGFR-TKI治疗失败的EGFR突变阳性晚期NSCLC患者的Ⅱ期研究
这是一项由上海市肺科医院周彩存教授牵头的国内多中心Ⅱ期临床研究,研究共纳入了40例先前接受EGFR-TKI治疗失败,同时未伴有T790M突变或接受奥希替尼治疗失败的EGFR激活突变患者,接受240mg或360mg固定剂量的特瑞普利单抗(Q3W)联合培美曲塞和卡铂4~6个周期,后续接受特瑞普利单抗联合培美曲塞维持治疗,直至疾病进展(PD)或不能耐受毒性。研究主要终点为研究者评估的客观缓解率(ORR),次要终点包括安全性、ORR、DOR、DCR、PFS、OS等。
全组40例患者纳入评估,确认的ORR为50%(95%CI:33.8%~66.2%),20例达到PR,15例SD,DCR达87.5%(95%CI:73.2%~95.8%);DoR为7.0个月,整体人群的mPFS为7.0个月(95%CI:4.8个月~10.3个月)。
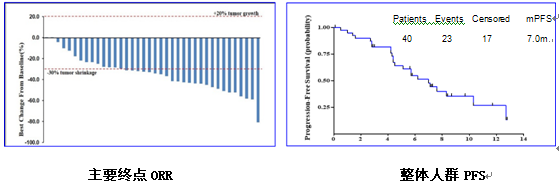
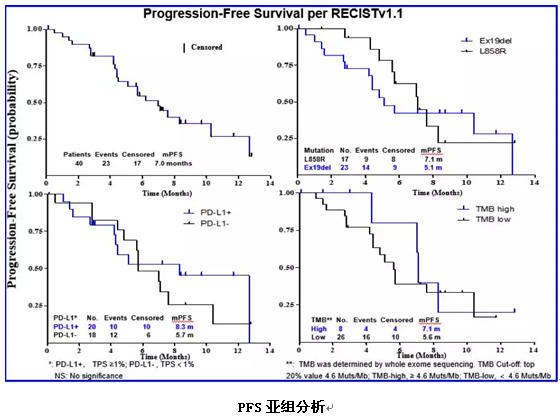
亚组分析显示,PD-L1阳性患者ORR为60%,mPFS达8.3个月;PD-L1阴性患者ORR为38.9%,mPFS为5.7个月。根据基因突变类型:EGFR L858R突变患者ORR为58.9%,mPFS为7.1个月;19Del患者ORR为43.5%,mPFS为5.1个月。以患者TMB状态前20% 4.6Muts/Mb为界,TMB≥4.6Muts/Mb,ORR为50.0%,mPFS为7.1个月;TMB<4.6Muts/Mb,ORR为50.0%,mPFS为5.6个月。在PD-L1阳性、EGFR L858R突变或TMB高患者中可以观察到更好的ORR和/或PFS,但并无统计学差异。
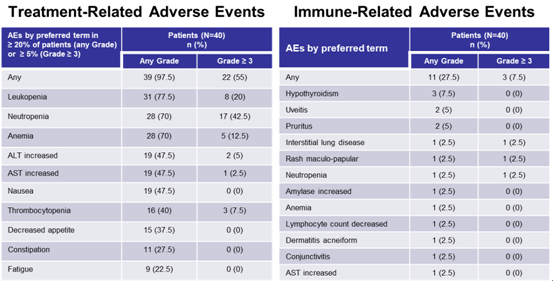
安全性方面,≥3级TRAEs为55%,常见不良反应包括白细胞减少、中性粒细胞减少、贫血等。≥3级irTRAEs为7.5%,联合治疗方案安全可耐受。
2、晚期一线
1) Keynote-024研究3年生存数据更新:Pembrolizumab单药对比含铂化疗对PD-L1≥50%的NSCLC患者提高3年生存近2倍
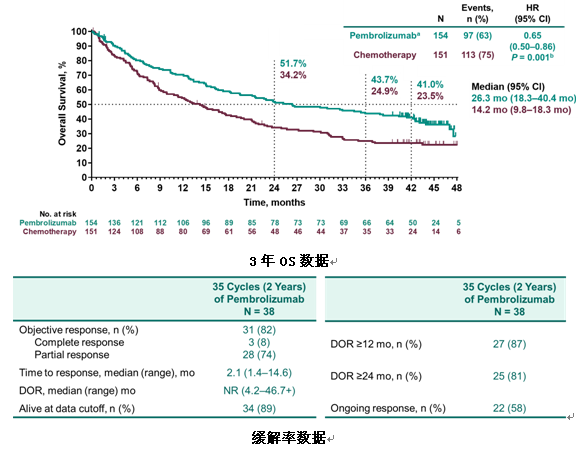
KEYNOTE-024研究是在PD-L1 TPS≥50%、EGFR/ALK野生型晚期NSCLC患者中,一线接受Pembrolizumab单药治疗对比含铂双药化疗的有效性和安全性的III期随机对照研究。之前的研究结果显示,pembro显著延长患者的OS和PFS,同时提高ORR。KEYNOTE-024研究为Chemo-Free提供了依据,由此pembro被批准用于PD-L1表达≥50%的转移性NSCLC患者的一线治疗。
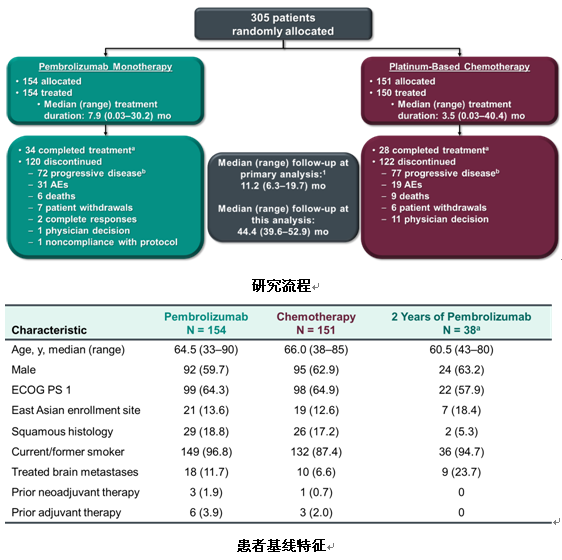
本次WCLC上更新了3年生存随访数据,结果显示,免疫治疗组和标准化疗组的mOS为26.3个月 vs 14.2个月,3年OS率为43.7% vs24.9%。同时,免疫治疗的整体安全性与化疗相比更好。
2) Keynote-042中国研究:Pembrolizumab单药一线治疗在PD-L1≥1%的中国NSCLC患者中获益更明显
在KEYNOTE-024研究的基础上,KEYNOTE-042试图让更多的患者从pembro单药治疗中获益,进一步扩大Chemo-Free的受益人群。KEYNOTE-042研究评估了pembro对比铂类为基础化疗一线治疗PD-L1 TPS≥1%的晚期NSCLC患者的疗效和安全性。对于PD-L1≥50%、≥20%和≥1%患者,相比单纯化疗,pembro单药治疗都能显著改善OS。由此pembro适用范围得以扩大,被批准用于EGFR/ALK野生型、PD-L1表达≥1%的晚期NSCLC患者的一线治疗。
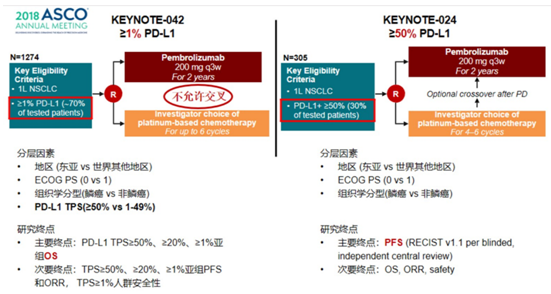
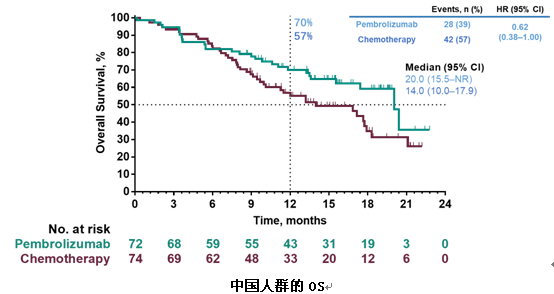
本次WCLC大会上,广东省人民医院吴一龙教授汇报了KEYNOTE-042中国研究的结果。研究结果与全球研究的主要终点一致,pembro单药治疗在中国患者中安全性良好,相比含铂双药化疗,能显著改善PD-L1≥1%的患者的OS(20个月vs 14.0个月)。同时与全球研究相比,在PD-L1≥1%、≥20%和≥50%不同亚组的人群中,中国患者的生存获益更为明显,降低死亡风险更多。
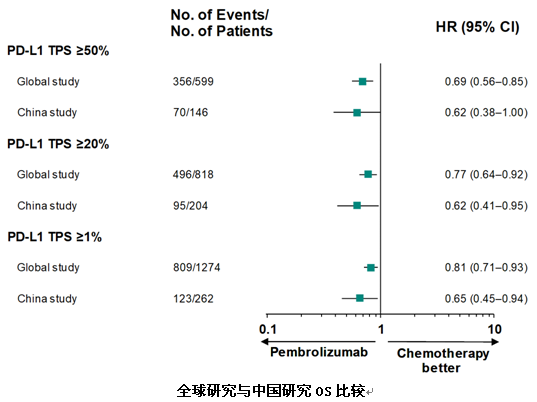
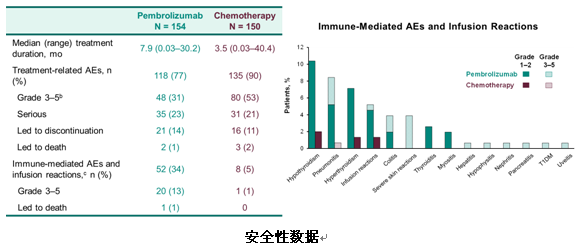
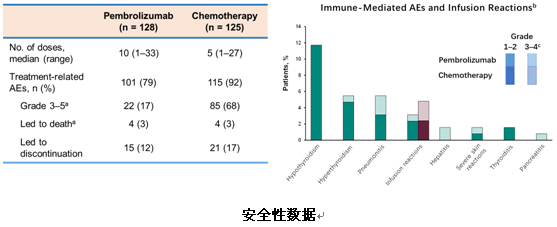
在安全性方面,pembro单药治疗较传统化疗的整体治疗相关不良事件及3-5级不良事件发生率均更低,显示出免疫治疗更好的安全性和耐受性。
3) CAMEL研究:卡瑞利珠单抗联合培美曲塞和卡铂开启中国晚期非鳞NSCLC患者一线治疗的新标准
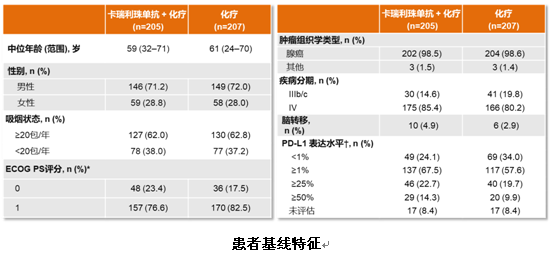
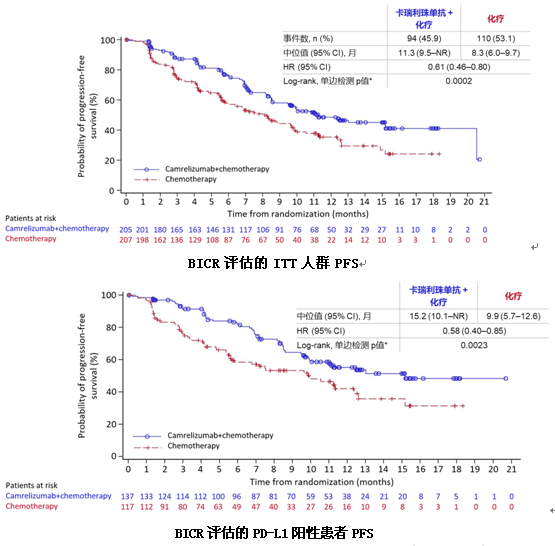
本次大会公布了首个针对中国非鳞NSCLC患者的一线免疫联合治疗的III期临床研究结果,也是国产PD-1抑制剂第一个III期临床研究亮相国际舞台。上海市肺科医院周彩存教授口头报告了该项研究数据。SHR-1210-III-303(CAMEL)研究是一项开放标签、随机、多中心III期研究,纳入EGFR或ALK突变阴性的晚期非鳞NSCLC患者,以性别和吸烟史(≥20包/年与<20包/年)作为分层因素,按1:1随机分配为两组,接受4~6个周期卡铂(AUC=5)+培美曲塞(500 mg/m2),联合或不联合卡瑞利珠单抗(200 mg)治疗,之后维持治疗采用培美曲塞联合或不联合卡瑞利珠单抗,每3周为一个治疗周期,直至疾病进展或出现不可耐受的毒性。对于确认疾病进展的化疗组患者,允许交叉使用卡瑞利珠单抗单药治疗。研究主要研究终点是盲法独立中心审查(BICR)委员会依据RECIST v1.1评估的无进展生存期(PFS),次要研究终点包括客观缓解率(ORR)、疾病控制率(DCR)、缓解持续时间(DoR)和总生存期(OS)等。
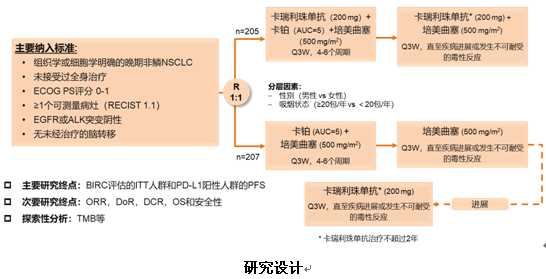
研究共纳入419例患者,其中205例分配至试验组,207例分配至对照组,患者中位随访11.9个月。
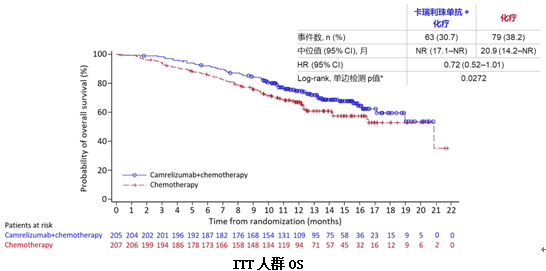
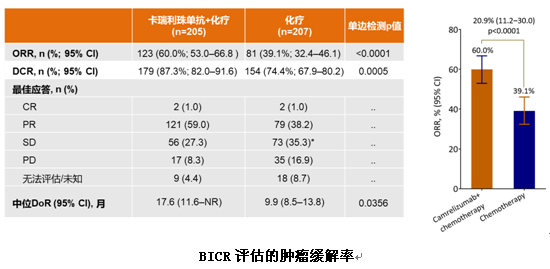
结果显示,在ITT人群中,与单纯化疗相比,卡瑞利珠单抗联合化疗能显著延长患者中位PFS(11.3个月vs8.3个月,HR=0.61,P=0.0002),PD-L1表达阳性患者PFS更长达到15.2个月。同时,联合组的ORR(60.0% vs39.1%)、DCR(87.3% vs74.4%)、中位DoR(17.6个月vs9.9个月)和中位OS(NR vs20.9个月)均显著优于单纯化疗组。
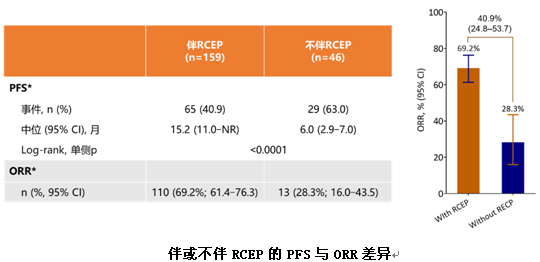
对于卡瑞利珠单抗独特的反应性皮肤毛细血管增生症(RCCEP)这一不良反应,研究中也做了相应统计,发现出现与没有出现该反应的患者PFS(15.2个月vs 6.0个月)和ORR(69.2%vs 28.3%)均有显著差异,提示反应性皮肤毛细血管增生症可能为预测卡瑞利珠单抗疗效相关的一个biomaker。
在安全性方面,3/4级治疗相关不良事件(TRAEs)的发生率,联合治疗组为66.3%,单纯化疗组为45.9%。在免疫相关不良事件(irTRAEs)中,联合治疗组3级以上的不良反应最高的发生率仅为3.4%,显示出良好的安全性。此外,联合组与单纯化疗组分别发生5例(2.4%)和4例(1.9%)TRAE导致的死亡。
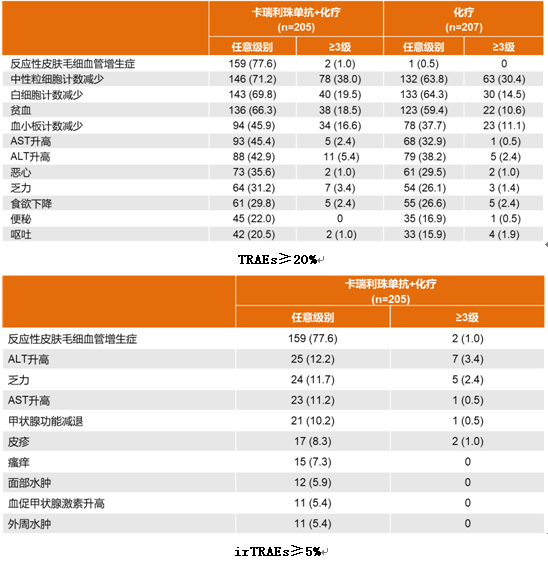
对于EGFR或ALK驱动基因突变阴性的晚期非鳞NSCLC患者,一线卡瑞利珠单抗联合培美曲塞和卡铂,在PFS、ORR、DoR和OS方面均展现出显著的临床获益,且不良反应可耐受。卡瑞利珠单抗联合化疗有望成为中国人群新的标准一线治疗方案。
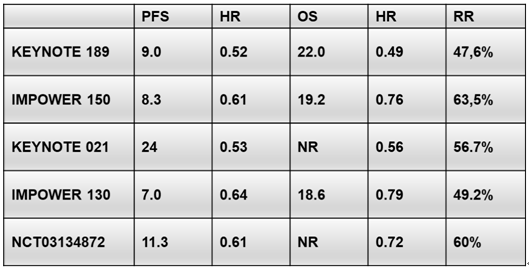
4) CheckMate 817:一线Nivolumab+Ipilimumab双免疫联合治疗在ECOG PS 2及其他特殊人群中安全有效
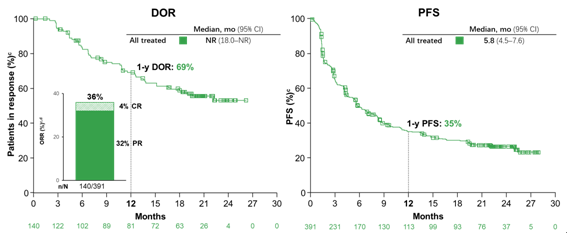
CheckMate 817研究主要探索Nivolumab+Ipilimumab双免疫组合方案在既往未接受过治疗的晚期NSCLC患者(队列A和队列A1)中的疗效和安全性。队列A纳入了391名ECOG PS 0~1的患者,队列A1则由198名ECOG PS2或ECOG PS 0~1但合并无症状的未治疗脑转移,或肝/肾功能损伤,或HIV感染的特殊患者(AOSP)组成;两组均排除EGFR/ALK阳性患者。每组均接受nivo固定剂量(240mg,q2w)联合低体重剂量ipi(1mg/kg,q6w),使用至2年或直至患者出现疾病进展或不可耐受的毒性。主要研究终点为队列A中3~5级TRAEs和irAEs;次要研究终点为PFS、ORR、DOR和队列A的OS。
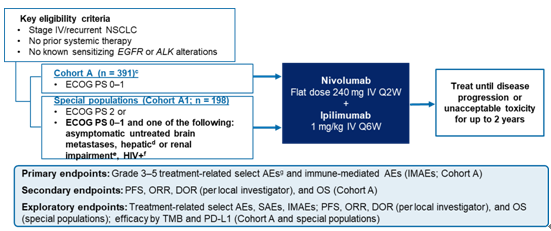
队列A的研究结果曾在2018年AACR上公布,固定剂量nivo联合低体重剂量ipi的给药模式,与既往根据体重剂量nivo(3mg/kg,q2w)给药的研究中观察到的疗效和安全性是一致的。此次WCLC大会主要公布A1队列ECOG PS 2或 AOSP的患者数据分析。结果显示,不良事件发生率为67%,3~4级不良事件发生率为28%,主要表现为皮肤毒性、内分泌毒性、消化道毒性、肝毒性、肺毒性、过敏/输液反应以及肾毒性。因3~4级TRAEs导致停止治疗的比例为12%,因TRAEs导致的死亡仅为3例(2%),分别为4级免疫治疗继发性肌无力综合征1例、4级间质弥漫性肺炎1例和3级多发性肌炎1例。与既往发表的队列A以及CheckMate 226安全性数据相比,双免疫联合方案在ECOG PS 2或合并特殊疾病的特殊人群中均观察到一致的安全性。
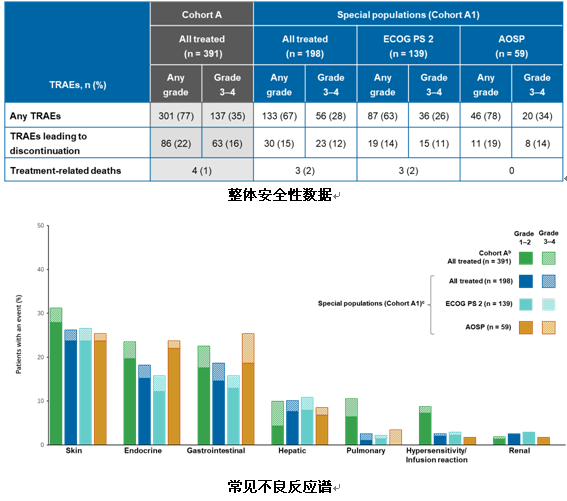
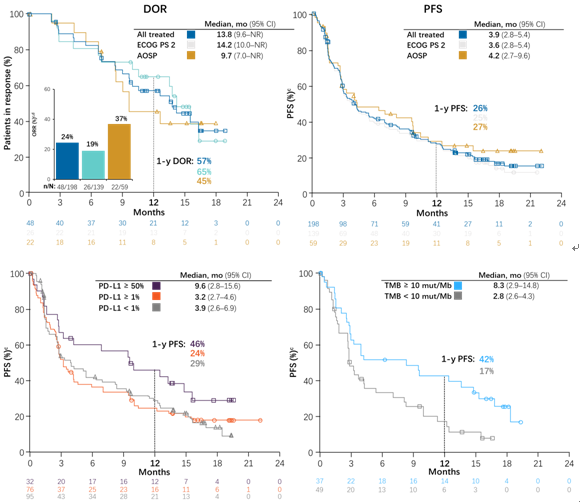
疗效方面,尽管总体疗效结果受到ECOG PS 2或者合并症的影响,但患者通过双免疫治疗仍获得了持久的应答,整体mDOR还未达到(18.0~NR),mPFS为5.8个月,1年PFS率为35%。此外研究中还发现高TMB(≥10 mut/Mb)和高PD-L1表达(≥50%)与两组PFS延长更加明显。
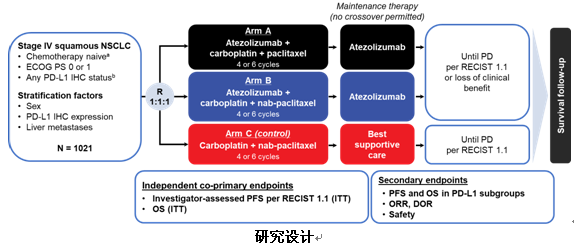
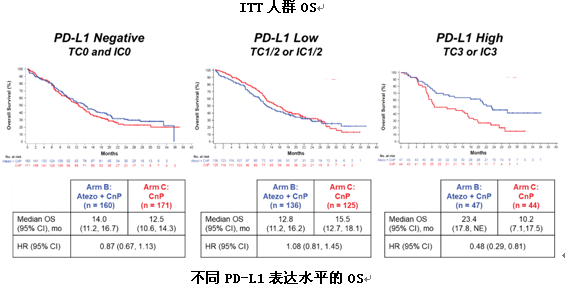
5) IMpower131:Atezolizumab联合卡铂+白蛋白紫杉醇一线治疗显著提高PD-L1高表达晚期肺鳞癌患者的OS,PD-L1阴性或低表达患者OS改善不明显
IMpower131研究对比了Atezolizumab联合卡铂和紫杉醇(队列A)、Atezolizumab联合卡铂和白蛋白紫杉醇(队列B)以及单纯卡铂和白蛋白紫杉醇(队列C)一线治疗晚期肺鳞癌的疗效和安全性,主要研究终点为PFS和OS。
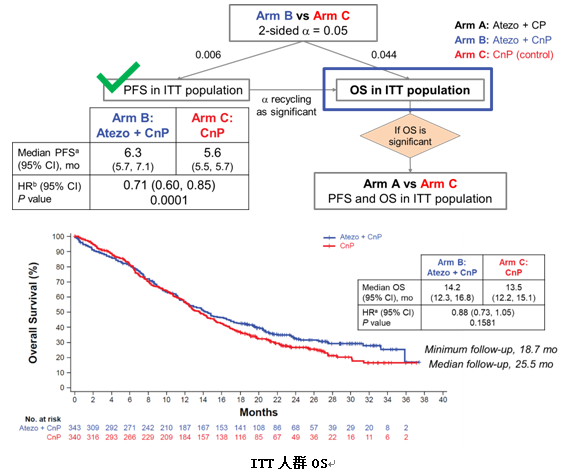
相比单纯化疗,atezo联合卡铂+白蛋白紫杉醇延长了患者的PFS(6.3个月vs5.6个月,HR=0.71)。本次大会公布了最终的OS数据,在ITT人群中,atezo联合卡铂+白蛋白紫杉醇和单纯化疗组的mOS为14.2个月vs13.5个月(HR=0.88,95%CI 0.73~1.05;P=0.1581),未能达到统计学差异。
基于PD-L1不同表达水平的亚组分析显示,在PD-L1表达阴性以及低表达患者中,B组和C组的OS差异不明显;而在PD-L1高表达亚组中,B组的中位OS高达23.4个月,显著长于单纯化疗组的10.2个月,降低死亡风险52%。
安全性方面,B组和C组治疗相关不良事件发生率相当,3-4级不良事件以及严重不良事件,B组较C组略有增加。
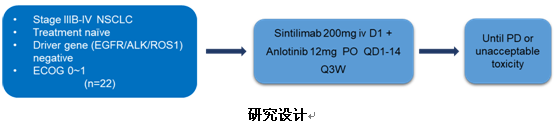
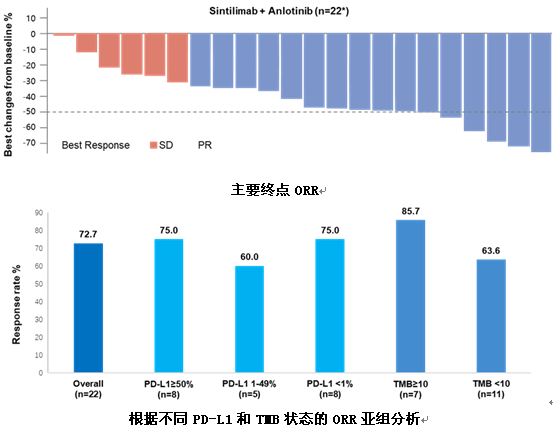
6) 信迪利单抗联合安罗替尼一线治疗晚期NSCLC患者的I期研究令人鼓舞
上海市胸科医院韩宝惠教授汇报了一项信迪利单抗联合安罗替尼一线治疗驱动基因阴性的晚期NSCLC患者的Ⅰ期临床研究结果。研究纳入驱动基因(EGFR/ALK/ROS1)阴性、未经治疗的ⅢB~Ⅳ期NSCLC患者,年龄18~75岁,ECOG 0~1分。给予信迪利单抗(200mg,q3w)和安罗替尼(12mg/d,吃2周停1周)治疗,直至疾病进展(PD)或不可耐受的毒性。研究主要终点为ORR和安全性,次要终点包括DCR、PFS和OS。
研究入组22例患者,男性占95.5%,63.6%的患者有吸烟史,鳞癌占54.5%,4例患者合并脑转移。其中21例患者进行了PD-L1表达检测,18例患者进行了TMB检测。结果显示,16例患者达到PR,6例患者SD,ORR达72.7%,DCR为100%。同时,根据患者的PD-L1表达水平和TMB状态进行亚组分析,在各亚组中均观察到疗效获益。
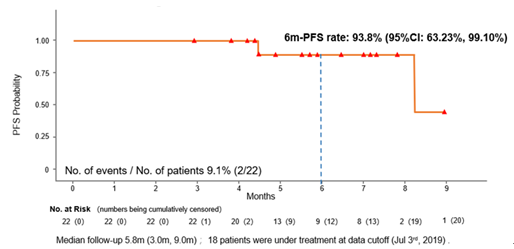
数据截止时,81.8%(18/22)的患者仍在接受治疗,仅2例患者发生PFS事件,PFS数据尚不成熟,预估6个月PFS率为93.8%(95%CI:63.23%~99.10%)。
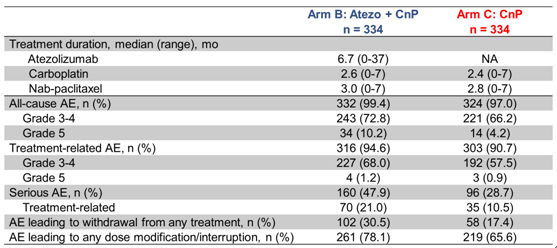
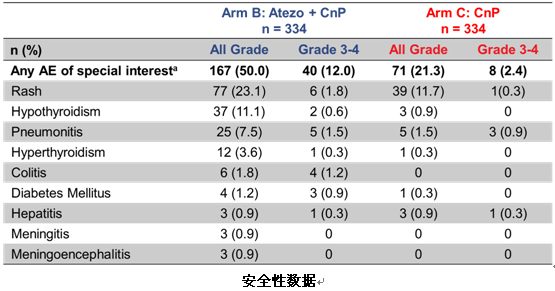
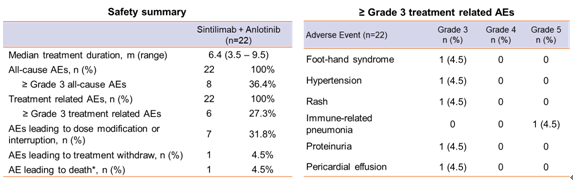
安全性方面,所有患者耐受性良好,未观察到意料之外的毒性。≥3级TRAEs为27.3%(6/22),且多数可逆可控。
信迪利单抗联合安罗替尼在未经治疗的晚期NSCLC中展现出令人鼓舞的抗肿瘤活性,且在各亚组中均显示出获益,值得扩大样本量进行更深入的研究。
3、新辅助治疗
1) 信迪利单抗新辅助治疗可切除NSCLC主要病理缓解率高达40.5%,值得进一步深入探索
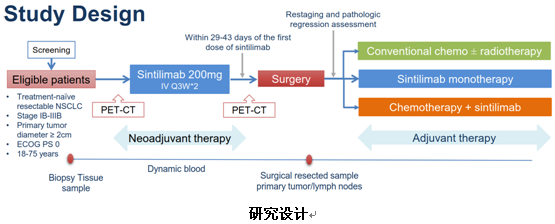
研究招募未经治疗的、可手术切除的ⅠA期~ⅢB期NSCLC患者,同时要求原发病灶≥2cm、ECOG PS评分为0、年龄在18~75岁之间。入组的患者经过PET-CT检查,排除远处转移之后,接受2周期的信迪利单抗新辅助治疗(200mg,q3w)。在距离开始接受信迪利单抗治疗的第29至43天之内,进行第二次PET-CT检查,评估治疗疗效并证实无远处转移者,接受手术切除。根据术后病理诊断进行重新分期后,患者将接受以下三种辅助治疗:传统化疗联合或不联合放疗、信迪利单抗单药治疗、传统化疗联合信迪利单抗治疗。研究主要终点是信迪利单抗首剂治疗后90天或者手术切除后30天内出现的不良反应、手术并发症及新辅助治疗是否导致手术延期等。次要研究终点包括ORR、MPR以及DFS。
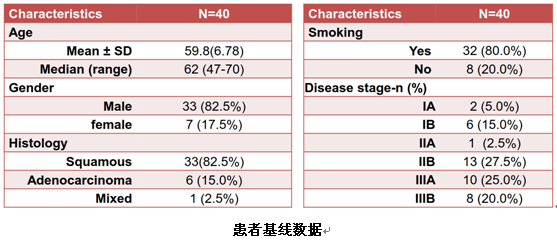
共有40例患者接受药物安全性评估,且均完成了2个周期的新辅助治疗。有3例患者接受了探查术,其中1例患者在术中冰冻病理证实胸壁结节转移,另2例患者在辅助治疗后评估为SD。另外37例患者接受了手术切除,其中1例肺鳞癌患者为R2切除,36例患者均为根治性切除(R0)。40例患者中位年龄为62岁(47~70岁),其中男性33例;肺鳞癌患者最多,为33例(82.5%);32例为吸烟患者。ⅠA期2例(5%)、ⅠB期6例(15.0%)、ⅡA期1例(2.5%)、ⅡB期13 (32.5%)、ⅢA期10例 (25.0%)、ⅢB期8例 (20.0%)。
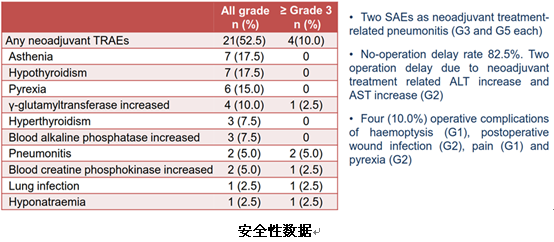
安全性方面,整体治疗相关不良反应发生率为52.5%(21例),其中≥3级为10%(4例)。最常见的不良反应包括乏力(17.5%)、甲状腺功能减退(17.5%)、发热(15%)、谷氨酰转移酶升高(10%)等。≥3级的严重不良反应中发生率最高的为肺炎(5%;2例,分别是3级和5级)。无手术延期率可达82.5%;另外两例患者由于2级治疗相关的不良反应而导致手术延期。此外,有4例患者出现了手术并发症,分别为咯血(1级)、术后切口感染(2级)、疼痛(1级)、发热(2级)。
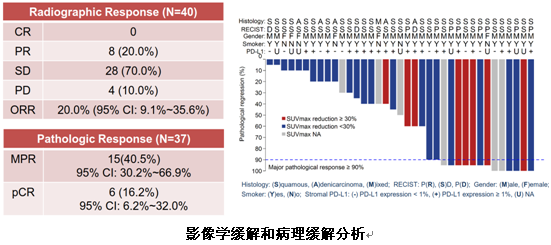
影像学评估中,8例PR,28例SD,4例PD,ORR为20%。37例可做病理缓解分析的患者中,15例(40.5%)达到MPR(病灶缩小90%以上),6例(16.2%)达到pCR。
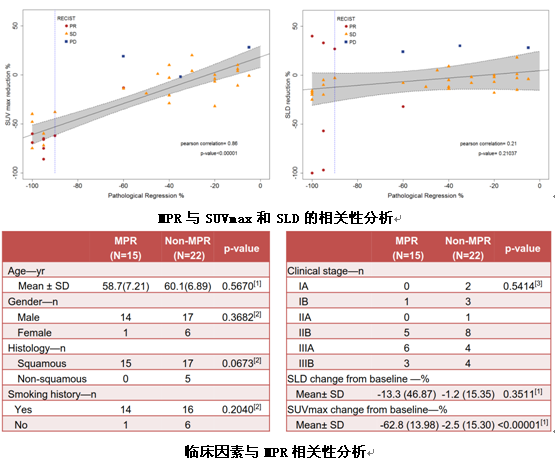
PET-CT检查中,MPR与SUVmax值的降低显著相关(P<0.00001),但与肿瘤直径之和(SLD)无相关性性(P=0.2104)。与临床因素的相关性分析显示,仅有SUVmax值相比于基线水平的缓解百分比与之显著相关,达到MPR的SUVmax降低率为62.8%,未达到MPR的SUVmax降低率为2.5%(P<0.00001)。
这项信迪利单抗新辅助治疗初治NSCLC患者的研究具有良好的安全性和耐受性,其MPR高达40.5%,pCR达到16.2%,具有良好的应用前景。研究初步发现,SUVmax值的降低程度可以作为预测病理缓解率的指标,但新辅助治疗后病灶直径缩小程度之和并不能作为预测标志,还需更进一步大样本的深入研究。
2) NADIM研究更新:Nivolumab联合紫杉醇+卡铂新辅助治疗可切除IIIa期NSCLC缓解率达到新高度,12个月PFS率>80%
这是首个在IIIa期NSCLC患者中探索免疫联合化疗疗效的多中心临床研究,继2018WCLC、2019ASCO之后,本次WCLC更新了最新的数据。研究共纳入46例患者,术前给予nivo+紫杉醇+卡铂治疗三个周期,在第三周期的第21天之后的第3或第4周进行手术,接着给予nivo辅助治疗一年。研究的主要终点是2年PFS率,次要终点包括降期率、缓解率、TTP、3年OS率、安全性及免疫相关biomaker探索。
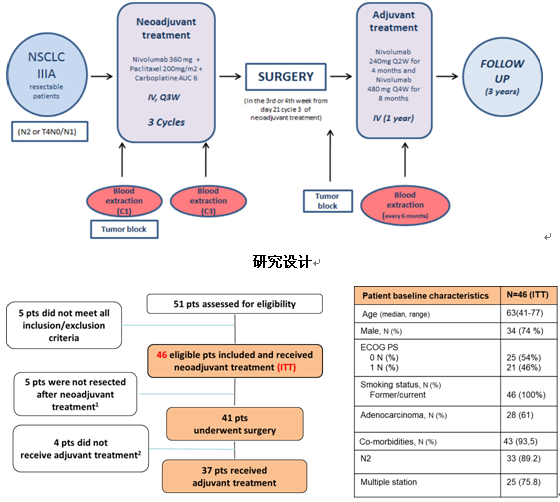
患者基线情况
最新的研究结果显示,免疫联合化疗的新辅助方案,可以产生惊人的临床缓解率和病理缓解率,ORR高达73.9%,MPR高达83%,pCR达到59%。并且该方案的使用并未增加手术并发症及术后死亡率。
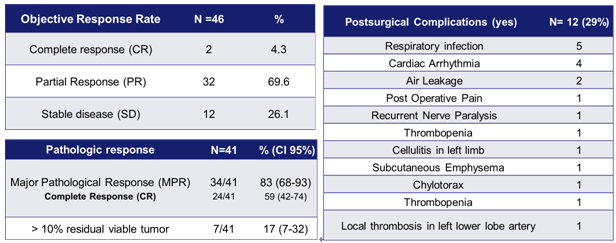
临床缓解和病理缓解情况术后并发症情况
生存数据显示,ITT人群中,12个月PFS率为96%,18个月PFS率依然有81%,且高的PFS率可以转换为高的总体存活率,18个月OS率达到91%。
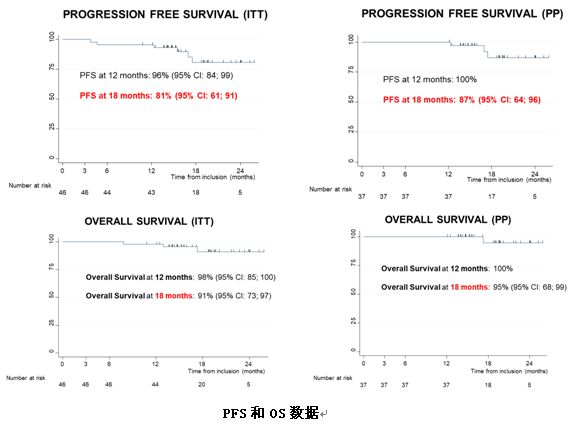
3)NEOSTAR研究手术结果更新:Nivolumab或Nivolumab+Ipilimumab新辅助治疗可切除NSCLC的切除率与化疗作用相当
这是一项对比nivo单药与nivo联合ipi双免疫新辅助治疗在可切除NSCLC患者中的疗效的随机对照II期研究,患者术前接受3个周期的nivo或nivo+ipi治疗,治疗后第3-6周内进行手术治疗。研究主要终点为主要病理缓解率(MPR),次要研究终点包括pCR、R0切除率、ORR、RFS、OS、切除肿瘤组织中CD8+TILs及免疫相关biomaker探索。
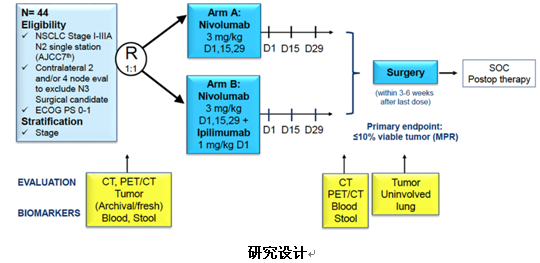
研究共筛查了53例患者,44例患者符合纳入治疗标准,其中23例接受nivo单药治疗,21例接受nivo+ipi双免疫治疗。今年ASCO大会上报道了研究的主要终点MPR结果,显示总体MPR为25% (单药组vs联合组为17% vs33%),其中18%(8例)患者达到pCR(单药组vs联合组为9% vs29%)。
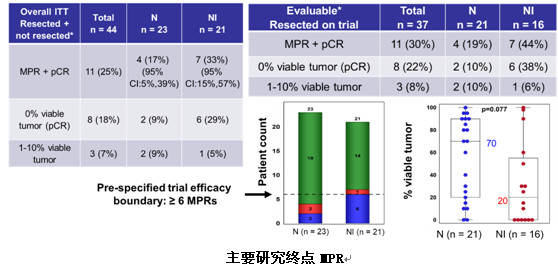
本次WCLC大会公布了手术结果的情况。39例(89%)患者接受了R0切除,其中2例患者在附加诱导化疗后进行手术并退出试验。其余37例患者中,nivo单药组21例,nivo+ipi组16例。中位年龄66岁(43-83岁),男性24人(65%),腺癌22人(59%),I期22人(59%),II期9人(24%),IIIA期6人(16%)。未行切除的患者有5例(11%),其中nivo组1例,因缺氧/大量胸腔积液而未行切除;nivo+ipi组4例,主要是结节进展、局部肿瘤进展(不可切除)、吸烟和高手术风险、拒绝手术。
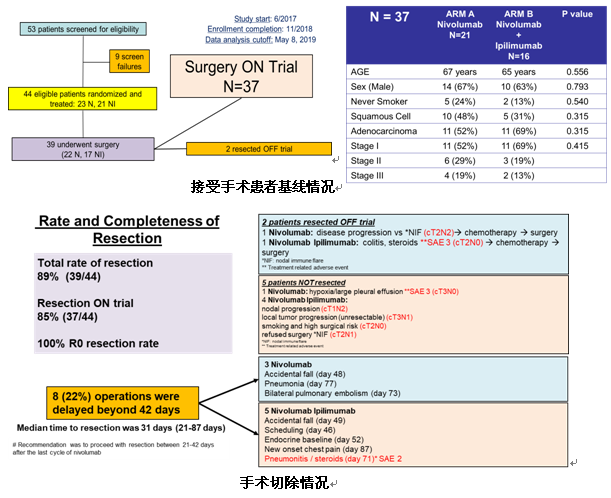
中位手术时间147分钟,中位出血量100cc,中位术后住院时间4天。围手术期发生延迟漏气8例(22%),肺炎2例(5%),脓胸1例(3%),1例(3%)死于支气管胸膜瘘(BPF)和类固醇治疗肺炎的并发症;4例(11%)发生房颤,1例(3%)腹泻,1例(3%)肠梗阻,1例(3%)短暂性缺血发作。

手术情况及术后并发症
在对手术切除的复杂性判断方面,外科医生主观判断40%(15/37)的手术比常规手术更复杂,19%(7/37)的手术时长>4小时。
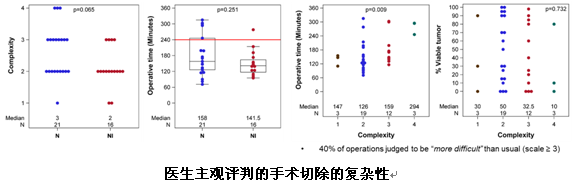
NEOSTAR研究显示免疫单药与双免疫新辅助治疗之间没有太大区别,手术的复杂性与治疗的反应关系不大,患者肺功能未受免疫新辅助的影响,整体切除率与新辅助化疗作用相当。同时,5例未能进行手术切除的患者和1例围手术期死亡患者提示我们,对于可手术NSCLC患者进行免疫单药或联合新辅助治疗时还需谨慎选择。
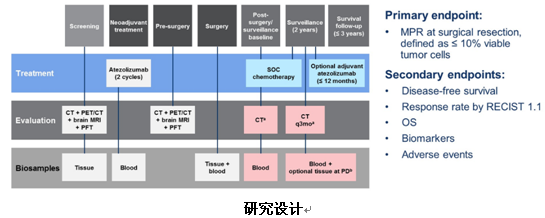
4)LCMC3:Atezolizumab新辅助治疗可切除NSCLC患者安全性良好
LCMC3研究是一项旨在评估Atezolizumab用于IB、II、IIIA及部分选择性可切除的ⅢB期NSCLC患者的新辅助治疗的疗效与安全性。计划纳入180例患者,研究第一部分为患者接受2个周期atezo 1200 mg(第1、22天)治疗后,再手术切除(第40±10天)。手术有效的患者将继续第二部分的探索性研究,接受atezo 12个月的辅助治疗。研究主要终点为主要病理缓解率(MPR,存活肿瘤≤10%),次要终点包括DFS、ORR、OS、安全性和PD-L1表达、TMB和基因表达谱与疗效的相关性等。
此次中期分析纳入了101例患者,并入组了7例EGFR阳性和1例ALK阳性患者,其中90例患者完成了手术,77例患者完成了病理学评价。意向手术人群(N=90)的ORR为6.67%,主要疗效人群(N=77)的MPR为19%(95%Cl:11%-30%),pCR为5%,其中49%患者达到≥50%病理学缓解,3/8例EGFR/ALK+患者达到40%-50%病理学缓解。
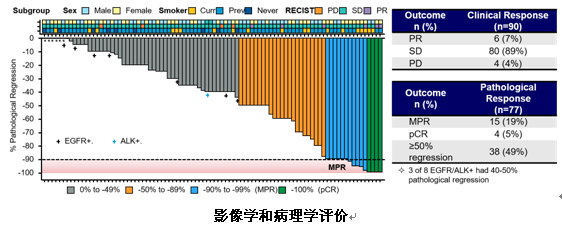
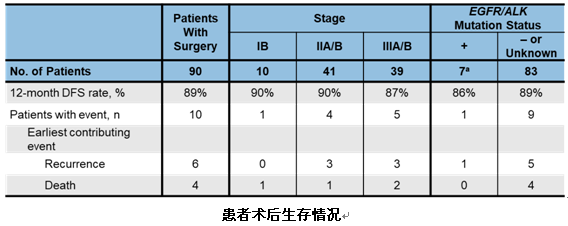
生存数据方面,意向手术人群的12个月PFS率为89%,其中EGFR/ALK+患者达到86%。有6例患者术后出现复发,4例患者死亡。
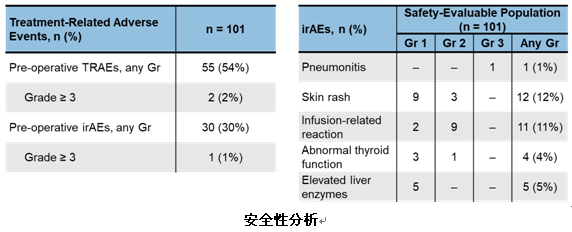
安全性方面,atezo作为新辅助治疗的安全性和耐受性较好,术前≥3级的与免疫相关的不良反应发生率为1%,常见免疫不良反应为皮疹、输液反应、肝酶升高、甲状腺功能异常,只有1例患者出现3级肺炎。


查看更多