查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






范照青主任
北京大学肿瘤医院乳腺癌预防治疗中心副主任
中国抗癌协会乳腺癌专业委员会委员
中国医师协会乳腺外科医师委员会常务委员
中国医药教育协会乳腺疾病专业委员会常务委员
中国医药教育协会乳腺疾病专业委员会乳腺癌多学科诊疗学组主任委员
中国医疗保健国际交流促进会乳腺疾病分会常务委员、副秘书长
北京医学会乳腺疾病分会青年委员会副主任委员
乳腺癌是全球女性中发病率最高的恶性肿瘤,随着诊疗技术的不断进步,乳腺癌已经逐渐向精准治疗的方向发展。基于雌 激 素 受 体(estrogen receptor,ER)、孕激素受体(progester onereceptor,PR)、人 表 皮 生 长 因 子 受 体 2(human epidermal receptor 2,HER2)及 Ki⁃67 这 4 个指标的不同组合状态所确定的分子亚型体系,为乳腺癌诊疗决策提供了重要依据。然而,在相同分子亚型的乳腺癌患者中,其对治疗的反应及预后仍存在着很大程度的异质性。为了更为精准的判断患者的预后及制定治疗方案,多基因检测技术在乳腺癌领域得到了长足的发展。
多基因检测(multi⁃gene assay,MGA)技术是在分子分型的基础上,通过检测乳腺癌肿瘤组织标本中与肿瘤细胞生长调控相关的若干个代表性基因的表达水平,进行量化、建立相应的数学模型,从而区分同一分子亚型乳腺癌的不同预后并进行疗效预测,指导辅助治疗决策。目前在早期乳腺癌中,主要检测的多基因表达谱有Oncotype DX(21基因)、MammaPrint(70基因)、EndoPredict(12基因)、BCI以及Prosigna(PAM50)。随着越来越多的循证医学证据的支持,这5种多基因检测模型已被NCCN指南列为辅助治疗临床决策的重要依据。在2019年中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)乳腺癌诊疗指南中,也推荐21基因和70基因检测用于早期乳腺癌辅助治疗前的评估。
化疗是乳腺癌治疗中非常重要的治疗手段之一,但并不是每个乳腺癌患者都可以从化疗中获益,特别是对于激素受体阳性、HER2阴性的Lumimal型乳腺癌患者,其总体复发风险不高,是否需要化疗,一直是困扰临床的问题。目前的循证医学证据显示,21基因检测和70基因检测都具有预测早期乳腺癌患者化疗获益的作用。
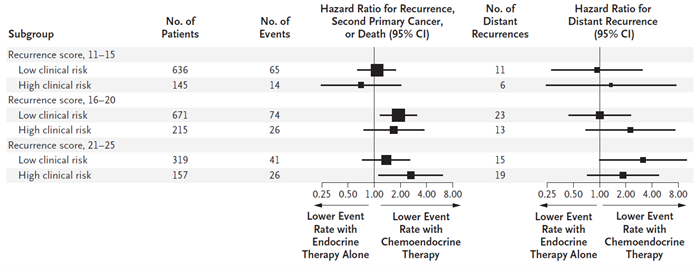
21基因检测对预后及化疗的预测价值已经多次在既往研究中证实。来自TAILORx研究早期的研究结果提示,复发风险评分(recurrence score,RS)>25分的患者辅助化疗获益较大,RS为11-25分的患者单用内分泌治疗预后不劣于化疗联合内分泌治疗;细分患者群发现,年龄≤50岁且RS 16-25分的患者,接受化疗后也有一定的获益。2019年ASCO上报道了TAILORx研究的二次分析,在RS的基础上结合临床病理特征 (通过肿瘤大小和组织学分级进行评估,满足以下之一为临床风险低危的患者:肿瘤大小≤1cm且组织学3级,肿瘤大小≤2cm且组织学2级,肿瘤大小≤3cm且组织学1级,其余则为临床风险高危),进一步区分出了年龄≤50岁且RS 16-25分,可以从化疗中获益的患者:RS为21~25分(不论临床风险如何)以及RS为16~20分且临床风险高的患者中,加用化疗都可以减少9年时的远处复发风险(476例复发评分为21-25分的患者中,临床风险低危的患者和临床风险高危的患者化疗绝对获益分别为6.4±4.9%和8.7±6.2%;886例复发评分为16-20分的患者中,临床风险高危的患者化疗绝对获益为6.5±4.9%,而临床风险低危的患者化疗绝对获益仅为- 0.2±2.1%)(图1)。基于TAILORx研究结果, 2019年V1版NCCN指南将21基因检测作为1类证据推荐,认可了其预测辅助化疗获益的价值。
图 1
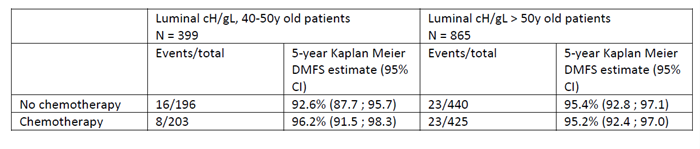
70基因是可以用于预测化疗获益的另一种MGA模型。MINDACT研究是一项前瞻性、随机、多中心临床研究,旨在评估70基因检测能否使一部分高临床风险的乳腺癌患者避免接受化疗,并首次将传统临床预后指标(修订后的Adjuvant! Online)与70基因预测模型结合,观察两者风险评估不一致时化疗的疗效。对意向性治疗人群的分析显示,高临床风险、低基因风险亚组中,化疗组患者5年无远处转移生存率(DMFS)为95.9%,仅比未化疗组患者的94.4%高出1.5%(HR=0.78,P=0.27)(图2),提示低基因风险患者从化疗中获益很小。而低临床风险、高基因风险亚组中,化疗组患者5年DMFS为95.8%,略高于未化疗组的95.0%(HR=1.17,P=0.66),提示所有低临床风险(无论基因风险高低)的乳腺癌都不再需要化疗。但值得注意的是,MINDACT的亚组分析也显示,对于低临床风险而高基因风险的T1a-bN0小肿瘤患者,接受辅助化疗可以进一步改善患者的预后,提示临床风险评估在肿瘤负荷低的患者存在一定的局限性,联合基因检测可以进一步细化出复发风险高的人群。基于MINDACT研究结果,2017年ASCO指南强烈推荐将70基因检测作用于指导HR+、HER2-,淋巴结0-3个阳性的早期浸润性乳腺癌辅助治疗决策。2019年SABCS上报道的MINDACT研究探索性分析发现,在激素受体阳性、HER2阴性、高临床风险、低基因风险的乳腺癌患者中,相较于>50岁女性,40~50岁女性从化疗中获益更多,接受化疗和未接受化疗患者的预估5年DMFS分别为96.2%和92.6%(图3),这与TAILORx研究二次分析的结果类似。但值得注意的是,在这两项研究中,绝大多数女性辅助内分泌治疗方案是他莫昔芬单药,因此无法确定较为年轻患者的获益是化疗的直接作用还是化疗引起卵巢功能抑制所致,仍有待进一步研究。
图 2
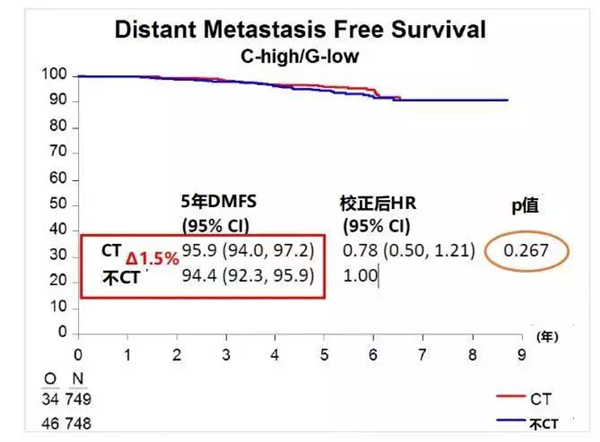
图 3
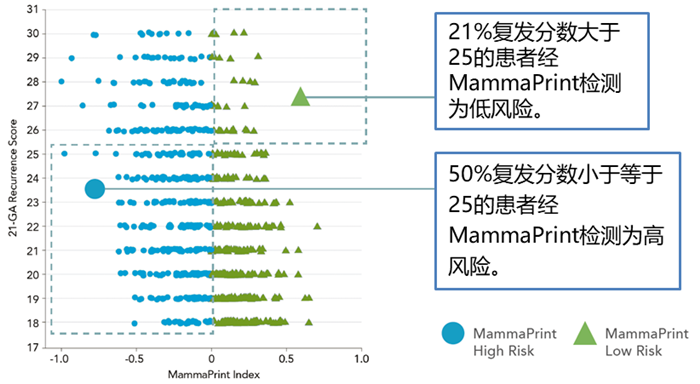
21基因和70基因作为两种不同的基因检测模型,对化疗获益都有一定的预测能力。然而,OPTIMA Prelim和PROMIS研究显示,在同一人群中,应用不同的MGA模型,所得到的预后及预测结果存在着很大程度的差异(图4)。截至目前,并无证据证明21基因和70基因在化疗获益的预测方面,哪一个效力更优。从TAILORx和MINDACT研究可以看出,两种检测工具都存在一定的局限性,与临床病例特征相结合,可以进一步提高基因检测对预后和化疗获益预测的能力。不同的是,TAILORx研究是在21基因检测基础上结合临床病理特征进行分析;而MINDACT研究是先根据临床风险进行分层,再进行基因检测,其结果提示只有临床高风险人群需要进行70基因检测,使检测人群 “精准”化,对临床实践更具有指导价值。
图 4
此外,2019年的一项荟萃分析也在探讨MGA在化疗中的应用价值。研究者对早期可手术HR阳性乳腺癌的MGA进行了成本效益分析。研究共纳入了31项临床研究,12202例患者,其中大多数(86.1%)使用21基因检测来确定复发风险,其他的MGA模型包括70 基因、50 基因和12 基因。结果发现,与不做MGA检测相比,MGA检测增加了临床高危患者化疗使用率,降低了临床低危患者化疗使用率(图5)。 此外,与不做检测相比,应用MGA来指导临床决策,降低了远处转移发生风险,应用21基因检测还可以缩减医疗成本(图6)。
图 5
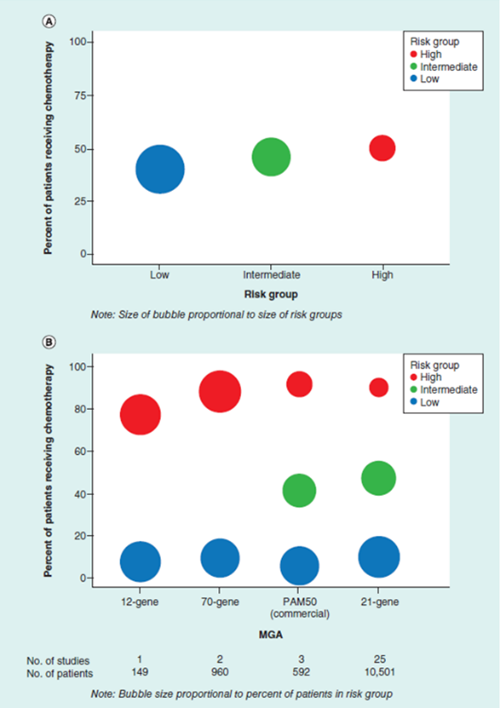
图 6

‡Dominant: cost-saving relative to no testing and reduces the number of distant recurrences.
ICER: Incremental cost–effectiveness ratio; MGA: Multi-gene assay; USD: United States dollar.
MGA是对乳腺癌分子亚型的补充,可以更为准确的评估患者的预后,为个体化选择治疗方案提供可靠的参考依据,将成为未来乳腺癌精准治疗的重要方向。但目前国内进行基因检测的实验室多是参照国外,相应的行业标准有待规范。此外,中西方乳腺癌患者基因表达上存在差异,在中国人群中开展基因检测组合的设计及验证,获得中国人群的循证医学证据,才能更好地推动国内乳腺癌“精准治疗”的发展。
参考文献:(滑动查看所有文献)
1. National Comprehensive Cancer Network. NCCN clinical practice guidelines in Breast Cancer(Version 3.2020). http://www.nccn.org/
2. 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)乳腺癌临床诊疗指南(2019)[M]. 北京:人民卫生出版社,2019.
3. Sparano JA, Gray RJ, Makower DF,et al.Adjuvant Chemotherapy Guided by a 21-Gene Expression Assay in Breast Cancer.N Engl J Med. 2018, 379(2):111-121.
4. Sparano JA, Gray RJ, Ravdin PM,et al. Clinical and Genomic Risk to Guide the Use of Adjuvant Therapy for Breast Cancer. N Engl J Med. 2019, 380(25):2395-2405.
5. Cardoso F, van’t Veer LJ, Bogaerts J, et al.70-Gene signature as an aid to treatment decisions in early-stage breast cancer.N Engl J Med 2016; 375: 717-729.
6. Piccart MJ, Poncet C, Cardoso F, et al. Should age be integrated together with clinical and genomic risk for adjuvant chemotherapy decision in early luminal breast cancer? MINDACT results compared to those of TAILOR-X. Presented at: San Antonio Breast Cancer Symposium; December 10-14, 2019; San Antonio, TX. Abstract GS4-05.
7. HOCHHEISER L,HORNBERGER J,TURNER M,et al. Multi⁃gene assays:Effect on chemotherapy use,toxicity and cost in estrogen receptor⁃positive early stage breast cancer. J Comp Eff Res,2019,8(5):289-304.
8. Bartlett JM, et al. Comparing Breast Cancer Multiparameter Tests in the OPTIMA Prelim Trial: No Test Is More Equal Than the Others. J Natl Cancer Inst, 2016 Apr 29;108(9) djw050.
9. Michaela Tsai, Shelly Lo, et al. Association of 70-Gene Signature Assay Findings With Physicians’ Treatment Guidance for Patients With Early Breast Cancer Classified as Intermediate Risk by the 21-Gene Assay. JAMA Oncol. 2018;4(1):e173470. doi:10.1001/jamaoncol.2017.3470
审批号:CN-48223 有效期:2022-3-23
•仅供医疗卫生专业人士使用和参考。
查看更多