查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





鲍曼不动杆菌(Acinetobacter baumannii,AB)是临床最重要的致病菌之一,其临床分离率、感染率、耐药率均呈上升趋势,成为全球抗感染领域的挑战1。2024年上半年CHINET数据显示,从2005年到2024上半年AB对碳青霉烯类的耐药率几乎翻倍,接近75%2。与碳青霉烯类敏感鲍曼不动杆菌相比,碳青霉烯类耐药鲍曼不动杆菌(carbapenem-resistant Acinetobacter baumannii, CRAB)感染患者的死亡率增加至少1倍;碳青霉烯类耐药是鲍曼不动杆菌感染患者死亡率增加的独立危险因素3。探究AB的耐药机制特点,是了解其耐药性特征及选择抗微生物药物方案的理论基础3。

AB的耐药机制囊括所有革兰阴性菌的耐药机制
AB多重耐药率约为其他主要医院内感染病原菌的4倍,这是由于其耐药机制囊括几乎所有革兰阴性菌的耐药机制,如多种抗生素酶水解失活、药物外排增加、膜通透性降低致药物流入减少、抗微生物药物靶位点改变等;亦可通过其毒力相关机制促进抗微生物药物耐药,如包膜因子、Ⅳ型菌毛、微量营养素获取系统等3。此外,AB还可形成生物膜,提高膜内AB对微生物药物的耐受性,使原本对游离态菌体有效的药物药效降低、甚至失效4。
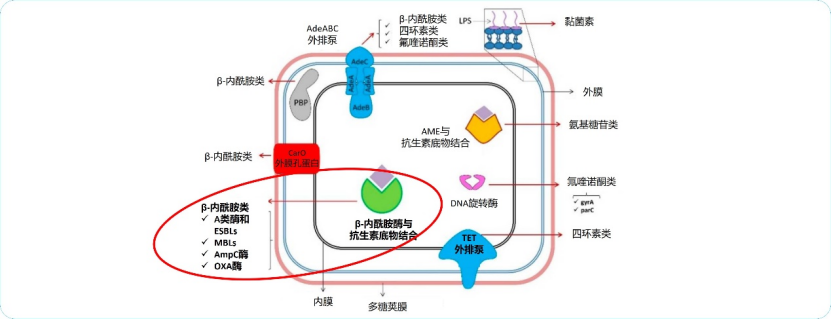
图1 AB的耐药机制5
AME:氨基糖苷修饰酶;ESBLs:超广谱内酰胺酶;MBLs:金属内酰胺酶;LPS:脂多糖;PBP:青霉素结合蛋白
总的来说,AB对β-内酰胺类耐药的最常见机制是β-内酰胺酶的水解作用,对四环素和替加环素耐药主要通过上调外排泵,对氟喹诺酮类药物耐药主要是由氟喹诺酮类靶酶、DNA促旋酶和DNA拓扑异构酶IV的突变引起,对氨基糖苷类耐药主要通过产氨基糖苷类修饰酶(AMEs),对黏菌素耐药机制则是染色体编码的突变引起5。
CRAB对碳青霉烯类的耐药机制
主要是携带blaOXA⁃23基因
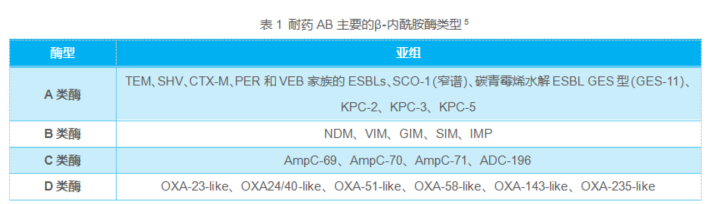
AB的耐药机制主要经β-内酰胺酶介导,AB有4种类型的β⁃内酰胺酶,即A~D类酶,以苯唑西林酶(OXA,D类酶)为主(表1)。AB的酶介导机制分为内源性酶和外源性酶,其中内源性酶主要包括OXA⁃51及染色体编码的头孢菌素酶(AmpC酶,C类酶),过量表达的OXA⁃51酶和鲍曼不动杆菌来源的头孢菌素酶(ADC,C类酶)共同导致AB对第三代和第四代头孢菌素的高耐药性3。
表1 耐药AB主要的β⁃内酰胺酶类型5
获得性碳青霉烯类水解D类β⁃内酰胺酶(CHDL)主要包括OXA⁃23、OXA⁃24/40、OXA⁃58等,在我国,CRAB对碳青霉烯类的耐药机制主要是携带blaOXA⁃23基因3。一项Meta分析结果表明,中国产碳青霉烯酶的CRAB分离株中,OXA-23是最常见的碳青霉烯酶,分离率为91%(95% CI 84%-96%)(图2)6。β-内酰胺酶抑制剂度洛巴坦钠可有效抑制A、C和D类β-内酰胺酶,对OXA-23的抑制活性是阿维巴坦钠的51倍7。
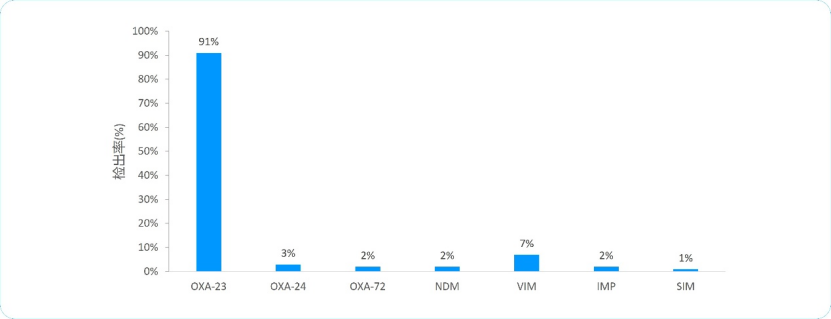
图2 中国产碳青霉烯酶的CRAB中不同碳青霉烯酶的分离率6
综述所述,目前我国AB对碳青霉烯类的耐药率高达73.1%,CRAB感染死亡率高于CSAB(carbapenem-sensitivityAcinetobacter baumannii)感染1-3。AB的耐药机制囊括所有革兰阴性菌的耐药机制,产β-内酰胺酶是其主要的耐药机制,携带blaOXA⁃23基因是CRAB对碳青霉烯类的主要耐药机制3;β-内酰胺酶抑制剂度洛巴坦钠对OXA-23的抑制活性是阿维巴坦钠的51倍7。
本文由安徽医科大学第一附属医院殷俊副主任医师审阅
参考文献:
1.周华,等. 中国循证医学杂志, 2016, 16 (01): 26-29.
2.CHINET 2024年上半年细菌耐药监测结果(2024年1-6月)
3.中华医学会神经外科学分会, 等. 中国现代神经疾病杂志, 2024, 24(6): 407-424.
4.侯小丫,等. 国际生物制品学杂志, 2022, 45(2): 111-115.
5.Ayoub Moubareck C, et al. Antibiotics (Basel). 2020 Mar 12;9(3):119.
6.Yu H, et al. MEDICC Rev. 2022 Jan 31;24(1):59-69.
7.McLeod SM, et al. Future Microbiol . 2024;19(7)563-576.
查看更多