查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





自2020年新冠疫情席卷全球,疫苗成为了结束这场持久而影响深远的大流行的关键,其中,mRNA疫苗更是在这场全球抗疫战中大放异彩。2022年伊始,我们也看到了国产新冠mRNA疫苗的好消息。
2022年1月24日,备受瞩目的国产mRNA新冠疫苗ARCoVaX(ARCoV)的Ⅰ期临床试验数据公布,并发表在《柳叶刀·微生物》(The Lancet Microbe)杂志上。这款国产新冠mRNA疫苗由艾博生物、军事科学院军事医学研究院和沃森生物共同研制,Ⅰ期临床试验由李兰娟院士领导进行,在杭州树兰医院完成。

ARCoV是国内首个进入临床试验的新冠mRNA疫苗,根据文章,这是一项单中心、双盲、随机、安慰剂对照、剂量递增Ⅰ期试验,评估了这款编码新冠病毒刺突蛋白(S蛋白)受体结合域(RBD)的mRNA疫苗的初步安全性、耐受性和免疫原性。
ARCoV的Ⅰ期临床数据
这项Ⅰ期临床试验纳入了120名18-59岁(平均27岁)、SARS-CoV-2感染阴性的健康成年人,并采用区组随机分组的方式随机分配,接受肌肉注射疫苗或安慰剂,疫苗剂量为5μg、10μg、15μg、20μg和25μg,共6组,每组20人。
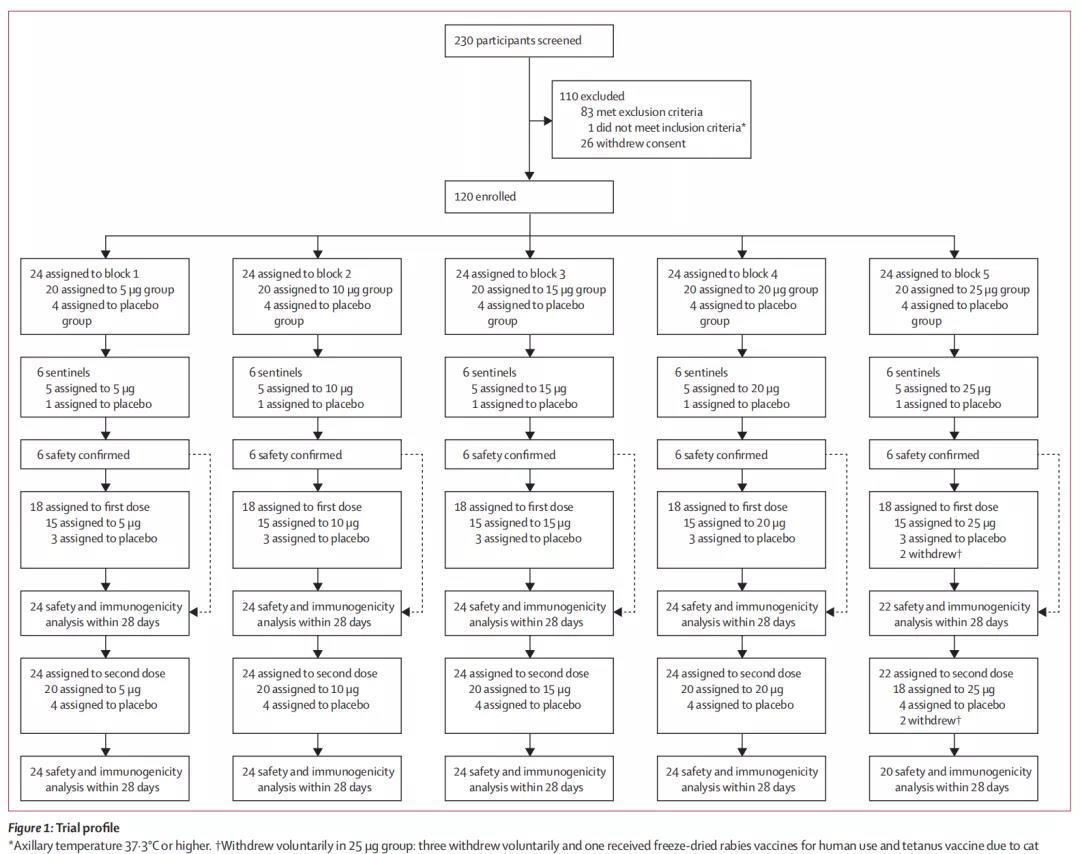
ARCoV的Ⅰ期临床试验流程图
试验结果显示,ARCoV在这5种不同剂量下均表现出良好的安全性和耐受性,接种后56天内无严重不良事件报告,大多数不良事件为轻度或中度。其中,发烧是最常见的系统性不良反应,出现频率随着剂量增加而增加,5μg组仅有5%受试者出现,25μg组100%出现(p<0.0001)。
更重要的是,ARCoV能够诱导强烈的体液和细胞免疫反应:抗RBD的IgG中和抗体在第二次注射后7天显著增加,并在第14 - 28天达到高峰,而特异性T细胞反应(IFN-γ/IL-2)在完全接种后7-14天达到高峰。
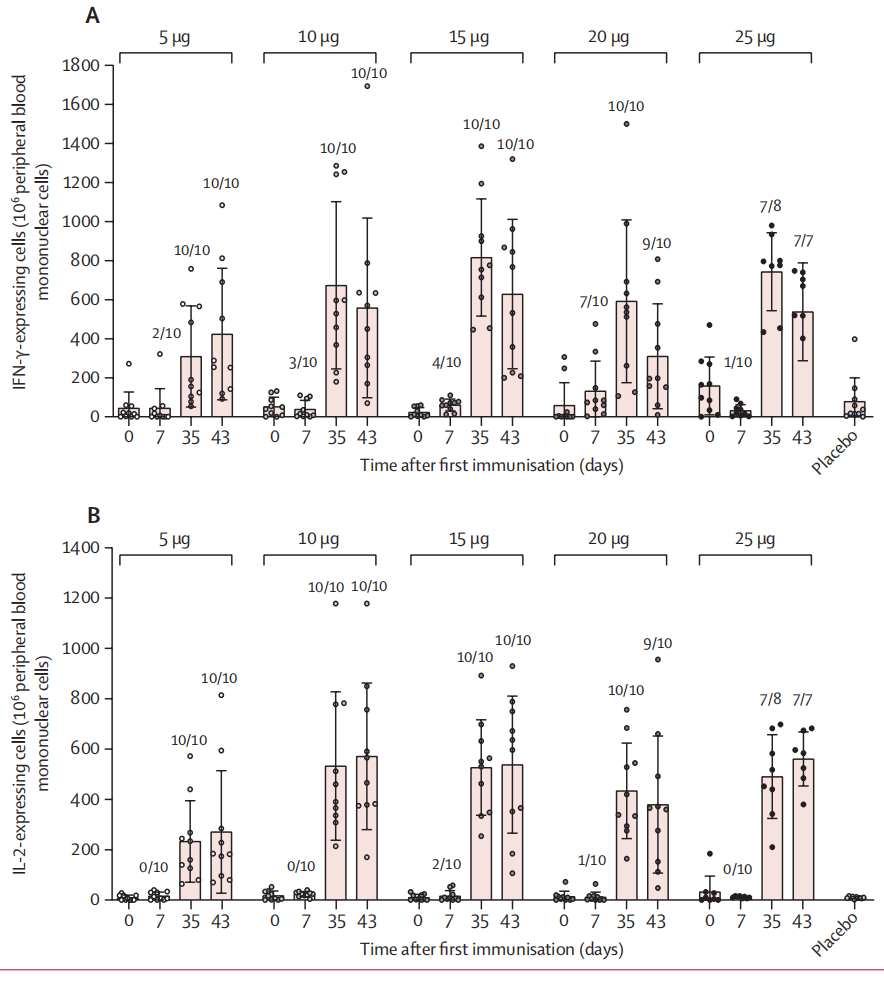
特异性T细胞反应(IFN-γ/IL-2)在完全接种后7-14天达到高峰
其中,15μg试验组诱导的中和抗体滴度最高:接种56天后,对原始野生型假病毒中和活性ID50达290,大约是新冠康复患者的2倍;对野生型活病毒的中和活性,15μg组中和滴度FRNT50为145,但5μg和25μg组则较低,分别为42和41。
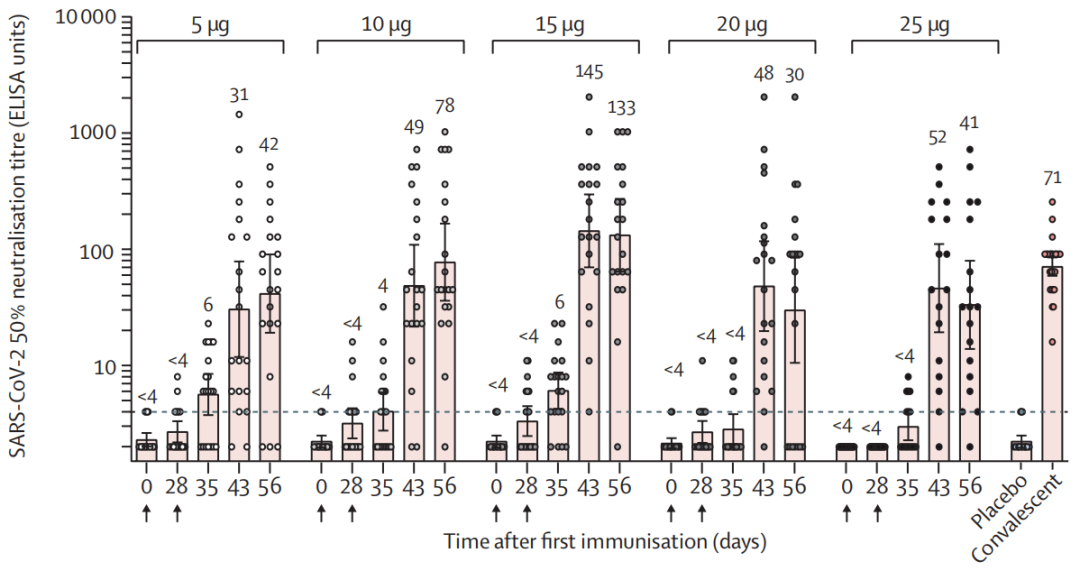
15μg试验组诱导的中和抗体滴度最高
据此,这项临床研究证实了ARCoV的安全性,且具有良好耐受性及免疫原性,支持了对ARCoV进行大规模的进一步临床测试,目前ARCoV的多中心Ⅲ期临床正在全面开展。
ARCoV的优势与不足
在ARCoV之前,国际上,辉瑞/BioNTech和Moderna研发的mRNA新冠疫苗表现优异。在临床试验中,这两种疫苗在预防症状性感染方面都有90%以上的效果,并获得美国FDA批准上市。虽然随着Delta和Omicron变体的出现,突破性感染有所增加,但这两款新冠mRNA疫苗在预防住院和死亡方面仍然相当有效。
ARCoV作为国内首款进入临床试验的新冠mRNA疫苗是一项重大突破,从目前的Ⅰ期临床数据来看,对比国际上已上市的这两款mRNA疫苗,ARCoV的有着明显优势,但也存在一些不足:
艾博生物开发的这款mRNA疫苗ARCoV具有出色的稳定性,可在正常家用冰箱温度下(2-8℃)长期保持稳定(至少6个月),这为mRNA疫苗向公众的应用提供了极大的便利。相比之下,Moderna的mRNA疫苗需要在-20℃下保存和运输(在2-8℃稳定30天),而BioNTech更是需要在-70℃下保存和运输(在2-8℃稳定5天)。
在安全性上,ARCoV的不良反应比较大。虽然这是mRNA疫苗的普遍特点,但ARCoV引发的不良反应还是有点出乎意料。在最有效的15μg组,出现一种以上不良反应的高达90%,其中出现发烧症状的有85%,30%的人是三级(39-40度的高烧);在25μg组,出现发烧症状的更是达到100%。这个比例超过了辉瑞/BioNTech与Moderna的mRNA疫苗所有临床试验的结果。
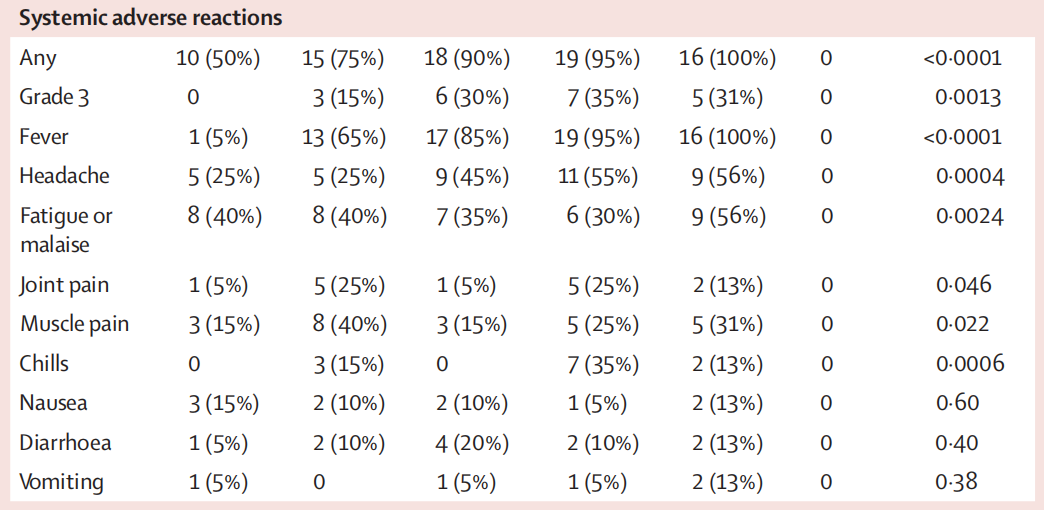
ARCoV的Ⅰ期临床试验的全身不良反应
此外,ARCoV表现出来的有效剂量范围较小。ARCoV的Ⅰ期临床数据显示,15μg可以引发高滴度的中和抗体,但其他四个剂量组的效果较差。例如,10μg、20μg组与15μg仅相差5μg,但接种第二针14天后中和抗体滴度却仅为15μg组的三分之一。相比之下,辉瑞/BioNTec开发的BNT162b1在中国的临床试验里,10μg组与最高效的30μg组差异并不大。鉴于接种时存在的剂量误差,如此狭窄的有效剂量区间可能会影响ARCoV的实际效用。
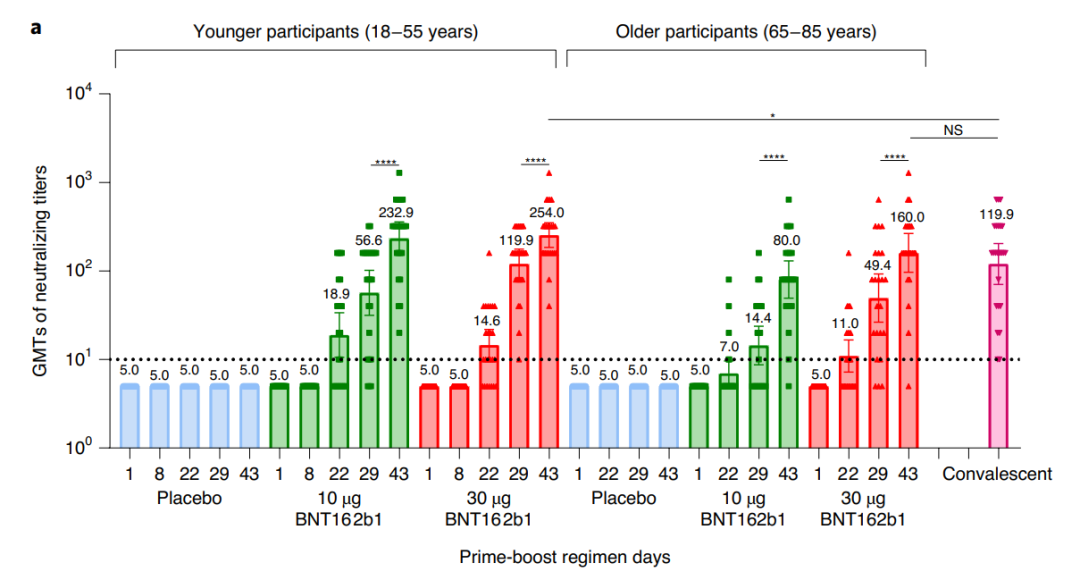
BNT162b1的10μg组与最高效的30μg组差异并不大
最后,ARCoV的抗原是新冠病毒刺突蛋白(S蛋白)的受体结合域(RBD),而不是常用的全长S蛋白,即和辉瑞/BioNTech早期候选疫苗BNT162b1相似,但辉瑞最终选择了BNT162b2(针对全长S蛋白)。值得注意的是,在临床试验中,仅用RBD的BNT162b1的不良反应比例要高于全长S蛋白的BNT162b2。此外,在突变株层出不穷、尤其是Omicron有更多RBD突变的情况下,ARCoV将在后续临床试验中面临更多挑战。
结语
新冠大流行爆发以来,mRNA疫苗备受公众关注,与灭活疫苗、亚单位疫苗和腺病毒载体疫苗等传统疫苗相比,mRNA疫苗可以提供更强的免疫保护能力,且可以根据病原体变异情况迅速进行更新迭代。
总而言之,这项发表在《柳叶刀·微生物》上的Ⅰ期临床研究表明,ARCoV能够诱导强烈的体液和细胞免疫反应,在接种后也未发现有严重的不良事件,并且具有出色的稳定性。但ARCoV也存在一些问题,例如发烧、淋巴细胞下降等不良反应的比例比目前国际上已上市的两款mRNA疫苗要高,以及有效剂量区间更狭窄等等。
作为国内首款进入临床试验的新冠mRNA疫苗,ARCoV被寄予了太多期望。据了解,在后续临床试验中,上述不良反应等问题已经得到了一定程度的改善。我们也期待ARCoV在后续大规模的临床试验中更出色的表现,期待首个国产新冠mRNA疫苗的上市。
本文转发自生物世界
查看更多