查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





原发性醛固酮增多症的确诊试验:系统回顾及META分析
作者:吴思岑 重庆医科大学附属第一医院健康管理科
原发性醛固酮增多症(Primary aldosteronism, PA)是继发性高血压的一个常见病因,它在普通高血压人群中约占6%,在三级医疗转诊中心的高血压人群中约占11%[1]。PA患者较与之血压相匹配的原发性高血压(Essential hypertension, EH)患者,具有更加严重的心血管及肾脏结局,因此对于PA的准确诊断至关重要[2-5]。
PA的诊断流程包括筛查、确诊和分型三个阶段。美国内分泌学会临床指南推荐了四种确诊试验,分别为盐水负荷试验(Saline infusion test, SIT)、卡托普利抑制试验(Captopril challenge test, CCT)、氟氢可的松抑制试验(Fludrocortisone suppression test, FST)及口服钠负荷试验(Oral sodium loading test, SLT)[6]。每种确诊试验均有其各自的优点及缺点。SIT目前虽然得到广泛应用并被认为其试验结果可靠,但对于肾功能不全或充血性心力衰竭的患者则是禁忌症[7]。相对而言,CCT更安全,更便宜并且在门诊患者中更容易实施,但对于卡托普利的剂量、采血的时间以及诊断的标准目前仍然存在争议[8]。FST被认为是最可靠的试验,但在实施过程中,其操作繁琐,并且完成整个试验所需费用较高[9-11]。SLT费用便宜,但尿醛固酮不能被准确测定,同时患者对于留取24小时尿液标本的依从性较差也是一个关键问题[12]。
迄今为止,关于比较四种确诊试验诊断效能的研究较少,哪种确诊试验是最优选择仍然存在争议。例如,在比较CCT与SIT时,Meng等人发现[13],以试验后的血浆醛固酮浓度(Plasma aldosterone concentration, PAC)作为诊断指标,SIT受试者工作特征(Receiver operator characteristics, ROC)曲线的曲线下面积(Area under the curve, AUC)为0.972,而CCT的AUC为0.933,SIT和CCT的阳性预测值分别为97.2%和96.1%,阴性预测值分别为80.7%和75.0%,提示SIT可能略优于CCT。而我们既往的研究发现[14],以试验后的PAC作为诊断指标,SIT的AUC为0.96,灵敏度为85%,特异度为92%,CCT的AUC为0.96,灵敏度为90%,特异度为90%,但SIT与CCT对比无显著统计学差异(P>0.05)。为了探究哪种确诊试验更优,我们对现有的数据进行了系统回顾和meta分析,并比较了以上四种确诊试验的诊断效能。
我们纳入了前瞻性及回顾性研究,它们评估了SIT、CCT、FST和SLT在PA中的诊断效能。纳入文献符合以下标准:(1)被纳入的PA患者和对照患者(EH、健康受试者、除PA外其它继发性高血压)均有明确定义;(2)至少通过以下方法之一确诊PA:(a)临床检查,包括生化诊断、影像学诊断、肾上腺静脉取血;(b)临床检查加手术、组织病理学检查、术后随访;(c)临床检查加给予盐皮质激素受体拮抗剂后的临床随访;(3)PAC或醛固酮/肾素比值(Aldosterone to renin ratio, ARR)用于评估CCT、SIT和FST,尿醛固酮用于评估SLT:(4)文献报道了四种确诊试验中至少一种确诊试验的诊断效能。排除文献符合以下标准:(1)综述、病例报道、动物实验或文献没有涉及上述四个确诊试验;(2)文献没有对照患者(如上所示):(3)文献缺乏足够的数据用于构建2x2四格表。
我们检索了PubMed、Embase和Cochrane Library在1980年1月至2018年1月期间发表的相关文献。我们不限制出版语言和研究设计,受试对象仅限于人类。最后一次检索日期是2018年1月17日。我们以“primary aldosteronism,”“primary hyperaldosteronism,”“sodium,”“captopril,”“saline”and“fludrocortisone”为自由检索词。两位研究人员(吴思岑、杨俊)均独立根据制定的纳入及排除标准对文献进行筛选。出现分歧时,由第三位研究人员(胡金波)决定。
两位研究人员(吴思岑、杨俊)使用标准化表格独立对纳入文献进行数据提取,包括第一作者、发表年份、地区、回顾性或前瞻性研究、PA患者及对照患者人数、醛固酮腺瘤(Aldosterone-producing adenoma, APA)患者的比例、醛固酮采样类型(血清或血浆)、诊断切点、确诊试验的AUC以及由真阳性、真阴性、假阳性和假阴性构成的2x2四格表。对于CCT,进一步提取卡托普利的剂量和采血时间。研究人员还独立对纳入文献进行质量评价,我们采用的质量评价工具为诊断准确性研究质量评价标准(Quality Assessment of Diagnostic Accuracy Studies, QUADAS-2)。数据提取及质量评价中存在的分歧通过协商或由第三位研究人员(胡金波)决定。
采用Spearman相关系数对阈值效应进行分析,诊断优势比(Diagnostic Odds Ratio, DOR)和Cochran-Q对非阈值效应进行分析。采用I2值对各研究间的异质性进行评估。当I2值>30%时使用随机效应模型。计算总受试者工作特征(Summary receiver operator characteristics, SROC)曲线和其相应的总曲线下面积(Summary area under the curve, SAUC)、合并敏感度、合并特异度及相应的95%置信区间(Confidence interval, CI)。采用Meta回归分析各研究间的异质性来源。所有的分析均使用Meta-Disc1.4版本。采用STATA12.0版本构建漏斗图以直观评估是否存在发表偏倚。所有统计检验均为双侧检验,P值<0.05表示差异具有统计学意义。
我们根据既定检索策略初步检索到2144篇文献,其中根据文献标题共筛选出135篇文献进行了摘要阅读及全文分析。其中综述、病例报道、PA患病率研究、PA筛查研究、PA分型研究、PA治疗研究、其他确诊试验以及缺乏有效数据用于构建2x2四格表的研究均被排除,最终26篇符合条件的文献被纳入研究(图1)。
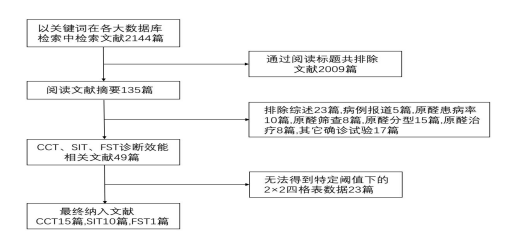

图1.文献筛选流程
表1总结了最终纳入meta分析的研究的相关特征。在这些研究中,13篇评估了CCT的诊断效能,8篇评估了SIT的诊断效能,2篇头对头评估了CCT和SIT的诊断效能,1篇评估了FST的诊断效能,没有研究评估SLT的诊断效能。
表1 纳入研究的特征
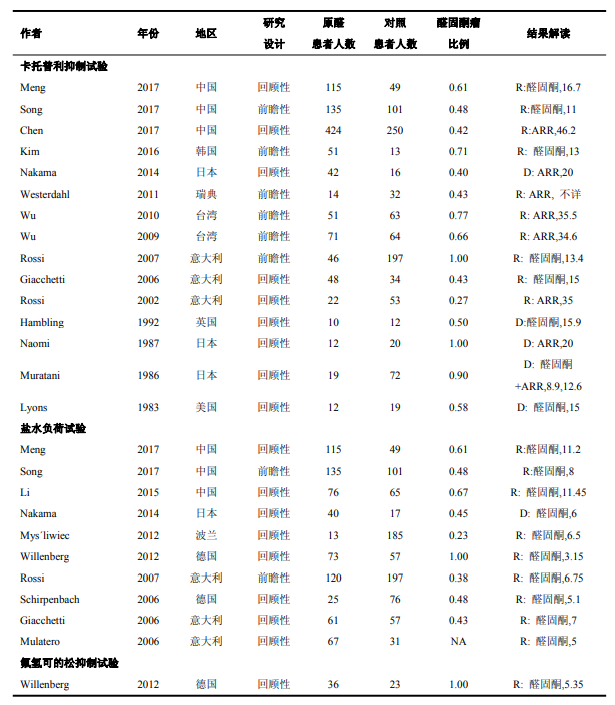

R, ROC 曲线; D, 自定义切点;醛固酮,血清或血浆醛固酮浓度(ng/dl); ARR, 醛固酮/肾素比值(ng/dl/ng/ml/h);例如, ‘R: 醛固酮,13’解释为该确诊试验切点通过ROC曲线确定,以醛固酮浓度作为结果判读标准,最佳切点为13ng/dl .
所有纳入研究的质量评价如图2所示。在CCT中,只有一项研究使用正常血压患者作为对照组[15],两项研究只纳入了APA患者[16,17],导致在“病例选择”的偏倚风险为高;两项研究由于缺乏关于病例是否为连续性或随机性的具体描述,在“病例选择”的偏倚风险为不确定[18,19];一项研究在金标准结果判读未使用盲法[8],从而导致了“金标准”中的临床适用性及偏倚风险为高。对于“待评价试验”及“病例流程和进展情况”,没有一项研究提示高风险。在SIT中,“金标准”一项具有最高的偏倚风险和临床适用性问题,因为有5项研究的金标准结果判读未使用盲法[8,20-23]。在“病例选择”偏倚风险为高的研究中,有两项研究纳入了正常血压患者作为对照组[20,23],一项研究排除了双侧肾上腺增生的患者[22]。对于“待评价试验”及“病例流程和进展情况”,所有研究均为低风险。在FST中,该研究因为排除了双侧肾上腺增生的患者以及金标准结果判读未使用盲法[22],导致在“病例选择”和“金标准”中的偏倚风险为高。通过Deek’s检验,我们在CCT和SIT中没有发现发表偏倚(P=0.714和P=0.244)。
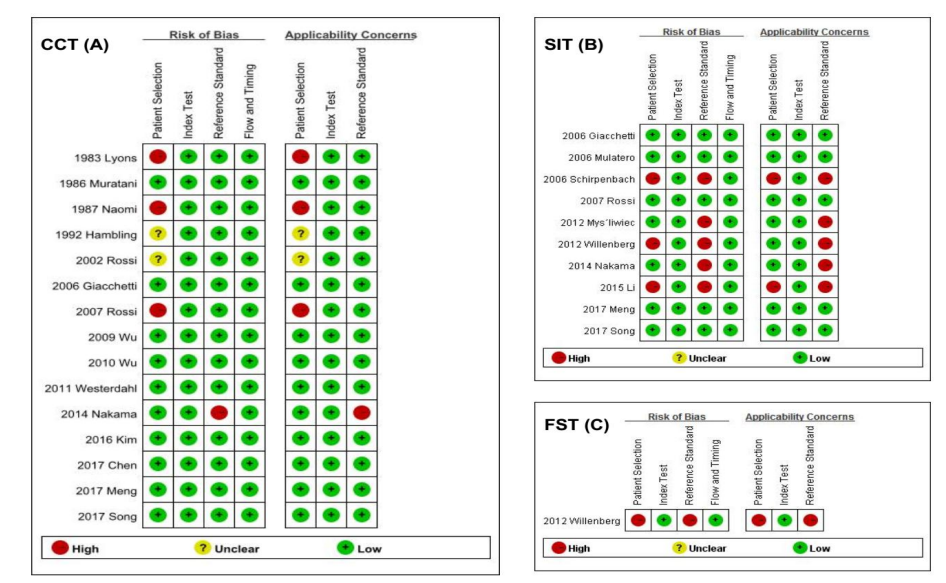

图2.卡托普利抑制试验(A),盐水负荷试验(B)和氟氢可的松抑制试验(C)的QUADAS-2评分
对于CCT,SAUC为0.9207,合并灵敏度及合并特异度分别为0.87(95%CI:0.84~0.89,I2=74.9%)和0.84(95%CI:0.81~0.86,I2=66.7%)。对于SIT,SAUC为0.9232,合并灵敏度及合并特异度分别为0.85(95%CI:0.82-0.87,I2=46.9%)和0.87(95%CI:0.85~0.89,I2=85.8%)(图3和图4)。由于只有一篇关于FST的研究符合纳入排除标准,我们将该研究的原始数据作为最终合并结果,即合并敏感度及合并特异度分别为0.87(95%CI:0.66~0.97)和0.95(95%CI:0.82~0.99)。结果表明,CCT、SIT及FST对PA均有较高的诊断效能。以CCT后的ARR作为诊断指标,其切点取值范围为12.6~46.2ng/dl/ng/ml/h(349~1279.7pmol/l/h),以CCT后的醛固酮作为诊断标准,其切点取值范围为8.9~16.7ng/dl(246.5~462.6pmol/l),SIT后的醛固酮切点取值范围为3.15~11.45ng/dl(87.3~317.2pmol/l),FST后的醛固酮切点取值为5.35ng/dL(148.2pmol/L)。除此之外,我们还发现CCT和SIT对PA的诊断效能没有显著差异(P=0.92),但由于FST相关的研究数量非常有限,我们不能有效将其与CCT和SIT进行比较。
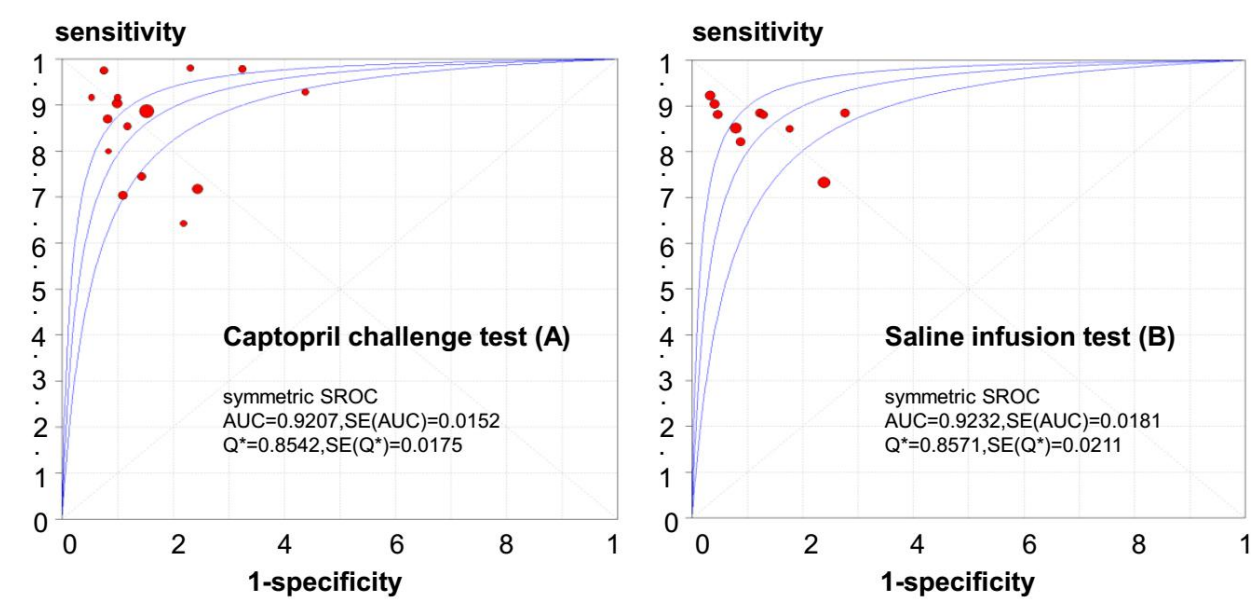

图3.原醛确诊试验中卡托普利抑制试验(A)和盐水负荷试验(B)的总受试者工作特征曲线(SROC)
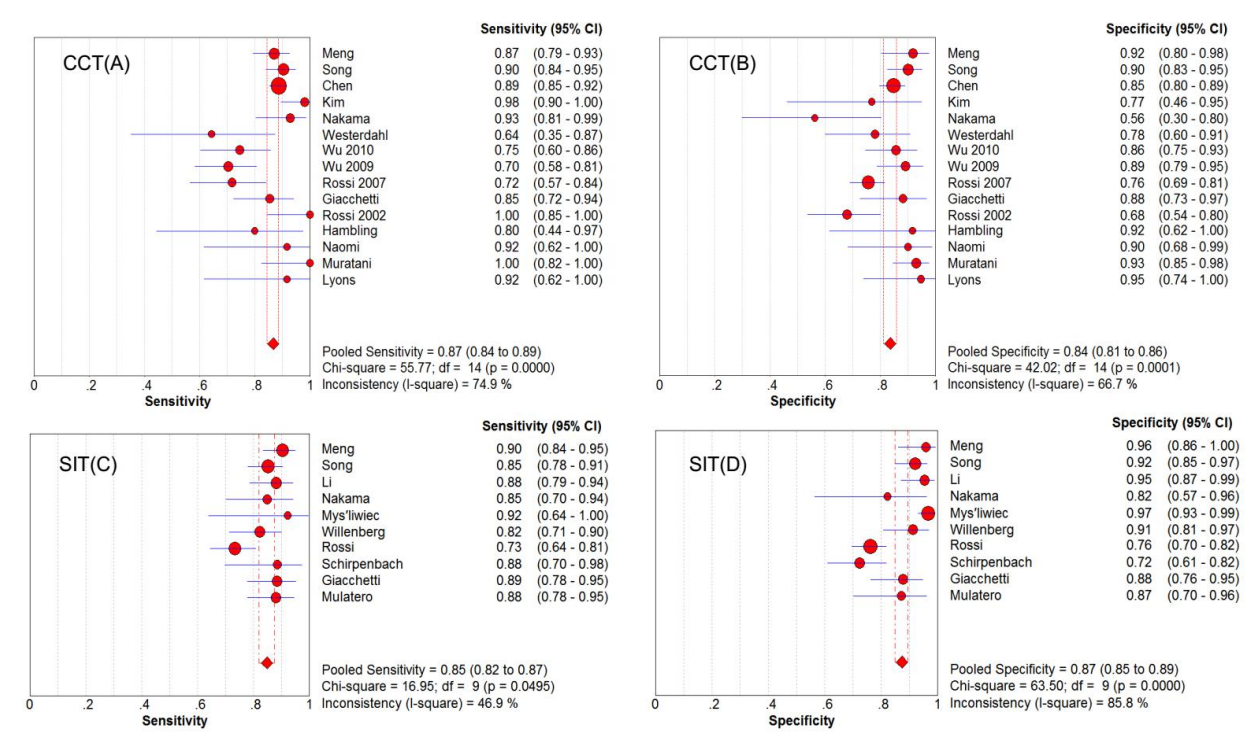

图4.原醛确诊试验中卡托普利抑制试验的合并灵敏度及特异度(A和B),盐水负荷试验的合并灵敏度及特异度(C和D )
在CCT中,Spearman相关系数和P值分别为0.034和0.904,在SIT中,Spearman相关系数和P值分别为0.539和0.108。因此,CCT和SIT均不存在阈值效应。为了评估非阈值效应引起的异质性,我们计算了DOR的Cochran‘sQ值和P值。CCT和SIT的P值均<0.10(CCT为0.0002,SIT为0.0000),表明在所有研究中均存在非阈值效应引起的异质性。因此,我们进行了Meta回归分析为进一步寻找异质性来源。对于CCT,包括“地区(欧洲、美洲或东亚)”、“采样类型(血浆或血清)”、“研究类型(前瞻性研究或回顾性研究)”、“醛固酮单位(ng/dl或pmol/l)”和“采血时间(1h、1.5h、2h)”在内的影响因素均被纳入了Meta回归分析,但这些因素均不是异质性来源。对于SIT,因为纳入的文献相对较少,我们无法通过Meta回归分析寻找异质性来源。
鉴于目前对CCT的结果判读存在不同的方式,因此我们以试验后的图像中的文字内容如下:
PAC[13-15,17,19,24]和ARR[8,14,16,18,26,27]分别作为CCT的诊断指标进行了亚组分析。在PAC亚组中,SAUC为0.9386,合并灵敏度为0.88(95%CI:0.84~0.91,I2=66.2%),合并特异度为0.83(95%CI:0.79~0.87,I2=67.4%);在ARR亚组中,SAUC为0.8992,合并灵敏度为0.84(95%CI:0.81~0.87,I2=81.4%),合并特异度为0.83(95%CI:0.80~0.86,I2=60.1%)(图5~图7)。我们还发现,以PAC和ARR分别作为CCT的诊断指标,对于PA的诊断效能无显著性差异(P=0.13)。
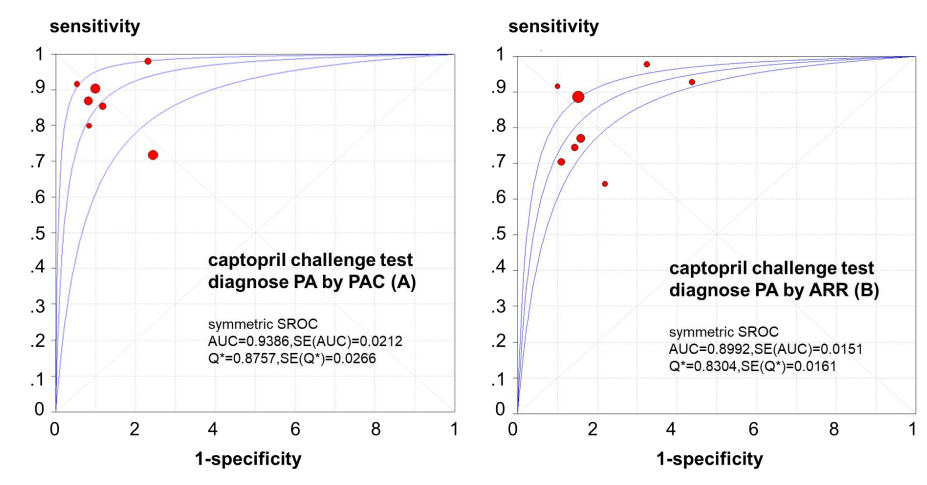

图5.卡托普利抑制试验亚组的SROC 曲线
Figure 6. Pooled sensitivity (A) and specificity (B) of CCT subgroup (ARR).
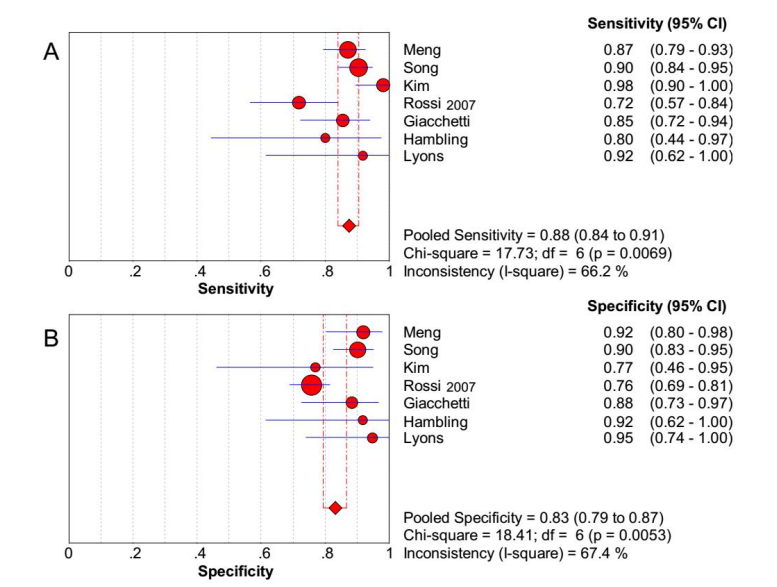

图6.卡托普利抑制试验PAC亚组的合并灵敏度(A)及合并特异度(B)
据我们所知,本项系统回顾和meta分析首次对PA四种确诊试验的诊断效能进行了评估。我们的研究发现,CCT、SIT和FST对PA的确诊均有较高的诊断效能。但是,我们未找到SLT的相关研究符合既定的纳入排除标准,也无法将其与另外三种确诊试验进行比较评估。
如上所述,我们对研究结果进行合并后,CCT和SIT表现出相似的诊断效能,但哪种确诊试验更好仍存在争议[8,17,25,30]。Nanba等人发现[30],对120名PA初筛阳性的高血压患者进行CCT、SIT、呋塞米立位试验,各组CCT阳性患者的比例均在85%以上,而SIT阳性患者的比例仅为60%左右。因此,与SIT相比,CCT似乎是一种更好的选择,因其灵敏度更高。相反,Meng等人进行了一项研究[13],164名高血压患者同时完成了CCT和SIT两种确诊试验,其中PA患者115名,EH患者49名,以试验后PAC为诊断标准,SIT的AUC为0.972,灵敏度为0.904,特异度为0.959;CCT的AUC为0.933,灵敏度为0.87,特异度为0.918。这些结果表明,在诊断PA时SIT较CCT略胜一筹。Rossi等人持有相同的观点[17],他们发现在高钠饮食时,CCT和SIT的AUC相似,但在低钠饮食(<130mmol/天)时,SIT的AUC值明显高于CCT(P=0.023)。结果表明,SIT与CCT一样可靠,且前者受钠摄入量影响较小,但SIT不推荐用于肾功能不全或充血性心力衰竭的患者。对于CCT,它比较安全,费用较便宜,并且在门诊患者中实施非常便捷,但卡托普利的剂量、试验过程中的体位以及试验阳性结果的判读标准尚不统一,这些均是应用的难点[9]。
目前有三种方法对CCT进行结果判读,它们分别是CCT后的PAC、CCT后的ARR,以及CCT后的PAC抑制率。我们一项纳入了236名高血压患者(包括135名PA患者和101名EH患者)的研究发现[14],以ARR作为CCT后的诊断指标,其诊断效能次于CCT后的PAC,两者灵敏度分别为77%和90%,特异度分别为84%和90%。Meng等人[13]一项纳入了164名高血压患者的研究发现,以CCT后的PAC作为诊断指标较CCT后的PAC抑制率的诊断效能更高,两者的AUC分别为0.933和0.552。在我们的Meta分析中,以ARR和PAC分别作为CCT的诊断指标,虽然两亚组间没有发现显著差异,但PAC组的SAUC和合并灵敏度更高,这可能提示了以PAC作为CCT后的诊断指标是一种更好的选择。
FST是一种更接近于PA病理生理学的确诊试验,既能实现对盐皮质激素受体的激活,又能实现容量扩张,因此被一些研究人员认为是最可靠的PA确诊试验[12]。然而,该试验繁琐,操作困难,价格相对昂贵,并且需要住院完成[31],这些因素限制了它的应用。我们只找到一篇研究符合纳入标准。有三篇关于FST的研究被剔除了[7,14,31],因为它们以FST作为金标准来评价其他确诊试验的诊断效能,导致FST的灵敏度为100%,而特异度无法提取。在纳入的研究中[22],59名患者完成了FST,根据ARR升高、SIT和/或FST后醛固酮分泌不被抑制、AVS的优势分泌指数为3以及同侧肾上腺肿块>5mm被确诊为PA。FST后血浆醛固酮的最佳诊断切点为5.35ng/dl(148pmol/l),其灵敏度为87%,特异度为95%。虽然FST具有较高的灵敏度和特异度,但FST相关研究的数量较少,我们无法有效将其与CCT和SIT进行比较。因此需要更多研究来评估总体的诊断效能。
SLT是最便宜的确诊试验,但24小时尿醛固酮无法被准确测定,患者留取尿液标本的可靠性同样是一个潜在问题,这可能是缺乏SLT诊断效能相关研究的原因。一篇研究[32]被剔除了是因为在49名同时完成了CCT和SLT的患者中,只有5名被诊断为EH,因此不能准确计算其特异度。我们有必要对SLT进行更大规模的研究,以更好评估其在PA诊断中的作用并与其他确诊试验进行比较。
本项meta分析结果提示存在异质性,但是通过meta回归尚不能找到异质性来源。研究中以下几个因素可能与异质性相关。首先,肾素和醛固酮水平受到各种条件的影响,而这些条件在研究中并不是统一控制的,包括降压药的使用、门诊或住院患者的血液样本采集、采血时间、试验过程的体位、钠和钾的摄入量、以及月经周期。其次,在纳入的研究中使用了不同的生化检测方法。目前,醛固酮的测定主要有三种方法:放射免疫法、化学发光免疫法和液相色谱-串联质谱法[33-35],这些测定方法具有显著的批间差异,因此可能得到不同水平的醛固酮值。第三,阳性结果的诊断切点在各项研究中有所不同。在SIT中,Li等人采用PAC>11.45ng/dl(317pmol/l)作为诊断切点,而Mulatero等人[7]采用PAC>5ng/dl(140pmol/l)作为诊断切点;在CCT中,亚组分析提示不同研究的诊断切点差异更大。最后,每项研究中APA患者的比例均不同,这将影响灵敏度和特异度。在含有多种PA亚型的研究中,若APA比例更高,那么其诊断切点将具有更高的特异度和更低的敏感度。
除了研究的异质性,我们的meta分析不足之处还有纳入研究的数量较少,特别是与FST和SLT相关的研究。由于缺乏SLT相关研究,我们无法对所有确诊试验进行全面的meta分析。虽然FST被认为是诊断PA最可靠的试验,但我们只有一项符合纳入排除标准的研究。除此之外,文献中还报道了其它不同的PA确诊试验,包括坐位盐水负荷试验[3]和地塞米松-卡托普利-缴沙坦试验,而这些试验均未被纳入本研究。最后,目前诊断PA缺乏金标准,对PA的诊断是基于临床表现、生化指标、组织病理学检查和治疗有效性来进行综合判断,因此对确诊试验的评估并不十分准确。
本项meta分析表明,CCT和SIT对PA均具有较高的诊断效能,并且两者的诊断效能没有显著差异。CCT可能是一种更可行的选择,因为它更安全且更容易实施。然而,我们的研究存在较大的异质性,这限制了结果的可靠性。除此之外,我们缺乏足够的数据来评估和比较FST和SLT的诊断效能。
因此,我们需要进行更多的、方法学更完善的研究,以综合评估和比较PA的不同确诊试验。
参考文献
[1] Buffolo F, Monticone S, Burrello J, et al. Is primary aldosteronism still largely unrecognized[J]? Horm Metab Res.2017;49(12):908-914.
[2] Ohno Y, Sone M, Inagaki N, et al. Prevalence of cardiovascular disease and its risk factors in primary aldosteronism: A multicenter study in Japan[J]. Hypertension.2018;71(3):530-537.
[3] Kuo CC, Wu VC, Tsai CW, et al. Relative kidney hyperfiltration in primary aldosteronism: a meta-analysis[J]. J Renin Angiotensin Aldosterone Syst. 2011;12(2):113-122.
[4] Rossi GP, Bermini G, Desideri G, et al. Renal damage in primary aldosteronism:results of the PAPY Study[J]. Hypertension.2006;48(2):232-238.
[5] Monticone S, D'Ascenzo F, Moretti C, et al. Cardiovascular events and target organ damage in primary aldosteronism compared with essential hypertension: a systematic review and meta-analysis[J]. Lancet Diabetes Endocrinol. 2018;6(1):41-50.
[6] Funder JW, Carey RM, Mantero F, et al. The management of primary aldosteronism:case detection, diagnosis, and treatment: an endocrine society clinical practice guideline[J]. J Clin Endocrinol Metab.2016;101(5):1889-1916.
[7] Mulatero P, Milan A, Fallo F, et al. Comparison of confirmatory tests for the diagnosis of primary aldosteronism[J]. J Clin Endocrinol Metab.2006;91(7):2618-2623.
[8] Nakama C, Kamide K, Kawai T, et al. The influence of aging on the diagnosis of primary aldosteronism[J]. Hypertens Res.2014;37(12):1062-1067.
[9] Stowasser M, Gordon RD. Primary aldosteronism--careful investigation is essential and rewarding[J]. Mol Cell Endocrinol.2004;217(1-2):33-39.
[10] Giacchetti G, Mulatero P, Mantero F, et al. Primary aldosteronism, a major form of low renin hypertension: from screening to diagnosis[J]. Trends Endocrinol Metab. 2008; 19(3):104-108.
[11] Mulatero P, Dluhy RG, Giacchetti G, et al. Diagnosis of primary aldosteronism: from screening to subtype differentiation[J]. Trends Endocrinol Metab. 2005;16(3):114-119.
[12] Mulatero P, Monticone S, Bertello C, et al. Confirmatory tests in the diagnosis of primary aldosteronism[J]. Horm Metab Res.2010;42(6):406-410.
[13] Meng X, Li Y, Wang X, et al. Evaluation of the Saline Infusion Test and the Captopril Challenge Test in Chinese Patients with Primary Aldosteronism[J]. J Clin Endocrinol Metab.2018;103(3):853-860.
[14] Song Y, Yang S, He W, et al. Chongqing P. Confirmatory Tests for the Diagnosis of Primary Aldosteronism: A Prospective Diagnostic Accuracy Study[J]. Hypertension.2018;71(1):118-124.
[15] Lyons DF, Kem DC, Brown RD, et al. Single dose captopril as a diagnostic test for primary aldosteronism[J]. J Clin Endocrinol Metab. 1983; 57(5):892-896.
[16] Naomi S, Umeda T, Iwaoka T, et al. Effects of sodium intake on the captopril test for primary aldosteronism[J]. Jpn Heart J. 1987; 28(3):357-365.
[17] Rossi GP, Belfiore A, Bermini G, et al. Comparison of the captopril and the saline infusion test for excluding aldosterone-producing adenoma[J]. Hypertension.2007;50(2):424-431.
[18] Rossi E, Regolisti G, Negro A, et al. High prevalence of primary aldosteronism using postcaptopril plasma aldosterone to rennin ratio as a screening test among Italian hypertensives[J].Am J Hypertens.2002;15(10 Pt 1):896-902.
[19] Hambling C, Jung RT, Gunn A, et al. Re-evaluation of the captopril test for the diagnosis of primary hyperaldosteronism[J]. Clin Endocrinol(Oxf).1992;36(5):499-503.
[20] Schirpenbach C, Seiler L, Maser-Gluth C, et al. Confirmatory testing in normokalaemic primary aldosteronism: the value of the saline infusion test and urinary aldosterone metabolites[J]. Eur J Endocrinol. 2006; 154(6):865-873.
[21] Mysliwiec J, Zukowski L, Grodzka A, et al. Diagnostics of primary aldosteronism: is obligatory use of confirmatory tests justified[J]? J Renin Angiotensin Aldosterone Syst. 2012; 13(3):367-371.
[22] Willenberg HS, Vonend O, Schott M, et al., Comparison of the saline infusion test and the fludrocortisones suppression test for the diagnosis of primary aldosteronism[J]. Horm Metab Res. 2012; 44(7):527-532
[23] Li Y, Liu Y, Li J, et al. Sodium infusion Test for Diagnosis of Primary Aldosteronism in Chinese Population[J]. J Clin Endocrinol Metab. 2016; 101(1):89-95.
[24] Kim JH, Park KS, Hong AR, et al. Diagnostic Role of Captopril Challenge Test in Korean Subjects with High Aldosterone-to-Renin Ratios[J]. Endocrinol Metab (Seoul). 2016; 31(2):277-283.
[25] Giacchetti G, Ronconi V, Lucarelli G, et al. Analysis of screening and confirmatory tests in the diagnosis of primary aldosteronism: need for a standardized protocol[J]. J Hypertens. 2006; 24(4):737-745
[26] Chen S, Zeng ZP, Song AL, et al. The application of captopril challenge test in the diagnosis of primary aldosteronism. Zhonghua Nei Ke Za Zhi[]]. 2017; 56(6):402-408.
[27] Westerdahl C, Bergenfelz A, Isaksson A, et al. Captopril suppression: limitations for confirmation of primary aldosteronism[J]. J Renin Angiotensin Aldosterone Syst. 2011; 12(3):326-332.
[28] Wu VC, Kuo CC, Chang HW, et al. Diagnosis of primary aldosteronism: comparison of post-captopril active rennin concentration and plasma rennin activity[J]. Clin Chim Acta. 2010; 411(9-10):657-663.
[29] Wu VC, Chang HW, Liu KL, et al., Primary aldosteronism: diagnostic accuracy of the losartan and captopril tests[J]. Am J Hypertens. 2009; 22(8):821-827.
[30] Nanba K, Tamanaha T, Nakao K, et al. Confirmatory testing in primary aldosteronism[]]. J Clin Endocrinol Metab.2012; 97(5):1688-1694.
查看更多