查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:广东省人民医院心内科 陈鲁原
一名年轻男子因心脏病发作被送往急诊室,最终被发现患有严重的冠状动脉疾病,但考虑到他的年龄、定期健康检查的结果(包括正常的血压以及血胆固醇水平),他在10年里心脏病突发的风险应该只有2%。但他的脂蛋白(a),也被称为Lp(a)指标很高,达到了80 mg/dl,或许有可能解释这种现象。
什么是Lp(a)?
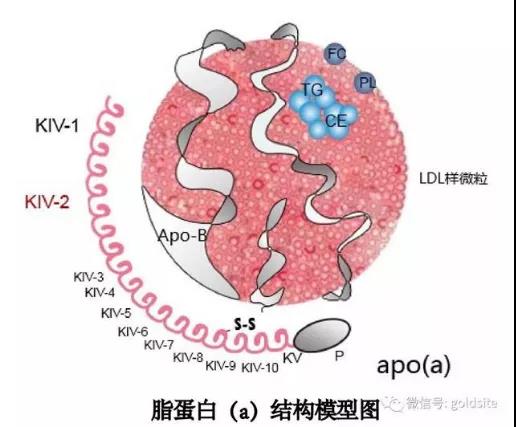
Lp(a)是由载脂蛋白(a)通过二硫键与LDL样颗粒连接构成,在肝脏中形成的复合物。Lp(a)不仅含有LDL-C的所有致动脉粥样硬化的、因素,还含有一分子的载脂蛋白a(Apo(a))。Apo(a)结构与纤溶酶原相似,具有致栓作用。
纤溶酶原含5种环饼结构域(Kringle,K1-K5),而apo(a)仅包括多个重复的KⅣ和一个KⅤ结构域,其中KⅣ结构域有10种亚型(KⅣ1-KⅣ10),除KⅣ2亚型为多拷贝外, 其余均为单拷贝。KⅣ2亚型的拷贝数由遗传因素(LPA基因)决定,从而导致apo(a)亚型大小的多态性。研究发现,KⅣ2型的拷贝数越大, apo(a)亚型越大, 蛋白合成、加工、分泌所需的时间越长,致使血浆中的Lp(a)水平越低;反之,Lp(a)水平越高。
血液中Lp(a)的浓度在个体之间差异很大,可以相差1000倍,从小于0.1 mg/dl到100或更高;总体呈低浓度正偏态分布。大约五分之一的人Lp(a)水平升高(>50 mg/dl)。人群中Lp(a)血浆浓度主要受遗传因素的影响,影响程度占75%~95%,主要由编码apo(a)的LPA基因而决定。Lp(a)几乎不受年龄、体重、饮食、运动和传统降脂药物的影响。白色人种、中国人、日本人的Lp(a)水平相对较低,而西班牙裔的水平较高,黑色人种的水平最高。
欧洲心脏病学会(ESC)指南则建议对所有成人广泛进行一次性Lp(a)测量,以识别高危个体——Lp(a)>180 mg/dl(430 nmol/L),但这一策略的广泛临床影响尚且未知。一次性测量主要是因为它通常是由基因决定的,在一生中不会有太大的波动。如果没有使用已知会显著改变Lp(a)水平的药物,通常不需要重复检测。
在大多数实验室中,LDL-C是用Friedewald公式计算的。Friedewald公式估算的cLDL-C和大多数dLDL-C(直接检测)均包括Lp(a)颗粒中存在的胆固醇。考虑到Lp(a)颗粒按重量计算由大约30%-45%的胆固醇组成,在Lp(a)浓度高的个体中会出现对TC、非-HDLC和LDL-C的明显高估情况。如果一个人的Lp(a)浓度为100 mg/dl,cLDLC和dLDLC将被高0.8~1.2 mmol/L。
如果某个患者的cLDLC值为100 mg/dl(2.6 mmol/L)、Lp(a)浓度为100 mg/dl,那么被Lp(a)纠正的LDLC大约只有55~70 mg/dl [即100 mg/dlL cLDLC减去30%~45%检测的Lp(a)]。在有效的LDLC降脂治疗的新时代,经过Lp(a)纠正的真实的LDLC浓度可低至0.3 mmol/L(10 mg/dl)。
在哥本哈根普通人群研究(Copenhagen General Population Study)中,人们突然发现25%的诊断为家族性高胆固醇血症的人,实际上是由于LDL中Lp(a)含量高所致。Lp(a)可能隐藏在高LDL和家族性高胆固醇血症中,因此,一定要检测它。
已知他汀类药物对LDL-C具有显著效果但并不降低Lp(a)浓度。如果高Lp(a)浓度是他汀类治疗效果明显失望的原因,在这种情况下可能不用增加他汀类药物的剂量了。
Lp(a)升高与心血管风险增加有关
为了不断降低心血管疾病残余风险,行之有效的办法就是不断更新其风险管理指标,并且积极进行干预和管理。近几年来LDL-C控制目标不断降低,2019年欧洲心血管疾病预防指南已将LDL-C控制目标已经下降到<55 mg/dl(1.4 mmol/L)。除此以外,在心血管事件残余风险研究中,近年来脂蛋白a(Lp(a))水平升高作为动脉粥样硬化心血管疾病的独立危险因素,在多种指南中不断提及。
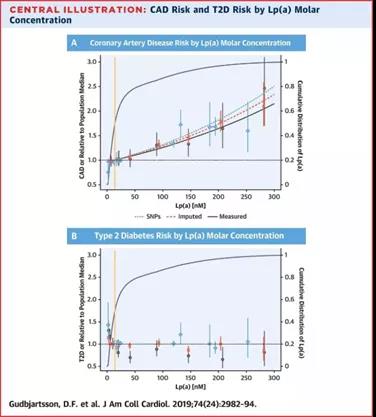
在普通人群中Lp(a)浓度升高是CVD和钙化性主动脉瓣狭窄的强大遗传风险因素,与LDLC无关。Lp(a)小于20 mg/dl可能是最理想的,大于30~50 mg/dl被认为是过高的。即便使用更保守的大于50 mg/dl的阈值,这也涵盖了大约10%~30%的全球人口,估计有14亿人。
2018年美国疾病控制和预防中心(CDC)首次批准两个Lp(a) ICD-10诊断编码,分别为“高Lp(a)血症” (E78.41) 和“高Lp(a)血症家族史” (Z83.430),用于临床诊断和病案记录。
在今天的临床实践中,人们终于意识到,最大程度降低LDL后的残余风险是高残余和Lp(a)的组合。
2020年,Mehta A教授在J Am Coll Cardiol上发表了其基于两个社区无症状人群(ARIC,社区动脉粥样硬化风险研究;DHS,达拉斯心脏研究)的长期队列研究结果,分析了Lp(a)及冠心病家族史与社区无症状人群中发生ASCVD和CHD事件的关系。该研究主要有两个发现:
1. Lp(a)的升高,可以独立的预测与社区无症状人群的长期ASCVD及CHD风险;其中DHS研究中Lp(a)升高更是使得CHD的风险增加3.37倍,而早发冠心病的家族史也只是使CHD的风险增加2.12倍。
2.将高Lp(a)和家族史联合,预测ASCVD及CHD风险效力更高;两个因素均为阳性,比一个阳性的风险预测提高1倍。
对于高危动脉粥样硬化心血管疾病人群,有早发心血管疾病家族史人群,增加Lp(a)作为管理目标,有助于进一步风险分层,并为临界风险人群明确治疗策略。

通过观察性研究和遗传研究比较LDL-C、残余胆固醇和Lp (a) –C升高1 mmol/L (39 mg/dl)对心肌梗死风险。经Nordestgaard /等人的许可改编的哥本哈根一般人群研究中的个体数据。
2019年5月,美国国家脂质协会(NLA)发布了关于Lp(a)临床应用的科学声明,认为Lp(a)作为ASCVD风险标记物的时代已经来临,并推荐成年人出现以下四种情况筛查Lp(a)是合理的(reasonable):
1. 具有一级亲属早发ASCVD的家族史;
2. 没有传统危险因素的早发ASCVD;
3. 原发性严重高胆固醇血症(LDL-C≥190 mg/dl)或怀疑家族性高胆固醇血症;
4. 识别使用PCSK9抑制剂更可能获益的极高危ASCVD患者。
目前研究认为,Lp(a)主要通过低密度脂蛋白样颗粒促动脉硬化、氧化磷脂促炎症及apo(a)促血栓形成参与ASCVD发生发展。重组Lp(a)在体外能抑制纤维蛋白凝块的溶解,其机制主要为抑制tPA激活纤溶酶原。可能PAI‐1水平升高也是纤溶酶原活性低的原因之一。
Lp(a)浓度与氧化磷脂密切相关。Lp(a)携带氧化磷脂。研究表明,Lp(a)和氧化磷脂可以很好地预测心血管疾病的预后。As斑块处存在氧化Lp(a),且氧化Lp(a)、自身抗体、以及Lp(a)循环免疫复合物在体内均被可检测。Lp(a)循环免疫复合物具强的致As作用,可见Lp(a)启动了机体的免疫应答反应。
在COVID-19感染大流行的最初的8.5个月内,那些Lp(a)浓度高的人发生心血管事件的风险明显较高。这意味着COVID-19感染增强了Lp(a)浓度与缺血性心脏病的关联。
怎样干预Lp(a)水平
目前尚无获批的药物疗法或缺乏经过前瞻性试验验证的策略来解决Lp(a)相关的过度风险。PCSK-9抑制剂可以将Lp(a)水平降低约25%。尽管PCSK9抑制剂和其他新型药物可使LDLC和Lp(a)都降低,但是Lp(a)降低本身是否为这些新型药物的临床受益尚不得而知。
临床试验显示,烟酸可适度降低Lp(a),但在他汀类药物的基础上加用烟酸可能不会进一步降低ASCVD风险。人类遗传学研究预计,可能需要大幅降低Lp(a)才能显著改善临床结果。
好消息是,目前,已经有旨在大幅降低Lp(a)水平的新型药物处于临床研发阶段。2020年一项发表于《新英格兰医学杂志》的2a期试验中,在286名ASCVD风险和Lp(a)升高的患者中,一种靶向LPAmRNA的反义寡核苷酸药物,代号为TQJ230,可将Lp(a)水平降低多达80%。TQJ230 是通过反义寡核苷酸(ASO)直接抑制编码的 apo(a) mRNA,减少肝脏apo(a)的合成,进而降低Lp(a)脂蛋白水平。
目前,这款药物正在全球的一项大型3期关键试验中接受检验,在7680名既往有心梗、中风或外周动脉疾病且Lp(a)水平>70 mg/dl的患者中,评估其对心血管结局的影响。此研究已获得中国国家药品监督管理局的批准(JXHL1900376),在我国多家三甲医院同步开展。
另一款药物Olpasiran(研发代号AMG890),一款靶向LPA的小干扰RNA(small interfering RNA,siRNA)药物,目前也正在开展2期试验。
来源:鲁原心论坛
查看更多