查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





lncRNASNHG1通过抑制p27kip1促进胃癌细胞的增殖作用
作者:施烯 福建医科大学附属第一医院
长链非编码RNA(lncRNA,long-chainnon-codingRNA)是一种不编码蛋白质的RNA,它由RNA聚合酶II转录,一般长于200个核苷酸[5]。lncRNA参与细胞生物学中的许多重要过程,如:信号传导的调控、DNA修饰、转录激活、转录后调控和蛋白质功能调节等[6]。许多研究认为lncRNA在肿瘤细胞的发展、耐药和转移中发挥了重要作用[7,8]。其中,SNHG1(smallnucleolarRNAhostgene1)是一种新发现的lncRNA,它位于染色体的11p12.3区域,长约3927个碱基[9]。SNHG1已经被证实在许多类型的肿瘤组织中高表达,如肺癌、肝癌、食管癌、胆管癌等[10],它能够通过与p53竞争性结合hnRNPC(recombinanthumanheterogeneousnucle-arribonucleoproteinC,重组人不均一核糖核蛋白C)来调节p53表达水平和活性,从而促进肿瘤发生发展[11]。另外,SNHG1还可以作为ceRNA(competingendogenousRNAs,内源竞争RNA)与各种miRNA(microRNA)竞争性结合,抑制miRNA对靶基因的调控从而发挥作用[10]。然而,lncRNASNHG1的表达及其在胃癌中的生物学功能目前尚未明确。
本研究探讨了lncRNASNHG1在胃癌中的表达及其对胃癌细胞增殖和细胞周期的影响,为胃癌的治疗寻找潜在的治疗靶点和预后标志物。

1.1材料
人永生化胃上皮细胞(GES-1)及胃癌细胞(NCI-N87和MKN-45)购自AmericanTypeCultureCollection(ATCC,美国)。实验中PCR引物,SNHG1探针、SNHG1过表达质粒及其shRNA干扰质粒,p27kip1过表达质粒及其shRNA干扰质粒均由上海吉玛公司合成。
1.2样本收集
在2017年6月至2018年6月期间,针对本院就诊患者中确诊胃癌、未接受术前放化疗或其他抗癌治疗的患者,在其知情同意的情况下,收取手术标本(胃癌组织和配对的癌旁组织),标本量为26例。标本保存于液氮中备用。
1.3原位杂交和免疫组化
为了检测胃组织中lncRNASNHG1的表达水平,根据试剂盒说明书进行原位杂交实验(试剂盒购于Boster公司,武汉)。将地高辛标记的lncRNASNHG1探针(1∶400)加入组织石蜡切片中,55℃孵育1小时后洗涤;随后试剂密封组织1小时,去除试剂后将组织切片置于含有抗地高辛抗体(1∶200)的TBST中,37℃孵育1小时;最后用HE染色,在显微镜下观察拍照。免疫组化检测均在本院病理科进行,p27kip1抗体(1∶200)购自SantaCruz公司(美国)。
1.4实时定量逆转录PCR
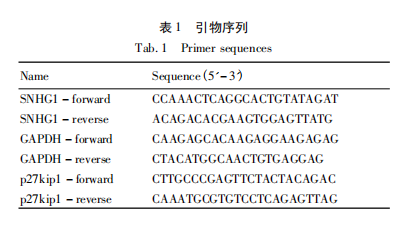
按说明书使用Trizol试剂(Vazyme,上海)从组织及细胞中提取总RNA。使用逆转录试剂盒(Takara,日本)将RNA逆转录成cDNA,后用SYBRPremixEXTaq试剂盒(Takara)完成实时荧光定量PCR实验。引物序列见表1。
1.5细胞培养及转染
将细胞在含有10%胎牛血清(Gibco,美国)的DMEM中于5%CO2、37℃条件下培养。转染试剂Lipofectamine2000购自Invitrogen(美国)。将pcDNA3.1-SNHG1、shSNHG1、pcDNA3.1-p27kip1及shp27kip1质粒根据说明书分别转染相应细胞(其中lipo∶质粒=2∶1),转染48小时后根据各质粒携带的抗性基因,分别给予嘌呤霉素(终浓度1μg/ml)或新霉素(终浓度400μg/ml)筛选,构建稳定细胞株。其中,shSNHG1序列:5'-GGCCAGCACCTTCTCTCTAAACTCGAGTTTAGAGAGAAGGTGCTGGCCTTTTT-3',shp27kip1序列:5'-CCGGGTAGGATAAGTGAAATGGATACTCGAGTATCCATTTCACTTATCCTACTTTTTG-3'[12]。获得的稳定细胞株继续在上述培养条件下培养。
1.6细胞活力测定
本研究使用CCK-8试剂盒(Beyotime,上海)进行细胞活力测定。以1500个/每孔的密度将细胞接种于96孔板中,待细胞完全贴壁后,分别在0、24、48、72和96小时向每个孔中加入CCK-8试剂,37℃下孵育4小时后用酶标仪测量其在490nm处的OD值,记录该OD值,并计算细胞活力。实验设六个复孔,独立重复三次。
1.7克隆形成实验
将细胞以1000个/每孔的密度接种在6孔板中,于正常培养条件下培养两周。用PBS小心洗涤细胞两次,加入预冷甲醇固定30分钟,移除甲醇后用1%结晶紫染料染色20分钟,清水漂洗,晾干后拍照计数细胞集落数。
1.8细胞周期测定
细胞周期检测试剂盒购自KeyGEN公司(南京)。取对数生长期细胞,胰酶消化后1000r/min离心3分钟收集细胞,PBS小心漂洗两遍,得到的细胞沉淀用300μlPBS重悬。向悬液中逐滴加入预冷无水乙醇700μl,4℃过夜固定。次日离心收集细胞,并用预冷PBS清洗残余乙醇。避光条件下加入20μlRNase(工作浓度50μg/ml)和20μlPI(工作浓度50μg/ml),避光室温染色30分钟,随后上机检测(FACSAriaII,BD,美国)并计算。
1.9Westernblot
用RIPA裂解细胞并提取细胞总蛋白,按BCA试剂盒(KeyGEN)说明书进行蛋白定量。将等量的细胞蛋白在10%SDS聚丙烯酰胺凝胶中电泳,后用湿转法转至PVDF膜上(Millipore,USA),脱脂奶粉封闭2小时后,一抗4℃孵育过夜。次日TBST洗涤后,加入相应的二抗,于室温下孵育1小时,GAPDH、p27kip1抗体(1∶500)及二抗均购自SantaCruz。最后将膜在TBST中漂洗彻底,加入ECL显影液(Bey-otime),在BioRAD凝胶成像仪上曝光显影。
1.10统计学分析
本研究使用GraphPadPrism7软件进行统计学分析。计量数据表示为平均值±标准偏差(x±s)。通过配对t检验或独立样本t检验进行组间平均差异的比较。P<0.05为差异有统计学意义。

2.1IncRNASNHG1在胃癌组织及细胞中高表达
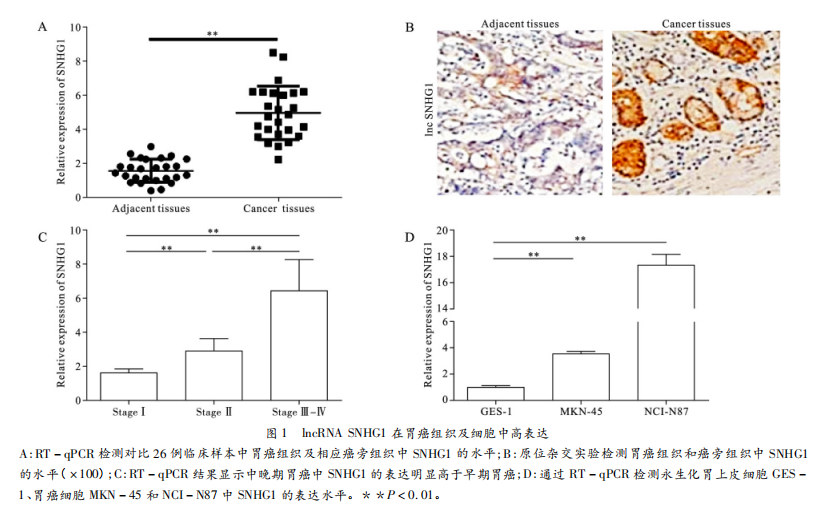
为了确定IncRNASNHG1在胃癌中的表达情况,运用RT-qPCR法检测26组配对胃癌组织和癌旁组织中的SNHG1水平。RT-qPCR结果显示:SNHG1在胃癌组织中的表达明显上调(图1A)。原位杂交后HE染色结果也显示,相比于癌旁组织,胃癌组织中SNHG1表达增高(图1B)。此外我们根据患者临床资料按不同疾病分期组织整理数据,发现SNHG1表达与胃癌TNM分期有关,其中中晚期胃癌SNHG1的表达明显高于早期(图1C)。为了进一步验证上述结果,我们检测了SNHG1在胃癌细胞(MKN-45、NCI-N87)和永生化胃上皮细胞(GES-1)中的表达,发现SNHG1在胃癌细胞中的表达显著高于永生化胃上皮细胞(图1D)。这些数据均表明IncRNASNHG1在胃癌中高表达。
2.2下调IncRNASNHG1抑制胃癌细胞增殖
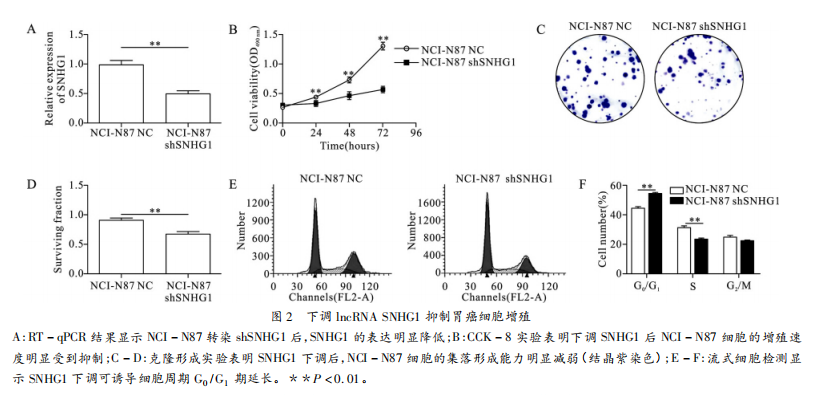
为了进一步探讨IncRNASNHG1在胃癌中的作用我们构建shSNHG1质粒并将其转染入NCI-N87细胞中以下调细胞中的SNHG1水平并通过RT-qPCR验证转染效果(图2A)。CCK-8实验结果显示下调NCI-N87细胞中的SNHG1后其细胞增殖能力明显受到抑制(图2B)。同时克隆形成实验也显示下调SNHG1后,NCI-N87形成细胞集落的能力明显减弱(图2C-2D)。此外,细胞周期测定结果发现,下调SNHG1可以诱导细胞周期停滞在G₀/G,期(图2E-2F)。以上数据表明,下调IncRNASNHG1可以抑制人胃癌细胞的增殖。
2.3上调IncRNASNHG1促进胃癌细胞增殖
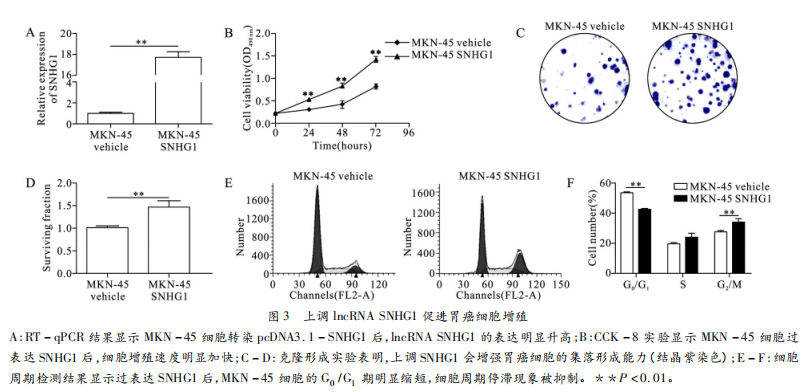
我们向胃癌细胞MKN-45中转染pcDNA3.1-SNHG1质粒以上调SNHG1并通过RT-qPCR验证了转染效果(图3A)。CCK-8实验结果显示,过表达SNHG1后,胃癌细胞MKN-45的增殖能力显著增强,72小时效果最为明显(图3B)。克隆形成实验表明上调SNHG1可以促进胃癌细胞的集落形成能力(图3C-3D)。而细胞周期测定进一步证明了上调SNHG1可显著减少MKN-45细胞G₀/G₁期的细胞周期停滞现象(图3E-3F)。上述实验结果证明IncRNASNHG1的上调可促进人胃癌细胞的增殖。
2.4IncRNASNHG1通过抑制p27kipl促进肿瘤生长
为了揭示SNHG1调控胃癌细胞增殖的机制,我们针对其可影响细胞周期这一细胞生物学现象检索了相关文献资料并通过RT-qPCR检测了临床样本中细胞周期相关蛋白mRNA的表达情况。其中,p27kipl表达在胃癌组织及相应癌旁组织中有显著差异(图4A)。我们通过免疫组化进一步证实了这一发现:相比于癌旁组织,p27kipl在胃癌组织中的表达明显偏低(图4B-4C)。通过统计学计算分析发现p27kipl与IncRNASNHG1的表达负相关,Pearson相关系数为-0.5208(图4D)。我们随后检测了p27kipl在胃癌细胞及永生化胃上皮细胞中的表达情况RT-qPCR结果显示:永生化胃上皮细胞GES-1中的p27kipl表达明显高于胃癌细胞MKN-45和NCI-N87(图4E)。为了验证我们的假设,我们将shSNHG1转染到NCI-N87细胞中(图4F)RT-qPCR和Westernblot结果显示下调SNHG1后NCI-N87细胞中p27kipl的表达在mRNA和蛋白质水平明显提高(图4G-4H)。随后我们将pcDNA3.1-SNHG1转染到MKN-45细胞中上调IncRNASNHG1(图4F)与预期的结果一致随着SNHG1的上调,MKN-45细胞中的p27kiplmRNA和蛋白质水平被抑制(图4G-4H)。
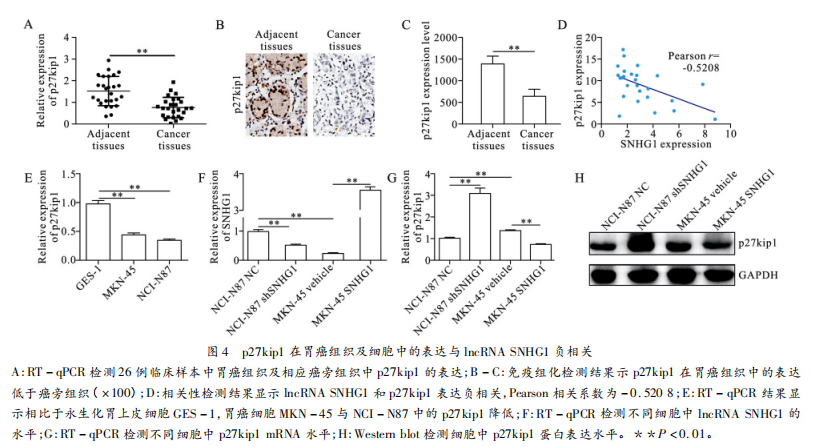
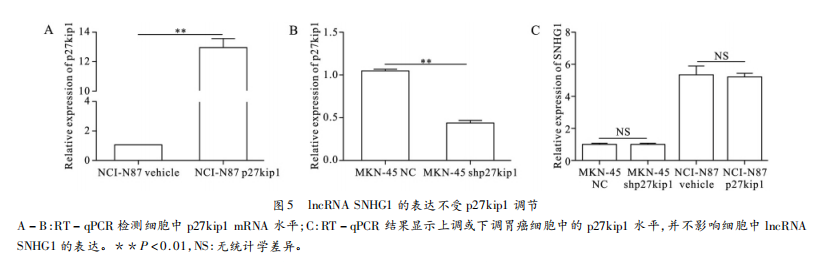
另一方面我们通过分别向NCI-N87和MKN-45细胞中转染pcDNA3.1-p27kipl或shp27kipl,以上调或下调胃癌细胞中p27kipl的表达(图5A-5B)RT-qPCR结果显示胃癌细胞中p27kipl表达水平的变化对SNHG1的表达并无明显调节作用(图5C)。因此我们推断JncRNASNHG1可能通过影响p27kipl在胃癌中发挥作用。
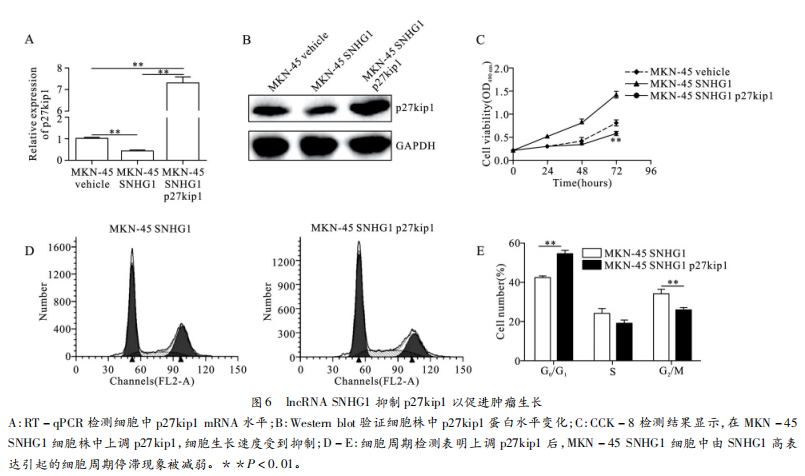
最后本研究进行了拯救试验来证实SNHG1是否通过p27kipl依赖性方式诱导胃癌发生发展。我们向SNHG1过表达的稳定细胞株MKN-45SNHG1中转染pcDNA3.1-p27kipl以上调细胞中p27kipl的表达水平,并通过RT-qPCR和Westernblot验证细胞株中p27kipl水平的变化(图6A-6B)。CCK-8结果显示MKN-45SNHG1细胞过表达p27kipl后其由SNHG1上调引起的较高水平的细胞增殖速度被明显抑制(图6C)。此外细胞周期测定也同样显示过表达p27kipl可以抑制MKN-45SNHG1细胞中由SNHG1上调引起的G₀/G₁期变化(图6D-6E)。这些数据均证明lncRNASNHG1通过抑制p27kipl促进胃癌细胞的增殖。

胃癌是全球发病率较高的恶性肿瘤之一中国每年新诊断的胃癌病例近70万例,占世界新发病例一半左右。且大多数病例发现时即处于晚期阶段每年中国胃癌相关死亡病例近50万例[3]。尽管越来越多的治疗手段被应用于胃癌,但发现新的生物标志物和靶向治疗以提高胃癌治疗效果、延长有效生存期仍至关重要。近年来,许多研究证实IncRNA参与肿瘤生长信号的调节[¹4]但IncRNA的大部分生物学功能仍不清楚。IncRNASNHG1也称为linc00057,由UHG转录而来,包含9个外显子,可以通过不同的信号途径促进肿瘤发生。在肝癌中SNHG1可以促进肿瘤细胞生长,且与肝癌的预后不良密切相关15]。SNHG1可以促进非小细胞肺癌的增殖和侵袭转移[16]。敲低SNHG1可抑制胆管癌细胞增殖及迁移并与胆管癌的预后不良有关[12]。此外,有研究表明在人淋巴母细胞受到照射后TK6细胞内SNHG1水平明显升高[17]。Hu等人研究发现IncRNASNHG1与胃癌T分期、TNM分期和淋巴结转移有关,且SNHG1高表达的患者预后显著较差,Hu认为IncRNASNHG1可作为预测胃癌预后的一种新型标志物[18]。本研究数据显示,与癌旁组织相比SNHG1在胃癌组织和细胞系中的表达显著上调,且与TNM分期相关。此外我们发现SNHG1水平与胃癌细胞的增殖能力存在相关性敲低或过表达IncRNASNHG1可调控胃癌细胞的增殖及细胞周期,这与SNHG1在非小细胞肺癌中的作用相似[16]。
为进一步阐明IncRNASNHG1促进胃癌增殖能力的具体机制我们检索相关文献,发现肺癌中SNHG1可以下调p27kipl蛋白水平从而推进肺癌进程19]。本研究中我们检测了细胞周期相关蛋白的表达量,通过统计分析发现p27kipl的表达和IncRNASNHG1呈负相关。p27kipl是细胞周期负调控因子它属于细胞周期蛋白依赖性激酶(Cyclin -dependentkinaseCDK)抑制蛋白Cip/Kip家族的一员,可以结合并阻止细胞周期蛋白E-CDK2或D-CDK4复合物的活化,从而诱导细胞周期停滞在G₁期,抑制细胞进入S期因此它也被定义为CDK抑制剂2021。此外,p27kipl还与细胞周期相关蛋白以外的蛋白质相互作用参与各种生物学进程,包括DNA复制、基因转录、细胞凋亡和分化
等[22-24。最近研究发现p27kipl蛋白在多种恶性肿瘤组织中表达降低或缺失,如乳腺癌、急性白血病、非小细胞肺癌等[27。本研究通过调控IncRNASNHG1的表达在胃癌细胞系也同样证明IncRNASNHG1负向调控p27kipl的表达。值得注意的是我们实验结果显示p27kipl的水平变化对In-cRNASNHG1的表达并无明显调节作用。本研究中最后的拯救试验进一步证实了SNHG1是通过p27kipl依赖性的方式诱导胃癌细胞增殖的。
【参考文献】
[1]Rebecca L Siegel,Kimberly D Miller,Ahmedin Jemal,et al.Cancer
statistics,2019[J].CA Cancer J Clin,2019,69( 1) :7-34 .
[2]Bertuccio P,Chatenoud L,Levi F,et al. Recent patterns in gastric cancer : A global overview[J].Int J Cancer,2009,125 (3 ) : 666 -
673 .
【3]Wang M,Gu H,Qian H,et al.miR - 17 -5p /20a are important markers for gastric cancer and murine double minute 2 participates in their functional regulation[J].Eur J Cancer,2013,49(8) : 2010 - 2021 .
[4]Zang M,Hu L,Zhang BG,et al.Luteolin suppresses angiogenesis and vasculogenic mimicry formation through inhibiting Notch1 - VEGF signaling in gastric cancer[J].Biochem Biophys Res Com- mun,2017,490(3) : 913-919 .
[5]Farong Ou,Kai Su,Jiadong Sun,et al.The lncRNA ZBED3 -AS1 induces chondrogenesis of human synovial fluid mesenchymal stem cells[J].Biochem Biophys Res Commun,2017,487 ( 2 ) : 457 -
463 .
[6]Mercer TR , Dinger ME,Mattick JS.Long non -coding RNAs : In- sights into functions[J].Nature Reviews Genetics,2009,10 (02) :
155 .
[7]Yantian Xu ,Yuanwen Zheng ,Hongyan Liu ,et al.Modulation of IGF2 BP1 by long non-coding RNA HCG11 suppresses apoptosis of hepatocellular carcinoma cells via MAPK signaling transduction [J].Int J Oncol,2017,51 (3) :791-800 .
[8]Li C,Gao Y,Li Y,et al.TUG1 mediates methotrexate resistance in colorectal cancer via miR - 186 / CPEB2 axis[J].Biochem Biophys Res Commun,2017,491 (2) : 552-557 .
[9]Tycowski KT,Shu MD. Requirement for intron-encoded U22 small nucleolar RNA in 18S ribosomal RNA maturation[J].Science, 1994,266(5190) : 1558 -1561 .
[10]Huang L,Jiang X,Wang Z,et al.Small nucleolar RNA host gene 1 : A new biomarker and therapeutic target for cancers[J].Pathol-
ogy - Research and Practice,2018,214(9) : 1247 -1252 .
[11]Shen Y,Liu S,Fan J,et al.Nuclear retention of the lncRNA SNHG1 by doxorubicin attenuates hnRNPC-p53 protein interac- tions[J].EMBO Rep,2017,18 (4) : 536-548 .
[12]Yu Y,Zhang MJ,Wang N,et al.Epigenetic silencing of tumor suppressor gene CDKN1A by oncogenic long non -coding RNA SNHG1 in cholangiocarcinoma[J].Cell Death Dis,2018,9 (7) :
746 .
[13]Huang J,Luo H,Zhou C,et al.Yield of staging laparoscopy for in curable factors in Chinese patients with advanced gastric cancer [J].J Laparoendosc Adv Surg Tech A,2018,28 ( 1) : 19-24 .
[14]Nagano T,Fraser P.No -nonsense functions for long noncoding RNAs[J].Cell,2011,145 (2) : 178 -181 .
[15]Zhang M,Wang W,Li T,et al.Long noncoding RNA SNHG1 pre- dicts a poor prognosis and promotes hepatocellular carcinoma tu- morigenesis[J].Biomedicine & Pharmacotherapy,2017,91 ( 10) : 906-911 .
[16]You J,Fang N,Gu J,et al.Noncoding RNA small nucleolar RNA host gene 1 promote cell proliferation in non small cell lung cancer [J].Indian J Cancer,2014,51 (3) : 99 -102 .
[17]Chaudhry MA.Small nucleolar RNA host genes and long non - coding RNA responses in directly irradiated and bystander cells [J].Cancer Biother Radiopharm,2014,29(3) : 135 -141 .
[18]Hu YB,Ma Z,He YM,et al.lncRNA-SNHG1 contributes to gas- tric cancer cell proliferation by regulating DNMT1[J].Biochem Biophys Res Commun,2017,491 (4) : 926-931 .
[19]Zheng-Fu.lncRNA SNHG1 promotes lung cancer cell prolifera- tion[J].Chinese Journal of Biochemistry and Molecular Biology, 2017,33 ( 12) : 1274 -1279 .
[20]Slingerland J,Pagano M. Regulation of the CDK inhibitor p27 and its deregulation in cancer[J].J Cell Physiol,2000,183 ( 1) : 10 -
17 .
[21]Chu IM,Hengst L,Slingerland JM,et al.The CDK inhibitor p27 in human cancer: Prognostic potential and relevance to anticancer therapy[J].Nat Rev Cancer,2008,8 (4) : 253-267 .
[22]Pierantoni GM,Esposito Francesco,Tornincasa Mara,et al.Home- odomain-interacting protein kinase -2 stabilizes p27kip1 by its phosphorylation at serine 10 and contributes to cell motility[J].J Biol Chem,2014,289(25) : 17-26 .
[23]Mohanty AR , Kan QM,Srivastava S.Successive phosphorylation of p27 ( KIP1) protein at serine -10 and C terminus crucially con- trols its potency to inactivate CDK2[J].J Biol Chem,2012,287 (26) : 21757-21764 .
[24]Larrea M,Liang J,Da Silva T,et al.Phosphorylation of p27Kip1 regulates assembly and activation of cyclin D1 -CDK4[J].Mol Cell Biol,2008,28 (20) : 6462-6472 .
[25]Sharma SS,W Jackson Pledger.The non -canonical functions of p27( Kip1) in normal and tumor biology[J].Cell Cycle ( George- town,Tex.) ,2016,15 (9) : 1189 -1201 .
查看更多