查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





脓毒症概述
脓毒症是宿主对感染的反应失调,引起危及生命的器官功能障碍。脓毒症休克是指感染导致的循环、细胞、代谢的明显异常,是脓毒症的一个亚型,其诊断标准是:脓毒症患者经过积极的液体复苏后仍然需要升压药来维持平均动脉压(MAP)≥65 mmHg,且血乳酸>2 mmol/L。
为了更好地治疗脓毒症,拯救脓毒症运动(Surviving Sepsis Campaign,SSC)制定了治疗脓毒症的“Bundle”,从6小时“Bundle”升级为3小时“Bundle”,2018年更新为1小时“Bundle”,这也体现了脓毒症是一种急症,需要快速处理。2018年“Bundle”包括:① 测定乳酸,若初始乳酸>2 mmol/L,2~4小时再次测量;② 使用广谱抗生素前要进行培养,获取病原学依据;③ 如果出现低血压或乳酸>4 mmol/L,即应开始快速输注至少30 ml/kg晶体液(3 h内完成),进行液体复苏;④ 如果液体复苏期间或复苏之后出现低血压,应启动血管加压药来维持MAP≥65 mmHg。
在液体复苏中,一方面建议要根据乳酸和血压来判断是否需要液体复苏,另一方面是建议以30 ml/kg晶体液来进行复苏,即固定的输液量。这也导致出现一些问题:液体复苏的主要目的是恢复组织灌注,根据血压和乳酸水平来判断组织灌注不足,是否合适?是否所有患者都适合这种液体量?脓毒症患者存在异质性,且液体复苏后,液体反应性和组织灌注如何评估?这都是临床需要解决的问题。
脓毒症微循环障碍机制
在临床工作中我们也经常发现有一些脓毒症患者宏观血流动力学参数已经达标,但患者最终仍进展至多器官功能障碍综合征(MODS)甚至死亡。导致这种临床现象的真正原因是微循环障碍。因为微循环障碍可出现于大循环改变之前,即大循环血流动力学参数未发生明显改变,但微循环已受创。另外,微循环障碍也可发生于复苏之后,复苏后系统血流动力学指标已改善,但微循环尚未恢复。研究也表明,脓毒症患者微循环障碍与死亡率相关,存活患者血管灌注比例明显高于死亡患者。
为何会出现这种情况?
这主要是由于脓毒症休克与低血容量性休克、心源性休克和阻塞性休克引起微循环功能障碍的机制不同。低血容量性休克、心源性休克和阻塞性休克都是由于大循环动力(心排量)下降而导致微循环驱动压下降,进而造成微循环功能障碍,引起组织低氧及后续的器官衰竭。此种情况下,微血管的改变主要依赖于宏观血流动力学的变化。而脓毒症休克是一种分布性休克,其大循环动力(心排量)不变或增高,更重要的是,由于炎症反应导致微血管损伤和调节能力异常,引起微循环功能障碍,进而引起组织低氧及器官衰竭。此种情况下,微血管的改变可以完全独立于宏观的血流动力学。
大循环是将氧输送到微循环,微循环再将氧输送到组织细胞。当发生脓毒症时,对大循环、微循环和细胞/组织都有损伤。对大循环的损伤主要在于引起血管扩张,相对血容量不足以及心肌功能障碍,因此出现分布性休克。对于微循环的损伤是导致灌注的血管密度下降,灌注异质性增加,毛细血管通性增强,所以出现“微循环分流”。对细胞/组织的损伤是引起线粒体机能下降,使其获取氧气不足,产生代谢功能障碍。上述情况最终都引起组织低氧。所以,从脓毒症导致组织低氧的机制上来看,脓毒症患者大循环、微循环和细胞/组织代谢的改变既有联系又相对独立。
因此,对于脓毒症患者,大循环和微循环受累后,仅改善大循环,无法缓解器官功能障碍,微循环不改善,患者预后也不会理想。如果单纯通过监测MAP、中心静脉压(CVP)、心输出量等指标来评估大循环的受累情况,远远不够。所以,微循环障碍已经成为判断脓毒症预后的重要依据,评估和改善微循环是脓毒症关注的热点。
微循环的构成
微循环是由微血管(直径<100 μm)构成,不同微血管有各自的结构特点和功能。微血管包括微动脉、后微动脉、直通微血管、真毛细血管、动-静脉吻合支(分流血管)、微静脉。
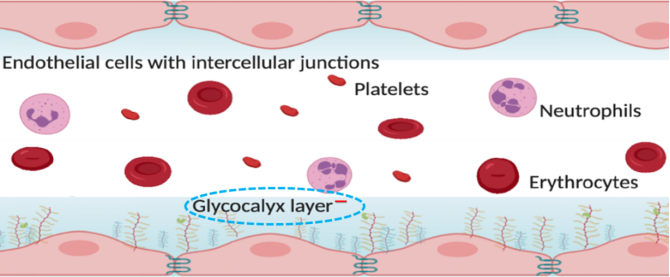
在微血管中,发挥最重要作用的是内皮细胞。通过监测血流量、新陈代谢和其他活性物质浓度的改变来调节血管的张力和毛细血管容量,控制血管通透性,在微循环灌注调节中具有核心作用。另外一个成分是多糖包被(Glycocalyx),位于血管内皮表面的内衬层,由糖氨聚糖、蛋白聚糖和糖蛋白构成多糖-蛋白质复合物。因其本身带有负电荷,可以阻止带有负电荷的蛋白质进入血管外空间,并作为白细胞黏附内皮细胞的屏障。脓毒症使其降解、变薄,导致出现微血管功能障碍,促进循环细胞黏附、微血栓形成和通透性增加。
作者:赵洪文
单位:中国医科大学附属第一医院
本文转发自重症肺言



查看更多