查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





糖尿病(diabetes mellitus,DM)是一种发病率和致残率极高的慢性代谢性疾病。长期高血糖刺激可能会使骨组织正常的钙磷代谢发生紊乱,引起骨重塑受阻以及骨微结构受损,最终可能导致DM患者骨质量的降低和骨折风险的增加。越来越多的证据表明,DM是发生骨质疏松症(osteoporosis,OP)的独立危险因素,糖尿病性骨质疏松症(diabetic osteoporosis,DOP)已经成为DM的严重并发症之一,临床上1型、2型糖尿病患者的骨密度及骨折风险越来越受到重视。
值此契机,本期“骨舞健言”荣幸地特邀华中科技大学附属同济医院内分泌科主任、中华医学会内分泌学分会常委、中国医师协会内分泌代谢分会委员、湖北省内分泌学会主任委员余学锋教授对糖尿病性骨质疏松症诊疗现状、综合管理及未来研究方向解读。现将内容整理如下。
余学锋 教授
华中科技大学附属同济医院
华中科技大学附属同济医院内分泌科主任,教授、主任医师、博士研究生导师
现任中华医学会内分泌学分会常委
中国医师协会内分泌代谢分会委员
湖北省内分泌学会主任委员
武汉市内分泌学会主任委员
《中国糖尿病杂志》《中华糖尿病杂志》《中华骨质疏松和骨矿盐疾病杂志》《临床内科杂志》《内科急危重症杂志》《药品评价》等多家杂志的编委
主要从事糖尿病及代谢性骨病的研究
主持多项国家自然科学基金并发表有多篇论文
2019年一项发表于Medicine、来自中国的54项2型糖尿病(T2DM)患者骨质疏松症患病率的Meta分析结果显示,中国超过三分之一T2DM患者患有骨质疏松症。您作为从事糖尿病及代谢性骨病的临床专家,可否请您介绍一下糖尿病骨质疏松症患者当前诊断现状?
余学锋教授:糖尿病性骨质疏松症(DOP)是高血糖在人体骨骼系统中引起的一种严重的慢性并发症,一项系统性综述和荟萃分析,纳入14项研究,涉及695例糖尿病患者和4,937例对照人群,研究结果显示,糖尿病患者骨折愈合受损风险是非糖尿病患者的2.11倍(OR: 2.11; 95%CI 1.33~3.37,p=0.002)[1]。2022年1月,发表于柳叶刀上的综述全面描述了糖尿病骨质疏松的细胞和分子机制。作为一种全身性的内分泌疾病,糖尿病诱发骨质疏松的发病机理十分复杂,主要体现为慢性高血糖状态影响全身信号转导过程,造成骨骼微环境中的相应基因表达水平和细胞功能发生了特定变化。其中,慢性高血糖状态引起胰岛素信号、肠促胰素效应、Wnt信号下降的同时引发慢性炎症、加剧组织损伤,表现为氧化应激活性氧(ROS)生成、糖基化终产物(AGEs)增加、微血管损伤等。长期刺激诱发骨微环境中脂肪细胞数量上升,成骨细胞、骨细胞、破骨细胞、内皮细胞、细胞外基质产物下降,最终导致骨脆性增加而形成骨质疏松症[2]。
图1 糖尿病和慢性高血糖致骨脆性增加的细胞和分子机制[2]
注:RANKL:核因子-κB受体激活剂配体;AGEs:晚期糖基化终末产物
T2DM导致骨折的机制是多种因素综合作用的结果。T2DM患者的骨密度(BMD)通常正常或升高,可能与肥胖有关。然而低骨转换和微结构改变可能导致骨强度降低和骨折风险增加。T2DM患者的皮质骨微结构受损,具有较低的皮质骨体积骨密度(vBMD),较高的皮质孔隙率,胫骨的横截面积更小,这可能解释了T2DM中某些骨折部位(例如髋骨和肱骨,主要由皮质骨组成)的骨折风险更高的原因。其他因素包括T2DM药物应用、微/大血管并发症及其对跌倒风险的影响[3]。
图2 T2DM患者发生骨质疏松骨折风险增加的可能机制[3]
注:BMD:骨密度;vBMD:体积骨密度
1型糖尿病(T1DM)引起的骨质疏松以骨密度、骨质量、骨愈合速度、骨形成降低和骨吸收增加为特征。导致1型糖尿病骨质疏松骨折风险增加的机制包括胰岛素缺乏、高血糖、胰岛素抵抗、较低的胰岛素样生长因子-1、高血糖诱导的氧化应激和炎症。在T1DM患者中,跌倒、肾功能不全、视力减退和神经病变的概率较高,间接增加骨质疏松性骨折的风险。此外,T1DM患者骨中一氧化氮(NO)的生物利用度降低,成骨细胞介导的骨形成减少,破骨细胞介导的骨吸收增加,也增加了骨质疏松性骨折的风险[4]。
图3 T1DM患者发生骨质疏松骨折风险增加的可能机制[4]
注:eNOS:血管内皮型一氧化氮合酶;iNOS:诱导型一氧化氮合酶;NO:一氧化氮;HSC:造血干细胞;MSC:间充质干细胞;TGF-β:转化生长因子β;SOST:骨硬化蛋白;Runx-2:Runt相关转录因子2;osterix:成骨细胞特异性转录因子;OPG:骨保护素;RAKNKL:核因子-κB受体激活剂配体;Wnt pathway:Wnt 通路;AL Pase:碱性磷酸酶;Osteocalcin:骨钙素;Osteopontin:骨桥蛋白;BMD:骨密度;Tb.Th:骨小梁厚度;Tb. N:骨小梁数量;Tb. Sp:骨小梁分离;bone marrow cavity:骨髓腔;cortical.Th:皮质骨小梁
在疾病诊断方面,BMD是评价DOP患者骨质量的常用指标之一,但其并不完全适用于DM患者,特别是T2DM患者骨质量的检测,因为T2DM患者的BMD通常表现为正常或升高,但却存在很高的骨折风险隐患。在双能X线吸收法测定(DXA)骨密度检测会低估糖尿病患者骨折风险的情况下,临床上如何评估糖尿病患者的骨质量及骨折风险成为一个棘手问题。目前,可用的评估手段除了DXA检测的BMD还包括: 骨折风险评估工具(FRAX)、骨小梁评分(TBS)、高分辨率外周定量计算机断层扫描(HR-pQCT)、冲击微压痕(IMI)、骨组织形态计量学、傅里叶变换红外光谱(FTIR)等。
FRAX、HR-pQCT等诊断技术在广泛用于常规的临床检测受到挑战,主要可能是因为它们并不包含所有DM相关的变量参数。期望未来有新的诊断工具,可以将空腹血糖含量、空腹胰岛素含量、糖化血红蛋白(HbA1c)水平、胰岛素抵抗指数、AGEs含量、激素水平以及DM患者的年龄、性别、身体质量指数、病程等影响因素与骨质量评价指标相结合,综合判断DM患者的骨折风险。此外,骨组织形态计量学、FTIR等骨活检技术具有一定的创伤性,目前多用于基础研究。但是,这些技术的检测指标不仅可以反映DM患者的骨量信息,还可以实时监测骨骼在氧化应激、糖基化反应等条件下的动态变化,这有助于及时判断DM患者的骨代谢失衡情况,并解释高血糖引起的骨脆性增加的原因。
另外临床医生在评估检测技术的安全性和实用性的同时,还需要考虑到患者的经济情况。一般来说,选择分辨率高、精密度高和特异性强的检测技术进行骨质量检查时,患者需要支付相对高昂的费用,这可能会导致其放弃检查。但是,如果选择成本低廉的检测技术,患者可能会得到不准确的结果。因此,为了让更多的DM人群及时检查骨质量,临床工作者还需进一步探索出价格实惠的检测方法[5]。
概而论之,随着新兴检测手段的不断发展,DM患者的骨质量及骨折风险评估检测选择也是愈趋多样化,但是DXA仍由于其检测价格低廉、耗时短、辐射量少相对安全,可以测量腰椎、髋部、手臂等身体各个部位的BMD等优点,目前仍是DM患者诊断OP、评估骨折风险和监测药物治疗效果的“金指标”,广泛适用于临床骨质疏松诊疗一线选择。
图4 DOP的诊断方法简介[5]
感谢余主任为我们全面、详细地介绍了糖尿病骨质疏松的发病机制与诊断现状。如您所说,糖尿病骨质疏松已成为亟待解决的重要问题,那么请您结合丰富的临床经验,谈谈糖尿病骨质疏松患者综合治疗措施有哪些?
余学锋教授:DOP兼有DM和OP两方面特点,常见临床症状包括微血管和大血管病变、肌肉骨骼疼痛、骨骼畸形、脆性骨折等。总览多部国内外糖尿病与骨质疏松疾病相关管理指南、专家共识可以发现,糖尿病患者骨质疏松及其骨折的综合干预措施包括调整生活方式;控制血糖,减少糖尿病相关的各类并发症;同时给予抗骨松治疗、降低骨折风险、预防跌倒等。在降糖药物选择方面,总体治疗避免使用增加骨折风险的药物。对骨折高风险的糖尿病者,应选用不影响骨代谢或是有骨保护作用的降糖药物[6]。整体上降糖药物可能以消极、中性或积极的方式影响骨代谢[7]。
图5 糖尿病药物对骨矿物质代谢的作用机制[7]
注:GLP-1:胰高糖素样肽-1;PPARγ:过氧化物酶增殖物激活受体γ;SGLT-2:钠-葡萄糖协同转运蛋白-2
磺脲类药物(由于低血糖的风险)和噻唑烷二酮类药物(由于作用机制)不推荐用于骨矿盐疾病和糖尿病患者。钠-葡萄糖协同转运蛋白-2(SGLT-2)抑制剂和二肽激肽酶-4(DPP-4)抑制剂等新型降糖药对糖尿病患者骨代谢的疗效数据尚无定论。最近发表一项综述指出,SGLT-2抑制剂对骨折的影响存在争议,临床医生处方前应充分评估患者骨密度和骨折风险[8] 。目前已有研究证实了二甲双胍对糖尿病患者骨密度及骨折风险的益处。一项纳入14,611例二甲双胍使用者的回顾性研究[9]指出,二甲双胍治疗>2年与较低的骨折风险相关,虽然二甲双胍带来的保护作用随着年龄的增长而减弱,但在≥80岁的患者中仍有显著意义。敏感性分析结果显示,二甲双胍显著降低了30%-40%的骨质疏松和椎体骨折风险(无论先前是否有骨质疏松)。另外作为肠促胰岛素家族的重要成员,胰高血糖素样肽-1(GLP-1)受体激动剂可通过促进成骨分化和抑制成脂间充质前体细胞在骨中的作用等多重机制,显示出对骨矿盐疾病的积极作用。
图6 二甲双胍显著降低骨质疏松及椎体骨折风险[9]
对糖尿病患者的抗骨质疏松药物治疗,在通过阳光照射或补充普通维生素D,使血清25(OH)D水平达到充足状态的同时,可以采用抗骨吸收制剂或骨形成促进剂,其基本使用原则、方法和疗程同原发性骨质疏松症。关于抗骨质疏松糖代谢最新重磅研究内容如下:
双膦酸盐是目前临床上应用的最广泛的抗骨质疏松药物,其含有P-C-P集团能够特异性结合到骨重建活跃部位,抑制破骨功能,从而抑制骨吸收。最新Meta分析,纳入7项关于糖尿病风险的研究,其中包括2项随机对照试验(RCTs)的事后分析和5项观察性研究,共纳入1,233,844例受试者,与对照组相比,双膦酸盐(BPs)显著降低糖尿病风险(RR: 0.77; 95%CI 0.65-0.90; p=0.002)[10]。然而,由于研究间异质性高,以及RCT的事后分析与观察性研究之间的发现不一致,需要进一步严格的RCT来确定这些发现是否具有因果关系。
图7 双膦酸盐显著降低糖尿病风险[10]
注:Relative risk:相对风险;Weight:体重
地舒单抗能够抑制核因子-κB受体激活剂配体(RANKL)与其受体RANK结合,抑制破骨细胞生成与功能,从而降低骨吸收,增加骨密度,降低骨折发生风险。2023年,《英国医学杂志》(BMJ)发表的《骨质疏松症患者使用地舒单抗与2型糖尿病发生风险》研究发现在骨质疏松症患者中,相较口服双膦酸盐,地舒单抗组发生2型糖尿病的风险显著降低了32%(HR: 0.68; 95%CI: 0.52-0.89), 且5年随访期间,地舒单抗组发生2型糖尿病的风险均低于口服双膦酸盐组。在骨质疏松症患者中的糖尿病高危人群(糖调节受损及肥胖)中,地舒单抗组可进一步降低2型糖尿病发生风险46%(HR: 0.54; 95%CI: 0.35-0.82)和35%(HR: 0.65; 95%CI: 0.40-1.06),且初始使用地舒单抗治疗可更多的降低2型糖尿病发生风险[11]。
图8 地舒单抗治疗可降低2型糖尿病累积发病率[11]
艾地骨化醇作为新型活性维生素D类似物,无需经肾脏1-α酶羟化,即可发挥生理活性,具有提高骨密度、减少跌倒,降低骨折风险的作用。2022年,《英国医学杂志》(BMJ)发表的一项随机对照试验(DPVD研究),探讨了新型活性维生素D类似物艾地骨化醇在预防2型糖尿病中的作用。研究结果显示,相比对照组,艾地骨化醇显著降低了糖耐量受损患者的糖尿病发病率(HR: 0.69; 95%CI 0.51-0.95; p=0.02),在HOMA-β(HR: 0.35,0.21-0.59; p<0.001)、HOMA-IR(0.37; 0.20-0.67; p=0.001)和空腹IRI(0.41; 0.23-0.71; p=0.001)的最低分级中,艾地骨化醇对基础胰岛素分泌水平较低人群具有潜在获益(HR: 0.41; 95%CI 0.23-0.71; p=0.001)[12]。
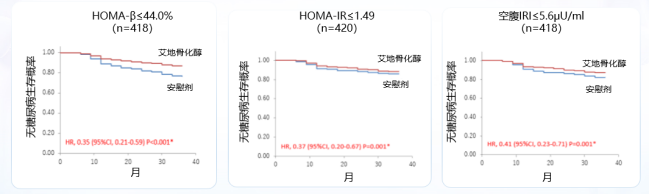
注:HOMA-β:胰岛素抵抗指数β;HOMA-IR:胰岛素抵抗指数IR;空腹IRI:空腹胰岛素
综上所述,糖尿病骨质疏松患者进行药物治疗决策时,需要兼顾糖尿病与骨质疏松的治疗,控制血糖平稳,并降低骨折风险是首要问题。未来需要进一步评估糖尿病药物单用和联合治疗对骨折的影响,积极探索最符合糖尿病患者骨代谢特点的抗骨质疏松治疗方案。
非常感谢您关于糖尿病骨质疏松症基础机制、诊疗研究进展进行地精彩分享,我们了解到近些年临床对于DOP患者认知不断深化,请问您是如何看待这一变化?放眼未来,您认为DOP患者诊疗方面还有哪些可以进一步探索的方向?
余学锋教授:原发性骨质疏松症与糖尿病均常见于老年患者,尽管部分患者是由糖尿病导致的继发性骨质疏松症,部分患者是糖尿病合并骨质疏松症,但对于广大患者和医务工作者而言,应积极开展骨质疏松症临床筛查,早认识、早发现、早治疗对于最大程度地降低其带来的潜在危害具有重要意义。
既往因糖尿病前来就诊的老年女性患者中,常自述全身不适、腰背疼痛及坠胀感等症状,这些症状均可能提示着骨质疏松的存在,老年患者发生骨质疏松后,骨强度下降,容易出现椎间盘突出等一系列问题导致患者的躯体症状。正是由于骨质疏松具有症状非特异性的特点,要求临床医生实际诊疗过程时,应提高警惕性,充分考量骨质疏松的发生可能并鼓励高风险患者开展相应筛查,最大程度地保障患者生命健康。
参考文献:
1.Ding ZC, et al. ANZ J Surg . 2020 Jul;90(7-8):1259-1264.
2.Hofbauer LC, et al. Lancet Diabetes Endocrinol . 2022 Mar;10(3):207-220
3.Sheu A, et al. Trends Endocrinol Metab . 2022 May;33(5):333-344
4.Jeddi S, et al. Biochem Pharmacol . 2022 Mar;197:114888
5.紫梦玮,等. 中国骨质疏松杂志. 2021,27(7):1005-1010.
6.中华医学会骨质疏松和骨矿盐疾病分会 等. 糖尿病患者骨折风险管理中国专家共识 [J] . 中华糖尿病杂志,2019,11 (7): 445-456.
7.Zawada A, et al. Biomedicines . 2022 Sep 5;10(9):2191
8.Dong B, et al. The Extraglycemic Effect of SGLT-2is on Mineral and Bone Metabolism and Bone Fracture. Front Endocrinol (Lausanne). 2022 Jul 7;13:918350.
9.Tseng CH. Metformin use is associated with a lower risk of osteoporosis/vertebral fracture in Taiwanese patients with type 2 diabetes mellitus. Eur J Endocrinol. 2021 Feb;184(2):299-310.
10.Chen PW,et al. Osteoporos Int. 2023 Feb;34(2):387-397.
11.Lyu H,et al. BMJ. 2023 Apr 18;381:e073435.
12.Kawahara T, et al. BMJ. 2022 May 25;377:e066222.
仅供医疗卫生等专业人士阅读
审核编号:EDR-NP-20230710-001
查看更多