查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





在2019年世界肾脏日,由刘志红院士牵头编写的《中国慢性肾脏病矿物质和骨异常诊治指南》正式发布。为此,《中国医学论坛报》邀请刘志红院士团队对该指南进行解读,以帮助肾科同道更好地理解指南要点。
作者:国家肾脏疾病临床医学研究中心 东部战区总医院 谢红浪

▲谢红浪教授
骨质疏松定义
骨质疏松是以单位体积内骨组织量低下、骨微结构破坏,导致骨脆性增加、易发生骨折为特征的全身性骨病。骨质疏松可导致骨骼或关节疼痛、骨折风险增加、病残率和死亡率增加。骨质疏松症可发生于任何年龄,但多见于绝经后女性和老年男性。糖尿病、高血压、动脉粥样硬化等疾病是导致慢性肾脏病(CKD)的常见原因,这些患者也是骨质疏松的高危人群。临床上以骨密度(BMD)作为诊断骨质疏松、预测骨质疏松性骨折风险、监测自然病程以及评价药物干预疗效的最佳定量指标。
骨质疏松是CKD的并发症之一。CKD G1~G3期成年人可采用正常人群骨质疏松症的定义;G3期以后的CKD且BMD低下患者应称为“CKD-MBD伴BMD降低”。
国内一项回顾性研究显示,经双能X线吸收法(DXA)测定BMD,CKD G1~G5期非透析患者中骨质疏松者占24.0%,骨量减少者占43.3%;CKD G1~G5期患者骨质疏松发生率分别为16.5%、34.7%、25%、21.6%、26.8%。美国肾脏病数据系统(USRDS)显示,透析患者髋关节和脊柱骨折发生率从1992年的12.5/1000人-年,上升至2004年的25.3/1000人-年;≥65岁的患者更为严重,分别为22.7/1000人-年和48.4/1000人-年。2004年后该数据有下降趋势。
骨质疏松的诊断和评估
1.生化指标及监测频率
CKD患者每6~12个月应检查血清钙、磷和碱性磷酸酶(ALP);根据甲状旁腺素(iPTH)基线水平和CKD程度决定iPTH的检查间隔时间;有条件时建议检测25(OH)D,并根据基线水平和治疗干预措施决定重复检测的频率。
2.骨密度测量
CKD G1~G2期的患者建议定期测定腰椎及髋关节BMD,以评估是否合并骨质疏松;CKD G3a~G5D期有CKD-MBD证据和骨质疏松高风险患者建议测定BMD,以评估骨折风险。
BMD是指单位体积(体积密度)或是单位面积(面积密度)的骨量。常用的骨密度测定方法包括DXA、外周DXA、定量CT(QCT)、外周QCT和定量超声等。
DXA的测定值是目前公认的诊断骨质疏松症的金标准。推荐的测量部分是中轴骨,包括腰椎和股骨近端,或非优势侧桡骨远端1/3。BMD通常以T值和Z值表示。
T值=(测定值-骨峰值)/正常成人骨密度标准差。
Z值=(测定值-同龄人BMD均值)/同龄人BMD标准差。Z值适用于一些缺少正常参考值的人群,如儿童和CKD患者。Z值>-1表示骨密度值在正常同龄人范围内;Z值≤-2 表示骨密度低于正常同龄人;Z 值是一个相对的数值,其根据同年龄、同性别和同种族分组,将相应检测者的骨密度值与参考值作比较,需要参照 T 值来准确判断(表1)。
表1 DXA测定BMD结果的判定
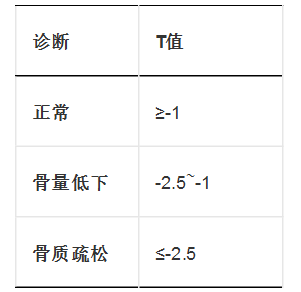
在普通人群中,BMD可预测70%的骨折风险;BMD值每降低一个标准偏差则骨折风险会增加两倍。2012-2015年间的4项前瞻性队列研究提示,通过DXA测定BMD可以预测CKD G3a~G5D期患者骨折风险。T值诊断标准对于CKD患者骨折亦具有重要预测价值。但BMD对CKD骨转化状态不具有指导意义。
3.骨转换标志物
骨转换标志物是骨组织(分解与合成)的代谢产物,分为骨形成标志物和骨吸收标志物,有助于判断骨转换类型、骨丢失速率、骨折风险评估、了解病情进展、干预措施的选择及疗效监测。
骨形成标志物是成骨细胞活动及骨形成时的代谢产物,包括血清ALP、骨钙素、骨特异性ALP、Ⅰ型胶原C端前肽和Ⅰ型胶原N端前肽等。骨吸收标志物是破骨细胞活动及骨吸收时的代谢产物,包括血清抗酒石酸碱性磷酸酶和Ⅰ型胶原交联C末端肽,以及尿液钙/肌酐比值、吡啶啉、脱氧吡啶啉、Ⅰ型胶原交联C端肽、Ⅰ型胶原交联N端肽等。其中血清Ⅰ型胶原N端前肽和Ⅰ型胶原交联C端肽是敏感度相对较好的两个骨转换标志物。
4.骨活检
骨活检是判断骨转化状态的金标准,属有创性检查,极少用于骨质疏松症的诊断。对于CKD G3a~G5D期患者,为了判断其肾性骨病类型以调整治疗方案时,则需行骨活检。CKD、低BMD及骨折高风险患者需要用抗骨吸收药物时,建议行骨活检排除低动力性骨病。
骨质疏松骨折风险预测
建议对CKD患者的骨质疏松骨折风险进行预测,常用的预测方法是亚洲人骨质疏松自我筛查工具(OSTA)和世界卫生组织(WHO)骨折风险预测简易工具(FRAX)。研究表明,FRAX能预测CKD G2~G5期患者骨折的风险,但并不优于BMD的预测价值。
1. 亚洲人骨质疏松自我筛查工具(OSTA)
OSTA指数= [体重(kg)-年龄(岁)]×0.2
表2 OSTA结果判定标准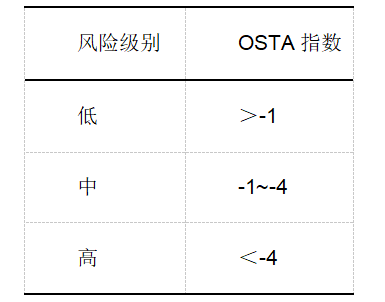
2. WHO骨折风险预测简易工具(FRAX)
根据WHO推荐的FRAX可计算10年发生髋部骨折和任何重要的骨质疏松性骨折发生概率(链接:)。
骨质疏松的基础治疗
1. 均衡膳食:富含钙质、低盐、适当的蛋白质。
2. 合理运动:适当的户外锻炼及增加日照有助于骨质健康及骨折后的康复治疗。
3. 避免嗜烟、酗酒,慎用影响骨代谢药物。
4. 骨折高风险患者要防止跌倒,慎用增加跌倒危险的药物,及时控制容易跌倒的疾病。
5. 加强自身和环境的保护措施(包括使用关节保护器等)。
骨质疏松的治疗时机
具备以下情况之一者,需要考虑药物治疗。
1. 确诊骨质疏松者(T值≤-2.5),无论是否有过骨折。
2. 骨量低下患者(-2.5<T值≤-1.0),并且存在一项以上骨质疏松危险因素,无论是否有过骨折。
3. 未测定BMD,具备以下情况之一者也需要考虑药物治疗:已发生过脆性骨折;OSTA筛查为高风险;FRAX工具计算出髋部骨折概率≥3%,或任何重要部位的骨质疏松性骨折发生概率≥20%。
骨质疏松的药物治疗
双膦酸盐
指征
1. 骨质疏松和(或)高骨折风险的CKD G1~G2期患者,建议参照普通人群;
2. CKD G3~G4期患者,如果出现CKD-MBD的生化指标异常及低BMD和(或)脆性骨折,可根据病情选择是否加用双膦酸盐,同时考虑进行骨活检;
3. CKD G5期患者使用双膦酸盐治疗时需要根据生化指标或骨活检排除低动力骨病。
方案
1. 第一代双膦酸盐:氯屈膦酸盐口服400 mg/d;依替膦酸钠口服 200 mg/次,2次/天。
2. 第二代双膦酸盐:阿仑膦酸钠口服75 mg,1次/周;帕米膦酸二钠口服150 mg/d,或静脉滴注 30~90 mg/d,1次/4周(静脉滴注时间不少于2h)。
3. 第三代双膦酸盐:唑来膦酸钠5 mg,静脉滴注,1次/年,连续用3年;伊班膦酸钠2 mg,静脉滴注,1次/3月;利噻膦酸钠口服5 mg/d或35 mg/周。
注意事项
1. 低动力性骨病是使用双膦酸盐的禁忌证。
2. 双膦酸盐主要经肾排泄,CKD G1~G3 期无需调整剂量;eGFR<30 ml/(min•1.73m2)时,需要适当调整剂量并短期使用; eGFR<35 ml/(min•1.73m2)时不推荐使用唑来膦酸钠;eGFR<15 ml/(min•1.73m2)时,可口服双膦酸盐,优先选择利噻膦酸钠35 mg,隔周1次,时间不超过3年。
3. 服用双膦酸盐后需要多行走,直立30~60 min,避免平躺;严重的不良反应包括下颌骨坏死和肾毒性,建议动态监测血清肌酐和尿蛋白。
钙剂、活性维生素 D 及其类似物
指征
1. 骨质疏松和(或)高骨折风险 CKD G1~G2 期患者,建议参照普通人群。
2. CKD G3a~G3b 期,iPTH在正常值范围时建议参照普通人群。
3. CKD G3a~G5D期患者,如出现CKD-MBD相关生化异常和(或)低BMD和(或)脆性骨折,建议根据生化指标及CKD的进展情况来选择治疗方案,并考虑行骨活检。
方案
1. 钙剂:2014年中国居民膳食营养素参考摄入量建议成人元素钙摄入量为800 mg/d,50岁及以上人群推荐摄入量为1000~1200 mg/d,可使用钙补充剂。
2. 活性维生素D及其类似物:CKD G1~G2 期参照普通人群;CKD G3~G5期iPTH正常、合并低BMD 和(或)高骨折风险的非透析患者,活性维生素D的推荐剂量为0.25~0.5 μg/d;CKD G3~G5 期且未接受透析合并低BMD和(或)骨折风险高的患者,如果iPTH进行性升高且持续高于正常值上限,建议使用活性维生素D及其类似物,从最小的起始剂量间歇或持续给药,维持iPTH在目标范围;对于CKD G5D期伴低BMD和(或)骨折风险高的患者,建议活性维生素D及其类似物从小剂量开始使用,iPTH超过目标值上限并持续上升者,可间断使用较大剂量活性维生素D及其类似物,期间应增加血钙和血磷监测频率。
注意事项
1. 钙剂、活性维生素D及其类似物治疗骨质疏松时,应避免发生高钙血症,避免因此而增加患者死亡风险。
2. 过度使用活性维生素D及其类似物可过度抑制iPTH ,可能导致低转化骨病的发生。
3. 骨质疏松治疗过程中,需要严密监测血钙、磷、iPTH及钙磷乘积水平;高磷血症时,首先应积极降磷,活性维生素D及其类似物应减量或停药;若发生高钙血症,建议活性维生素D及其类似物减量或停药;若iPTH水平低于正常值上限的2倍,建议活性维生素D及其类似物减量或停药;CKD G5D期患者口服活性维生素D及其类似物时,应在夜间睡眠前肠道钙负荷最低时给药。
其他药物
降钙素
适用于以下情况。
1. 其他药物治疗无效的骨质疏松症患者,如高转化骨质疏松、皮质激素治疗相关的骨质疏松,建议在个体化适量补充钙和维生素D的基础上,加用降钙素。
2. 骨质溶解或骨质减少引起的骨痛。
3. 伴严重高钙血症CKD患者:CKD G3~G5期患者如果出现CKD-MBD的生化指标异常,不建议常规使用降钙素;如确需使用时,建议用药前行骨活检。小样本研究证实,维持性透析患者使用降钙素可增加腰椎和股骨颈BMD,降低iPTH且不增加血钙浓度。
重组人甲状旁腺激素(rhPTH)
适用于以下情况。
1. 骨折风险高的绝经后骨质疏松妇女,男性原发性或性功能减退性骨质疏松症,糖皮质激素诱导性骨质疏松症,尤其是抗骨吸收药物治疗无效者。
2. 维持性透析患者,如果存在明显甲状旁腺功能低下,合并低动力骨病所致骨质疏松,也可以考虑使用该药;用药期间需要严密监测血钙,防止高钙血症。甲状旁腺功能亢进者禁用rhPTH。
雌激素类药物
适用于CKD G1~G2期合并性激素减少相关女性骨质疏松患者。常用药物剂量为:结合雌激素0.625 mg/d,炔雌醇10~25 μg/d,戊酸雌二醇和微粒化雌二醇1~2 mg/d。建议从最小剂量开始,避免突然停药。CKD G3~G5期(含透析)的中-重度肾功能不全患者,应慎用雌激素类药物治疗。补充雌激素会导致乳腺癌、心血管疾病和卒中风险增加,尤其是60岁以上的女性,骨折风险的降低不能抵消这些副作用,使用时需要个体化,并严格掌握适应证。
雌激素受体调节剂
对于CKD G1~G2期患者,明确的绝经后骨质疏松女性可使用雌激素受体调节剂;CKD G3~G5D期绝经后女性患者,若在iPTH控制良好时仍有严重骨质疏松或骨折,可考虑使用。常用药物:雷洛昔芬60 mg/d口服,苯卓昔芬20 mg/d口服。需要注意的是,药物可能会引起明显的潮热症状及下肢痉挛,潮热症状严重的围绝经期的妇女暂不宜用。
地诺单抗(denosumab)
核因子κB配体受体激活剂(RANKL)是破骨细胞存活和分化的重要信号分子。地诺单抗是一种特异性靶向RANKL的完全人源化单克隆抗体(IgG2单抗),分子量约为147 kDa,能够阻止RANKL和其受体物质结合,抑制破骨细胞活化和分化,减少骨吸收,增加BMD。该药经网状内皮系统清除。给药方法为:60 mg,在上臂、上大腿或腹部皮下注射,每6个月1次,不需要根据肾损伤程度调整剂量。同时应注意补充钙剂和维生素D。一项在不同CKD分期(不包括透析)患者进行的地诺单抗治疗骨质疏松的安慰剂对照研究,治疗6个月,随访36个月,发现该药能够明显改善BMD,降低骨折发生风险,疗效和副作用与CKD分期无关。在透析人群的研究结果表明,地诺单抗治疗能够减少骨丢失,联合使用骨化醇后,还能够降低血磷及iPTH,但需要密切监测血钙,防止低钙血症。地诺单抗也是抗骨吸收药物,用药前应确定患者不存在低动力骨病。
小结
骨质疏松是CKD人群常见且容易被忽视的一种并发症,导致骨折风险增加,影响患者的生存质量和远期预后。CKD患者应遵循健康生活方式,强调早期对骨质疏松骨折风险进行预测,定期监测生化指标、骨密度、骨转化标志物等指标,必要时行骨活检,适时进行药物干预。
本文来自中国医学论坛报,未经授权,请勿转载。
查看更多