查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





近日,以“让癌症有所医·可能治愈”为主题的2022 CSCO默沙东卫星会隆重举行。本次会议特别邀请中国医学科学院肿瘤医院吴令英教授和王洁教授共同担任大会主席。国内多位肿瘤领域的知名专家分享了肺癌、卵巢癌、肝癌、前列腺癌等领域的前沿进展,并围绕精准医学时代靶向治疗和免疫治疗为肿瘤患者带来的长生存获益展开深度探讨。

图1. 会议现场
大会主席吴令英教授在致辞中表示,肿瘤治疗的发展历经了几个世纪的探索,正如会议主题所言,“让癌症有所医,可能治愈”是临床工作者永恒的追求。回顾近几十年肿瘤治疗的变革,靶向治疗和免疫治疗是两个重要的里程碑。这些治疗模式和新药研发的进步,改变了诸多瘤种的治疗格局,期待未来能为更多患者带来更长生存获益。

图2. 中国医学科学院肿瘤医院吴令英教授
第一篇章 免疫治疗
精准免疫治疗,PD-1抑制剂使命必达
北京大学第一医院程渊教授讲述了免疫治疗时代晚期非小细胞肺癌(NSCLC)的长生存之路。与传统治疗相比,免疫治疗的最大优势在于具有独特的“长拖尾”效应,能够给患者带来长期获益。根据这一特征,总生存期(OS)成为免疫治疗疗效评估的金标准。在中位OS、HR和OS率这三个评价OS获益的指标中,长期OS率更直观反映长期获益的患者比例,因此更适合用于免疫治疗的生存获益评估。而5年OS率是抗肿瘤疗效评价的重要节点,被视为晚期肿瘤的治疗目标,也被认为是评估免疫治疗疗效的重要OS里程碑。

图3. 北京大学第一医院程渊教授
在NSCLC免疫治疗领域,PD-1抑制剂帕博利珠单抗可谓是“一骑绝尘”。KEYNOTE-024是首个报道晚期NSCLC一线免疫治疗5年疗效的Ⅲ期研究,显示帕博利珠单抗一线单药治疗PD-L1≥50%的患者,5年OS率仍较化疗提升近一倍(31.9% vs 16.3%)[1];
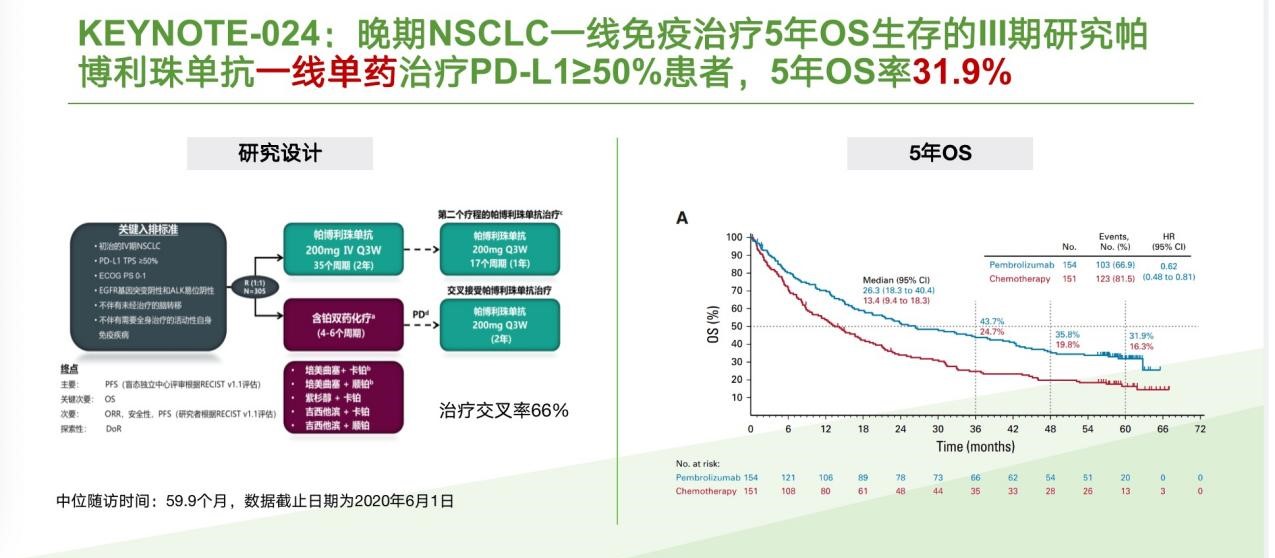
图4. KEYNOTE-024 研究5年OS数据
首个以OS为主要终点的免疫检查点抑制剂单药一线治疗晚期NSCLC的Ⅲ期研究KEYNOTE-042长期随访结果显示,帕博利珠单抗一线单药治疗PD-L1≥1%的患者,5年OS率达到16.6%[2]。

图5. KEYNOTE-042 研究5年OS数据
KEYNOTE-042中国人群随访数据显示,帕博利珠单抗组4年OS率达到21.3%[3]。
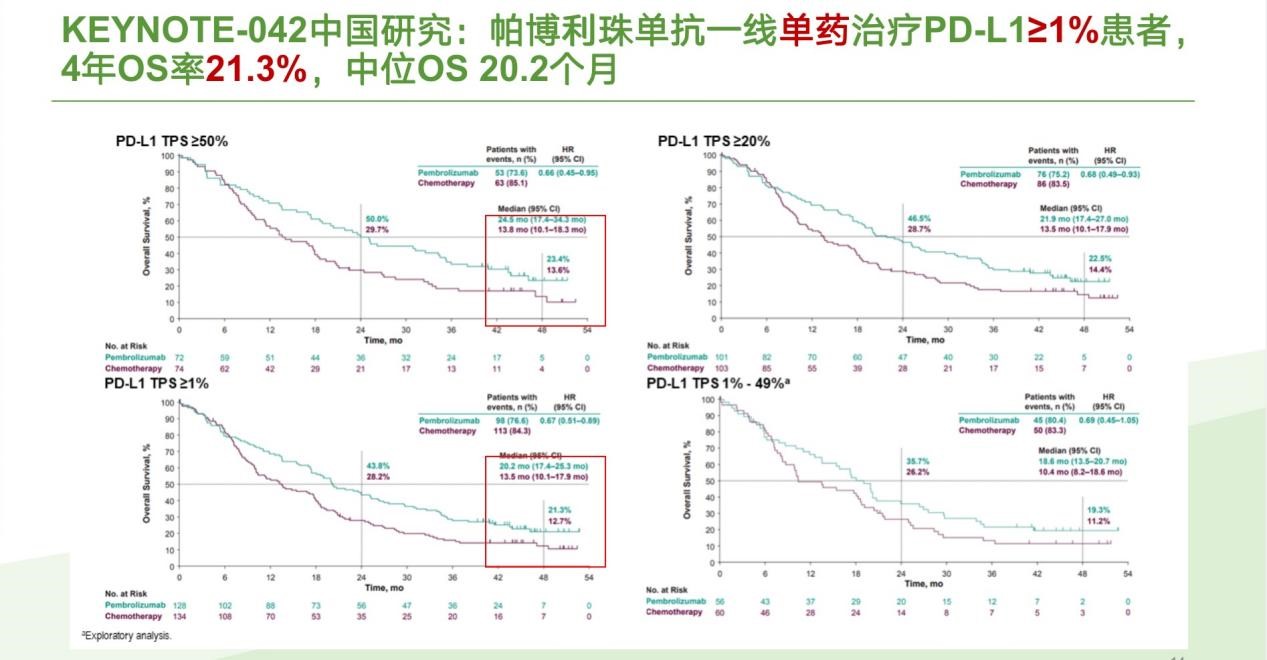
图6. KEYNOTE-042 中国人群5年OS数据
KEYNOTE-189研究首次在Ⅲ期临床研究中证实了免疫检查点抑制剂联合含铂化疗一线治疗晚期非鳞NSCLC的OS获益,5年随访数据表明,帕博利珠单抗联合含铂化疗一线治疗晚期非鳞NSCLC的5年OS率达到19.4%,而化疗为11.3%[4]。

图7. KEYNOTE-189 研究5年OS数据
KEYNOTE-407则首次在Ⅲ期临床研究中证实了免疫检查点抑制剂联合含铂化疗一线治疗晚期鳞状NSCLC的OS获益,5年随访结果显示,帕博利珠单抗联合含铂化疗一线治疗晚期鳞状NSCLC的5年OS率为18.4%,而化疗为9.7%[5]。
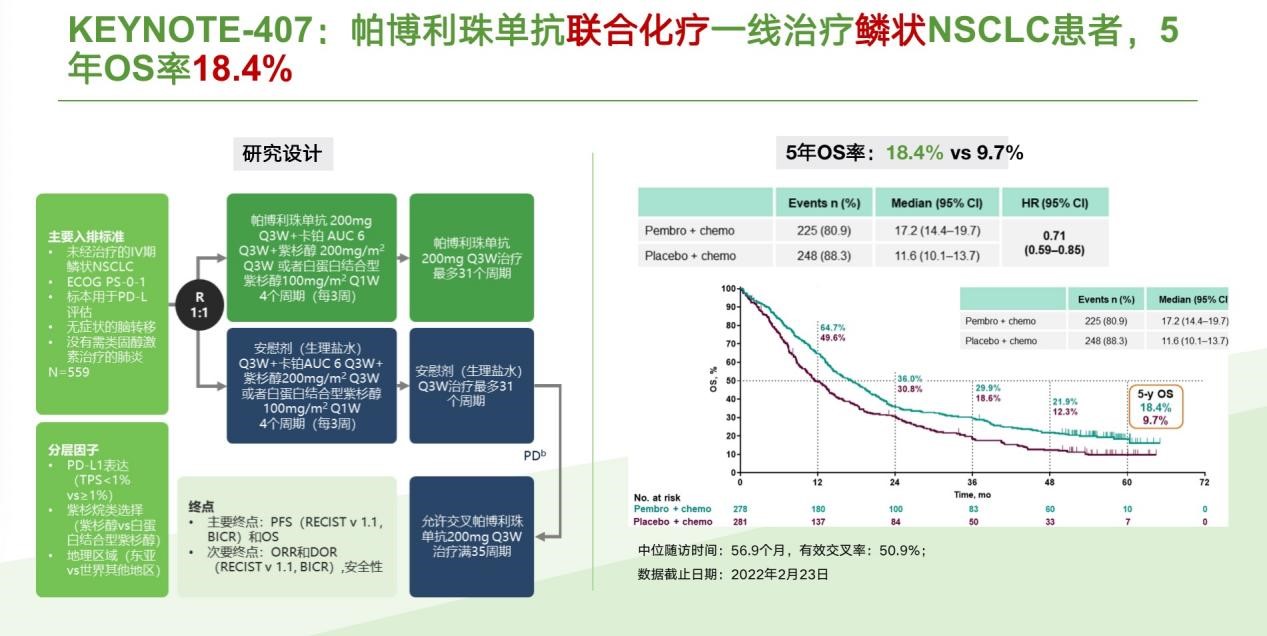
图8. KEYNOTE-407 研究5年OS数据
在头颈部癌免疫治疗上,帕博利珠单抗也拔得头筹。KEYNOTE-048研究是头颈部鳞癌(HNSCC)领域具有里程碑意义的临床研究,基于该研究结果,帕博利珠单抗于2020年在国内获得了复发/转移性HNSCC患者一线治疗适应证。随访69.2个月的OS数据显示,帕博利珠单抗单药一线治疗PD-L1 CPS≥20人群、PD-L1 CPS≥1人群、整体人群的5年OS率分别为19.9%,15.4%和14.4%,优于靶向联合化疗方案的7.4%,5.5%和6.5%。帕博利珠单抗联合化疗一线治疗上述不同人群的5年OS率也分别达到23.9%(对照组6.4%),18.2%(对照组4.3%)和16.0%(对照组5.2%)[6]。
在消化道肿瘤领域,帕博利珠单抗同样展现了非凡实力。KEYNOTE-177研究结果显示,帕博利珠单抗单药一线治疗微卫星高度不稳定/错配修复缺陷(MSI-H/dMMR)转移性结直肠癌(CRC)患者的3年OS率达到61%,较化疗组提升了11%[7];KEYNOTE-590研究2年生存结果显示,帕博利珠单抗联合化疗一线治疗晚期食管癌的2年OS率为26.3%,而化疗组为16.1%[8]。
在免疫治疗讨论环节,与会专家和报告专家一起就帕博利珠单抗为肿瘤患者带来的长生存获益进行了深入交流。专家们表示,让肿瘤患者取得长生存才是硬道理,长期生存率已经成为评估肿瘤治疗疗效最重要的指标,尤其是对于具有“长拖尾”效应的免疫治疗。帕博利珠单抗作为最早在Ⅲ期研究中证实免疫单药或联合化疗一线治疗能够给EGFR/ALK野生型晚期NSCLC带来OS获益的免疫检查点抑制剂,也最早拥有了5年OS率数据,而这些数据表明免疫治疗能够给驱动基因阴性晚期NSCLC患者带来更长生存,无论是鳞癌还是非鳞癌。并且免疫单药的长生存获益让“去化疗”成为可能。在头颈部癌上亦是如此,免疫单药和免疫联合化疗都取得了非常好的5年OS率数据。在精准免疫治疗方面,KEYNOTE-177研究根据MSI/MMR状态精准选择人群,开启了CRC精准免疫治疗模式。未来将探索更多的生物标志物,来指导肿瘤的精准免疫治疗。
第二篇章 靶向治疗
DDR精准诊疗,PARP抑制剂卓领长存
天津医科大学附属第二医院王海涛教授介绍了多聚腺苷二磷酸核糖聚合酶(PARP)抑制剂奥拉帕利治疗卵巢癌和前列腺癌研究进展。DNA损伤应答(DDR)和修复功能异常是癌症发生的重要机制之一,同源重组修复(HRR)通路最关键的基因BRCA1/2胚系突变使女性卵巢癌风险提高10-30倍。PARP酶和HRR基因分别参与DNA的单链和双链损伤修复,确保基因组的稳定性,HRR通路涉及的蛋白缺陷会诱导对PARP抑制剂的敏感性。PARP抑制剂靶向抑制和捕获DNA损伤修复酶PARP,通过合成致死作用导致肿瘤细胞死亡。

图9. 天津医科大学附属第二医院王海涛教授
SOLO-1研究结果表明,奥拉帕利降低一线BRCA突变晚期卵巢癌患者死亡风险67%,中位无进展生存期(PFS)延长42.2个月[9]。7年随访数据显示,中位OS未达到,7年OS率高达67%[10]。

图10. SOLO-1研究结果
在联合治疗方面,PAOLA-1研究显示,与安慰剂联合贝伐珠单抗相比,奥拉帕利联合贝伐珠单抗一线维持治疗同源重组修复缺陷(HRD)阳性晚期卵巢癌患者的中位PFS达到46.8个月,5年OS率达到65.5%[11]。基于PAOLA-1研究结果,2022年9月,奥拉帕利在中国获批与贝伐珠单抗联合用于HRD阳性晚期卵巢癌一线维持治疗。

图11. PAOLA-1研究结果
PROfound研究评估了奥拉帕利对比恩扎卢胺或阿比特龙用于携带HRR基因突变、既往经二代抗雄药物治疗进展的转移性去势抵抗性前列腺癌(mCRPC)患者的疗效,亚洲人群结果显示,对于BRCA突变患者,奥拉帕利治疗的中位OS达到26.81个月,较对照组延长12.55个月;rPFS达到9.33个月,较对照组延长5.85个月[12]。
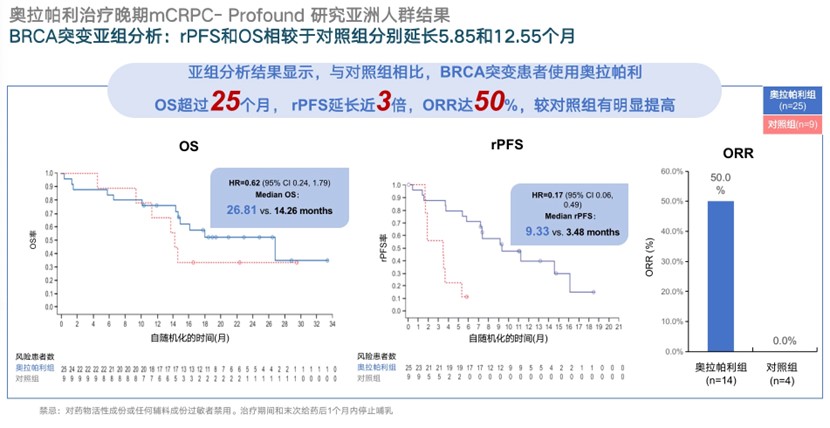
图12. PROfound研究亚洲人群结果
仑伐替尼高效缩瘤,肝癌外科转化治疗基石之选
北京大学肿瘤医院郝纯毅教授分享了肝癌系统治疗研究进展。自20世纪60年代以来,我国肝癌治疗在外科治疗、介入治疗以及系统治疗方面均发展迅速,同时新技术及理念出现为肝癌患者带来了更多生存获益。转化治疗指针对初始不可切除的肝癌,通过系统治疗或局部治疗手段,转化为可手术切除肿瘤,实现肿瘤的R0切除,使患者获得更长生存。

图13. 北京大学肿瘤医院郝纯毅教授
在选择系统抗肿瘤药物作为转化治疗方案时,应考虑三大要素,即较高抗肿瘤活性、较快起效时间和较低肿瘤进展率。目前肝癌系统治疗药物主要包括小分子靶向药物、抗血管生成药物和免疫检查点抑制剂,在靶向药物中,仑伐替尼较索拉非尼具有更高的客观缓解率(ORR)[13],即抗肿瘤活性更高。其与免疫检查点抑制剂联用,有望取得更好地转化治疗效果。
在靶向治疗讨论环节,专家们就PARP抑制剂对肿瘤治疗格局的影响及为患者“长生存”带来的突破进行了热烈讨论。他们指出,卵巢癌是死亡率最高的妇科恶性肿瘤,即使经过手术联合化疗的初始治疗,但仍有70%的患者在3年内复发,5年生存率不足50%。现在妇科肿瘤已进入精准医疗的新时代,以PARP抑制剂为代表的精准治疗药物研究在妇科肿瘤,尤其在卵巢癌中,取得了突破性的进展。手术联合化疗后的维持治疗也变得尤为重要。奥拉帕利作为唯一一个在维持治疗有OS数据的PARP抑制剂,一直给人们带来数据上的惊喜。今年ESMO最新公布的5年OS率65.5%和7年OS率67%也非常的鼓舞人心。奥拉帕利最新获批的PAOLA-1适应证也将受益患者人群从BRCA阳性扩大到了HRD阳性,这也意味着有更多的患者可以通过PARP抑制剂中得到生存获益。希望有更多的卵巢癌患者可以通过手术、化疗、维持治疗等一系列的治疗手段,获得长生存的机会,也期待在后续的大会报道上可以看到更多数据上的惊喜。
第三篇章 让癌症有所医、可能治愈
默沙东是全球医疗行业的领先者,一百多年来,默沙东始终致力于为攻克癌症等全球最为棘手的疾病带来创新的药品和疫苗。作为肿瘤领域领导者,默沙东正全力为患者开创一个癌症有所医、可能治愈的时代。
默沙东在肿瘤领域已拥有数个重磅药物,并在中国获得了多项适应证。截至目前,帕博利珠单抗已在国内获批10个适应证,涵盖7个癌症种类;奥拉帕利已在国内获批乳腺癌、卵巢癌和前列腺癌适应证;仑伐替尼已在国内获批放射性碘难治性分化型甲状腺和肝癌适应证。
在传统化疗和支持治疗领域,默沙东也未停下探索脚步。替莫唑胺是默沙东研发的一种新型口服抗肿瘤药物,作为目前神经胶质瘤的一线化疗药物,已经造福了无数患者。另外默沙东还研发了全球第一个高选择性NK-1受体拮抗剂阿瑞匹坦,能够有效预防化疗导致的恶心呕吐,从而提高患者生活质量。
目前默沙东在中国正在开展的近70个肿瘤领域临床研究项目覆盖20个癌症种类,涉及肺癌、乳腺癌以及消化道肿瘤等中国高发癌种,有望支持其在中国获批更多适应证的步伐加快,造福更多中国患者及大众,助力建设健康中国。
总结
大会在热烈的学术讨论氛围中落下帷幕,大会主席王洁教授表示,“以帕博利珠单抗、奥拉帕利等为代表的多瘤种药物,引领了相关治疗领域的不断突破,为临床工作和肿瘤患者带来更多生的希望。”
默沙东始终秉承患者为先的理念,致力于为患者带来更多癌症治疗方案、更好生活质量和更长生存时间,在卵巢癌、前列腺癌、肝癌、肺癌等多个肿瘤领域取得了卓越成就。2022年11月9日,帕博利珠单抗在华获批三阴性乳腺癌治疗新适应证,是首个在全球获批的三阴性乳腺癌治疗的免疫检查点抑制剂。一个月前,10月10日,帕博利珠单抗在华获批肝癌治疗新适应证,带来晚期肝癌高质量长生存可能。“让癌症有所医·可能治愈”,默沙东将继续探索肿瘤治疗的未来边界,寻找下一个治疗突破,为广大癌症患者带来更多生存希望。
参考文献:
[1] Reck M, Rodríguez-Abreu D, Robinson AG, et al. Five-Year Outcomes With Pembrolizumab Versus Chemotherapy for Metastatic Non-Small-Cell Lung Cancer With PD-L1 Tumor Proportion Score ≥50[J].J Clin Oncol. 2021;39(21):2339-2349.
[2] Castro Jr G,et al. 2021 SITC.
[3] Yi-Long Wu, Yun Fan, JianYing Zhou, et al. Pembrolizumab vs chemotherapy in Chinese patients with PD-L1-positive NSCLC: 4-year update from KEYNOTE-042 China study. AACR 2022 CT555.
[4] M.C. Garassino, et al.KEYNOTE-189 5-year update: First-line pembrolizumab (pembro) + pemetrexed (pem) and platinum vs placebo (pbo) + pem and platinum for metastatic nonsquamous NSCLC, 2022 ESMO, Abs #973MO.
[5] S. Novello, et al.5-year update from KEYNOTE-407: Pembrolizumab plus chemotherapy in squamous non-small cell lung cancer (NSCLC), 2022 ESMO,Abs # 974MO.
[6] M. Tahara, et al. Pembrolizumab with or without chemotherapy for first-line treatment of recurrent/metastatic (R/M) head and neck squamous cell carcinoma (HNSCC): 5-year results from KEYNOTE-048 2022 ESMO, Abs #659MO.
[7] Thierry Andre, et al. Final overall survival for the phase III KN177 study: Pembrolizumab versus chemotherapy in microsatellite instability-high/mismatch repair deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC). 2021 ASCO Abstract 3500.
[8] Jean-Philippe Metges, et al. First-line pembrolizumab plus chemotherapy versus chemotherapy in advanced esophageal cancer: Longer-term efficacy, safety, and quality-of-life results from the phase 3 KEYNOTE-590 study.2022 ASCO GI.
[9] Banerjee S, Moore KN, Colombo N, et al. Maintenance olaparib for patients with newly diagnosed advanced ovarian cancer and a BRCA mutation (SOLO1/GOG 3004): 5-year follow-up of a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2021;22(12):1721-1731.
[10] DiSilvestro P, Banerjee S, Colombo N, et al. Overall Survival With Maintenance Olaparib at a 7-Year Follow-Up in Patients With Newly Diagnosed Advanced Ovarian Cancer and a BRCA Mutation: The SOLO1/GOG 3004 Trial. J Clin Oncol. 2022 Sep 9:JCO2201549. doi: 10.1200/JCO.22.01549. Epub ahead of print.
[11] Ray-Coquard IL, Leary A, Pignata S, et al. Final overall survival (OS) results from the phase III PAOLA- 1/ENGOT-ov25 trial evaluating maintenance olaparib (ola) plus bevacizumab (bev) in patients (pts) with newly diagnosed advanced ovarian cancer (AOC). Ann Oncol. 2022;33(suppl 7):LBA29.
[12] Matsubara N, Nishimura K, Kawakami S, et al. Olaparib in patients with mCRPC with homologous recombination repair gene alterations: PROfound Asian subset analysis. Jpn J Clin Oncol. 2022;52(5):441-448.
[13] Kudo M, Finn RS, Qin S, et al. Lenvatinib versus sorafenib in first‐line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non- inferiority trial[J]. Lancet, 2018, 391(10126): 1163‐1173.
查看更多