查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:首都医科大学附属北京佑安医院肝病消化中心 丁惠国
腹水是失代偿期肝硬化患者最常见的并发症,也是慢性肝病进展的重要标志。一旦出现腹水,1年病死率约15%,5年病死率约44%。特别是晚期肝硬化大量腹水患者,如果表现为顽固性腹水或发生急性肾损伤-肝肾综合征(AKI-HRS),1年病死率高达80%以上,预后更差。因此,肝硬化顽固性腹水及AKI-HRS的诊治一直是临床研究的难点和热点。近年来国内外指南(后附指南原文)及最新文献报告显示,收缩血管活性药物在肝硬化顽固性腹水治疗中具有较重要的价值。
收缩血管活性药物的作用机制
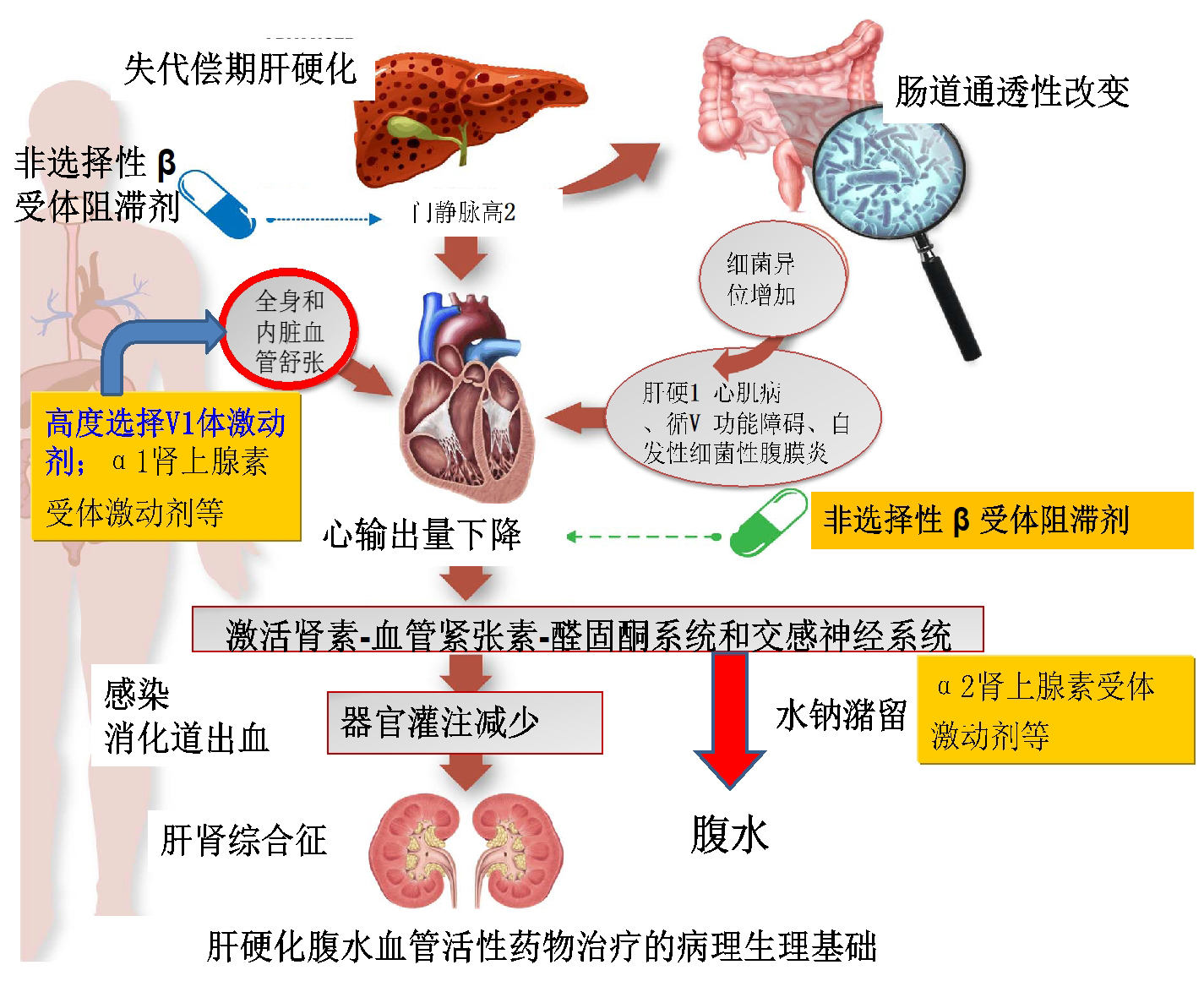
肝硬化腹水的形成机制包括传统的“泛溢学说”、“灌注不足学说”以及最新的“周围血管扩张学说和水钠代谢紊乱学说”。当慢性肝病进展到肝硬化阶段时,肝窦内皮细胞的功能异常导致局部血管扩张因子(如NO)减少,而内脏及外周循环NO显著增加,引起肝窦阻力增加、内脏循环血管扩张,有效循环血容量相对不足,激活肾素-血管紧张素-醛固酮系统(RAAS),导致水钠储溜,形成高动力循环状态,这是肝硬化腹水形成的病理生理基础。中晚期肝硬化患者,随着肝脏损伤进一步加重,导致内脏及外周血管显著扩张,过度激活RAAS及血管加压素水平显著增加,是肝硬化顽固性腹水主要的发生机制。因此,收缩血管活性药物治疗肝硬化顽固性腹水主要作用靶点是抑制内脏及外周血管扩张、高动力循环状态及RAAS的激活(图1)。
收缩血管活性药物的类型
利尿药物仍是治疗肝硬化顽固性腹水的主要方法,常用的利尿药物种类包括:醛固酮拮抗剂、袢利尿剂及高度选择性血管加压素V2受体拮抗剂等。近年来国内外指南推荐及最新文献报道,收缩血管活性药物在肝硬化顽固性腹水治疗中具有较好的效果,血管活性药物主要包括以下类型:
选择性血管加压素V1受体激动剂
代表性药物为特利加压素。特利加压素是一种人工合成的血管加压素缓释剂,由于其半衰期长,故不需要持续静脉给药。来自欧洲的一项多中心研究利用特利加压素(4 mg/d)治疗肾功能正常、应用大剂量利尿剂(螺内酯400 mg/d联合呋塞米160 mg/d)治疗无效的肝硬化顽固性腹水患者,结果发现67.5%的患者仍有应答反应,其中约35%患者腹水减少至少2级。多数临床研究也发现,伴AKI-HRS的肝硬化顽固性腹水患者,40%~50%患者对特利加压素有显著的应答反应。最近一项随机对照研究发现,特利加压素(4~8 mg/d)联合白蛋白(20~40 g/d)与单独应用白蛋白比较,前者可显著改善肝硬化顽固性腹水患者肾功能,全身炎症反应明显改善,Ⅰ型肝肾综合征逆转率达27%。但是,可能仍有50%肝硬化顽固性腹水患者对特利加压素无应答反应。
对于肝硬化顽固性腹水患者,大量放腹水后如何预防急性肾损伤仍是临床关注的重点。一项随机对照研究比较了特利加压素(6-12 mg/d)和人血白蛋白1 g/(kg·d)预防大量放腹水后循环功能障碍(PICD)的效果,发现特利加压素联合人血白蛋白可以有效预防PICD。
因此,2015年ICA、2017年中国及2018年EASL肝硬化腹水诊治相关指均推荐,特利加压素可用于治疗肝硬化顽固性腹水伴或不伴AKI患者,用法如下。
特利加压素1-2 mg/次,q12h静脉缓慢推注(至少15分钟)或持续静脉点滴,有治疗应答反应则持续应用5-7天停药;如果无反应,1-2 mg/次,q6h 静脉缓慢推注或持续静脉点滴,有反应则持续应用3-5天停药。停药后病情反复,可再重复同样剂量。如果重复剂量仍无反应,可增加剂量,最大剂量12 mg/天。
药物主要不良反应为腹部绞痛、大便次数增多及心脏和外周血管缺血表现,如头痛、心律失常,心绞痛、心肌梗死。由于具有高活性的血管加压素浓度低,故其不良反应少而轻,且与剂量及静脉点滴速度有关。
α-肾上腺素能受体激动剂
① 去甲肾上腺素,临床也称“正肾上腺素”,去甲肾上腺素主要激动α1受体,同时也激动β1受体。引起内脏及外周显著的血管收缩,心肌收缩力增强。
Israelsen M等纳入了10项随机临床试验的荟萃分析发现,特利加压素与其他血管活性药物(去甲肾上腺素、奥曲肽、米多君和奥曲肽或多巴胺)相比,在死亡率方面与其他血管活性药物的效果相似(RR 0.92);特利加压素治疗1型肝肾综合征是获益的,但增加了腹泻或腹痛或两者的风险。另一项荟萃分析发现,在HRS逆转(RR 0.97)、30天死亡率(RR 0.89)和HRS复发率(RR0.72)方面,去甲肾上腺素和特利加压素无显著性差异,去甲肾上腺素的不良事件较少见,较特利加压素便宜。因此认为,去甲肾上腺素似乎是特利加压素治疗HRS的有吸引力的替代品,并且与较少的不良事件相关。
2015年ICA和2018年EASL指南均推荐,去甲肾上腺素用于治疗肝硬化顽固性腹水伴或不伴AKI患者。
ICA推荐用法:起始剂量静脉输注0.1 μg/(kg·min),若平均动脉压没有升高10 mmHg,每4 h增加剂量0.05 μg/(kg·min),最大不超过0.7ug/(kg·min)。
EASL推荐用法:HRSⅠ型患,0.5~3.0 mg/h连续输注,目的是增加动脉压和改善肾功能。但研究结果均基于小样本量研究,来自中国临床医生的证据少。
② 盐酸米多君,为α1受体激动剂,对β受体无作用。常用于肝硬化伴低血压的管理,也用于AKI-RHS和顽固性腹水患者。
在一项顽固性或复发性腹水患者的随机试验中,口服米多君剂量为7.5 mg/次,每日三次,能显著增加尿量、平均动脉压和生存率。 因此,在利尿剂基础上,米多君通过增加动脉压将难治性腹水转化为利尿敏感性腹水。米多君联合奥曲肽在防治肝硬化大量放腹水后PICD与人血白蛋白的效果相似,但米多君成本低,且口服给药方便,对非氮质血症肝硬化患者张力性腹水有较好效果。
2012年AASLD、2015年ICA、2018年EASL指南推荐,米多君联合奥曲肽治疗肝硬化顽固性腹水伴或不伴AKI患者。
ICA推荐用法:奥曲肽起始剂量皮下注射100 μg,每日3次,最大600 μg/日;米多君起始剂量7.5 mg,每日3次,最大45 mg/日。
EASL 推荐用法:HRSⅠ型患者,米多君起始剂量2.5-75 mg/8h和奥曲肽100 μg/8h,如果肾功能没有改善,分别增加米多君12.5 mg/8h和奥曲200 μg/8h静脉输注。
AASLD推荐用法:米多君口服7.5-12.5 mg,3次/d,MAP在基线水平上增加15 mmHg;奥曲肽皮下注射100-200 μg,每日3次,或25μg/h静脉输注。国内缺乏盐酸米多君联合奥曲肽应用的经验及数据。
③ 可乐定,为α2a受体激动剂。
可乐定刺激脑干α2-肾上腺受体,导致交感神经系统肾上腺素能递质传出减少,从而降低外周血管、肾血管阻力及心率,血压降低。可乐定起效较快,口服给药后30~60分钟内起效,早期血压升高,然后具有降压作用,在2~4小时内降低到最大值。但是,肾血流量和肾小球滤过率保持不变。可乐定联合螺内酯,通过降低交感系统活性、肾素-醛固酮水平引起腹水的快速消退。国内外相关指南均未推荐。
非选择性β受体拮抗剂
常用药物为普萘洛尔,卡维地洛是一种新的β受体阻滞剂。Sinagra E等比较卡维地络与普萘洛尔血液动力学应答研究(HVPG较基线下降≥20%或 ≤12 mmHg定义为血液动力学应答)的荟萃分析(5个研究,175例患者)显示,从长期血液动力学应答看,卡维地络优于普萘洛尔,二者的不良反应无显著性差异。Hobolth L研究发现卡维地络与普萘洛尔对心脏、内脏(包括HVPG)及全身血液动力学(包括氧饱和度)无显著性差异。
值得注意的是,近年来研究发现,非选择性β受体阻滞剂可增加Child-Pugh C级患者的病死率。也有研究提示,肝硬化腹水患者合并SBP、动脉收缩压低于90 mmHg、血清钠低于130 mmol/L或肾功能障碍时, 非选择性β受体阻滞剂可增加肾损伤及死亡的风险。因此,准确认识肝硬化腹水非选择性β受体阻滞剂临床应用的“窗口期”。卡维地络国内应用经验较与证据少,长期效果及安全性仍需要进一步研究
血管活性药物禁忌症以及治疗应答反应指标
血管活性药物的绝对禁忌证为孕妇及未控制的高血压,相对禁忌证包括缺血性心血管疾病等。
对于肝硬化腹水患者,无论应用何种血管活性药物,其治疗应答反应指标为:① 完全应答,72小时内血肌酐(Scr)降低至基线值0.3 mg/dl(26.5 μmol/L)以下或较用药前下降50%以上,尿量显著增加,大于1000 ml/d;② 部分应答,72小时内 AKI分期下降及Scr降低至≥基线值0.3 mg/dl或较用药前下降>25%,尿量增加大于500-1000 ml/d;③ 无应答,AKI无恢复,尿量无显著性变化。
肝硬化腹水应用扩张血管活性药物的误区
传统观点认为,肝硬化顽固性腹水或KI-HRS是由于肾动脉收缩导致水钠潴留、尿少,试图通过扩张肾血管、增加肾血流治疗肝硬化顽固性腹水或AKI-HRS。因此,临床曾尝试应用的常用扩张肾血管作用药物,包括多巴胺、α1受体拮抗剂酚妥拉明等。
多巴胺受体其效应为剂量依赖性,小剂量多巴胺[0.5-2 μg/(㎏·min)],主要作用于多巴胺受体,使肾及肠系膜血管扩张,肾血流量及肾小球滤过率增加,尿量及钠排泄量增加;小到中等剂量[2-10 μg/(㎏·min)],多巴胺直接激动心脏β1受体及间接促使去甲肾上腺素释放,心肌收缩力及心搏量增加,收缩压升高,外周血管阻力常无改变;大剂量时[>10 μg/(㎏·min)],激动α受体,导致周围血管阻力增加,肾血管收缩,尿量反而减少。无论何种剂量,国内外指南均没有推荐多巴胺治疗肝硬化顽固性腹水或AKI-RHS。
酚妥拉明是短效的非选择性α受体(α1、α2)阻滞剂,拮抗肾上腺素和去甲肾上腺素的作用,使血管扩张而降低周围血管阻力。迄今,没有证据显示酚妥拉明治疗肝硬化腹水有效。
从肝硬化腹水形成机制看,多巴胺、酚妥拉明及其他扩血管药物,如硝酸酯类、血管紧张素转化酶抑制剂(ACEI)和血管紧张素受体阻断剂,可能对肝硬化患者急性肾损伤存在不利影响,且也没有临床研究的数据。因此,目前临床“淘汰”了应用扩张血管活性药物治疗肝硬化腹水。
未来的趋势
肝硬化腹水出现较为迅速,有明显诱因(如胃肠道出血)的患者预后较好;腹水伴肝功能衰竭、出现黄疸及肝性脑病的患者预后差。肝硬化腹水伴AKI-HRS,少尿或氮质血症,3月内病死率为50%~70%。因此,对于肝硬化腹水临床分层管理非常重要。
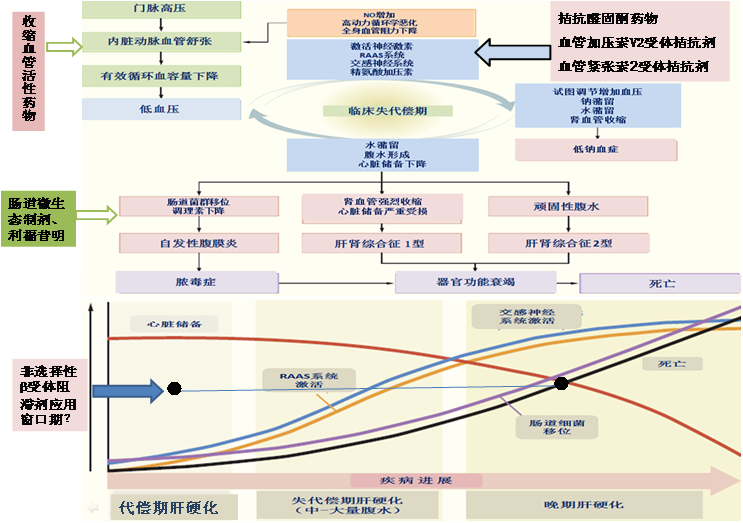
目前,收缩血管活性药物,如特利加压素、米多君联合奥曲肽,在肝硬化顽固性腹水或AKI-HRS的治疗中具有较重要的意义。针对肝硬化腹水形成过程中治疗新靶点(图2),如肠道微生态制剂、利福昔明及降门脉压力药物,及多靶点药物联合治疗值得临床进一步探讨。
相关链接:
(本文来自中国医学论坛报,如下转载,请联系授权)
查看更多