查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





2018年美国肝病研究学会(AASLD)年会于11月9~13日在美国旧金山召开。会上,AASLD公布了一系列最新临床试验(late-breaking clinical trials)。
ARREST研究Ⅱb期结果:Aramchol治疗NASH安全有效
口服脂肪酸-胆酸偶合物(Aramchol)可以下调硬脂酰辅酶A去饱和酶。之前的Ⅱa期临床研究表明,应用Aramchol治疗3个月,可以减少非酒精性脂肪性肝病(NAFLD)患者的肝脏脂肪含量;临床前动物模型研究表明,Aramchol还有抗肝纤维化的作用。
本届AASLD年会上,法国索邦大学研究人员报告了全球多中心Ⅱb期ARREST研究的最终结果,非酒精性脂肪性肝炎(NASH)患者应用Aramchol治疗1年,安全耐受性良好,可显著减少肝脏脂肪含量,改善肝脏组织学、肝脏生化指标和血糖控制情况。
该项随机安慰剂对照研究从美国、欧洲和拉丁美洲的11个国家纳入247例合并糖尿病前期或糖尿病、经活检证实为NASH[NAFLD活动度积分(NAS)≥4;F<4]的超重或肥胖患者,以2:2:1的比例,随机分组至接受Aramchol 400 mg qd、600 mg qd或安慰剂治疗。主要终点为自基线的肝脏脂肪含量(LF-MRS)绝对变化(Aramchol 600 mg组对比安慰剂组),关键次要终点包括NASH消退并且无肝纤维化加重、肝纤维化减轻≥1期并且无NASH加重以及丙氨酸氨基转移酶(ALT)水平下降。
该研究受试者65%为女性,平均年龄54.4岁,平均体质指数(BMI)为32.7 kg/m2,平均糖化血红蛋白(HbA1c)水平6.6%,平均LF-MRS为28.5%,60%为2~3期肝纤维化,平均NAS为5.12,最终89%的患者完成研究。
结果显示,与安慰剂组对比,Aramchol 400 mg组(P=0.045)和600 mg组(P<0.066)的LF-MRS均显著减少;安慰剂组LF-MRS绝对减少≥5%的患者比例为24%,与之相比,Aramchol 600 mg组和400 mg组肝脏脂肪含量绝对减少≥5%的患者比例分别为47%(P<0.028)和37%,表明Aramchol减少肝脏脂肪含量的效应与剂量有关。Aramchol 600 mg组与安慰剂组达到NASH消退且无肝纤维化进展的患者比例分别为16.7%和5.0%[比值比(OR)=4.74,P=0.051)],达到肝纤维化减轻≥1期且无NASH加重的患者比例分别为29.5%和17.5%(P=0.21)。Aramchol 600 mg组、400 mg组和安慰剂组分别有1例(1.3%)、6例(7.5%)和3例(7.5%)患者进展至肝硬化。与安慰剂组相比,Aramchol 600 mg组和400 mg组的ALT、天门冬氨酸氨基转移酶(AST)和HbA1c水平均显著下降,呈剂量效应关系。
口服睾酮治疗可以改善性腺功能低下患者的ALT和甘油三酯水平
大量研究表明,男性性腺功能低下与NAFLD有关,但是尚不清楚睾酮治疗是否对NAFLD有效。本届AASLD年会上,美国弗吉尼亚联邦大学研究人员交流的一项研究表明,男性性腺功能低下患者应用十一酸睾酮(TU)口服治疗,可以改善血清ALT和甘油三酯(TG)水平;TU口服治疗结束时,基线时NAFLD生化指标较高患者的改善更加明显;在所有合并症患者中,合并代谢综合征患者的生化指标改善最为明显。
该项开放标签的、随机、活性对照研究(SOAR试验)纳入男性性腺功能低下的患者,随机分组至口服TU治疗组(210例)和局部应用睾酮组(105例),评估口服TU治疗对患者NAFLD血清生化指标的影响。
研究结果显示,在口服TU治疗组中,合并肥胖(BMI>30 kg/m2)、高血压、糖尿病和代谢综合征(肥胖、糖尿病和高血压)的患者比例分别为56%、48%、22%和9%,接受治疗52周后,患者的ALT和TG水平显著下降。对基线时有合并症的患者进行比较结果表明,合并代谢综合征患者的ALT和TG水平下降幅度最大。基线时,分别有42例和73例患者的ALT和TG水平超出正常值,接受TU口服治疗后,52%的患者ALT恢复正常,34%的患者TG恢复正常。口服TU治疗与睾酮替代治疗的安全性一致,没有报告患者发生死亡、药物相关的严重不良事件、主要不良心脏事件、严重或重度肝病。

GT 1-6 HCV感染代偿期肝硬化患者应用Glecaprevir/Pibrentasvir治疗安全有效
全基因型直接抗病毒药物glecaprevir与pibrentasvir联合配方(G/P)被批准用于治疗基因1-6型(GT 1-6)HCV慢性感染。Ⅱ期和Ⅲ期研究表明,应用G/P治疗8周,停药后12周时,GT 1-6 HCV慢性感染患者可以获得较高的持续病毒学应答(SVR12)率,但是尚未对代偿期肝硬化患者进行研究。
本届AASLD年会上,美国纽约康奈尔医学院纽约长老会医院学者报告的一项研究表明,初治的HCV感染代偿期肝硬化患者应用G/P治疗8周,耐受性良好,可以获得较高的SVR12率,无病毒学失败发生。
该项正在进行的、非随机、开放标签的单组多中心Ⅲ期EXPEDITION-8研究纳入初治的GT 1-6 HCV慢性感染代偿期肝硬化成人患者(根据最近批准的修订方案,该项研究未纳入GT3 HCV感染患者)。进餐时,患者口服G/P(300 mg/120 mg),每日一次,治疗8周。
研究共纳入280例初治的代偿期肝硬化患者,多数(80%)患者为白人,60%为男性,90%患者为查尔德-皮尤(Child-Pugh)5分,感染GT1、GT2、GT4、GT5和GT6 HCV的患者比例分别为82%、9%、5%、<1%和3%。基线时,患者的中数HCV RNA水平为6.3 log10 IU/ml,中数FibroScan值为20.7 kPa,中数血小板计数为152× 109/L,中数总胆红素水平为0.7mg/dl,中数白蛋白水平为42 g/L。迄今为止,已经对116例患者完成治疗结束后12周随访。
没有发生病毒学失败。多数不良事件轻微,最常见(发生率≥5%)的不良事件为瘙痒(9%)、乏力(9%)、头痛(7%)和恶心(6%),没有发生导致G/P停药的不良事件,发生5例严重不良事件,均与G/P治疗无关。
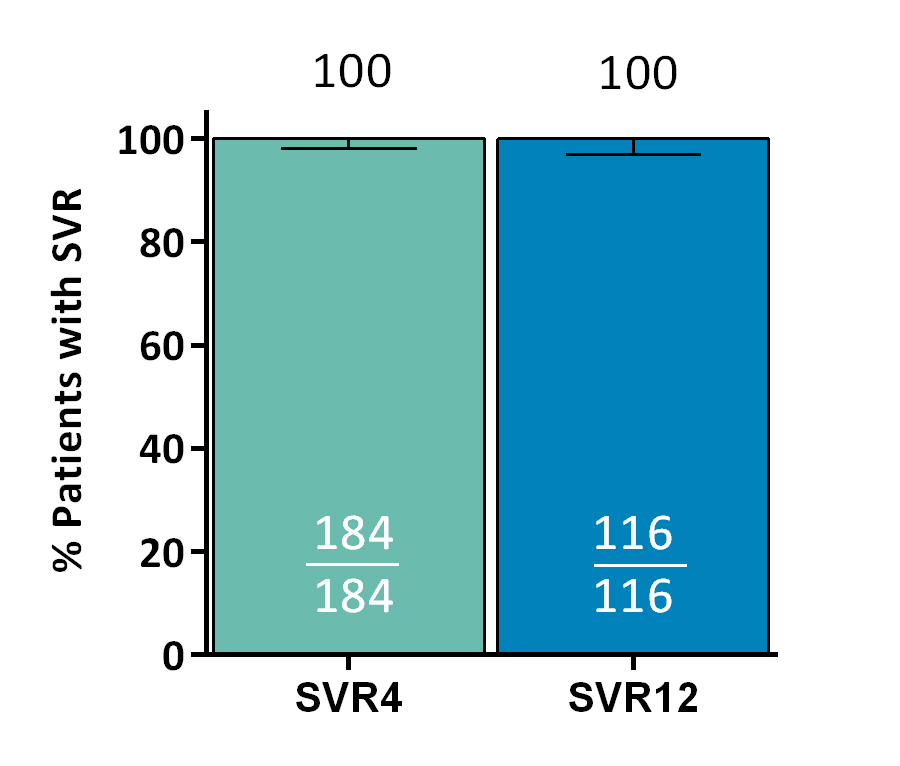
接受透析的HCV感染患者应用索磷布韦/维帕他韦方案治疗12周安全有效
接受透析患者的抗HCV治疗比较复杂,涉及药物之间的相互作用、基线耐药检测及肝毒性风险等。严重肾功能障碍的患者应用基于索磷布韦(SOF)的方案治疗,尽管患者循环SOF代谢产物浓度较高,但真实世界的病例系列研究表明,该组人群应用基于SOF的方案治疗,并没有发现安全性问题。
本届AASLD年会上,加拿大威廉·奥斯勒医疗体系研究人员报告的一项研究表明,接受透析的肝硬化或非肝硬化患者应用SOF/维帕他韦(VEL)单片药物方案治疗12周, SVR12率高达95%,且该方案的安全耐受性良好,没有发生治疗相关的停药或严重不良事件。
该项开放标签研究从加拿大、英国、西班牙、以色列、澳大利亚和新西兰的21家中心纳入59例初治或经治、感染HCV基因型不限、接受血液透析或腹膜透析的代偿期肝硬化或非肝硬化患者,接受固定剂量的SOF/VEL(400 mg /100 mg)治疗,每日一次,疗程12周。对接受透析的HCV感染患者应用SOF/VEL治疗12周的安全性、效果和药代动力学进行评估。
该项研究患者的中数年龄为62岁,59%为男性,53%为白人,32%为经治患者,29%患有肝硬化,基因1型、2型或3型HCV感染的患者比例分别为42%、11%和27%,多数(92%)患者接受血液透析,接受透析的平均时间为7.3年。
结果显示,患者对SOF/VEL治疗的耐受性良好,无患者由于不良事件停止治疗。1例患者由于依从性差,只是服用了研究药物的48%,于74天时停止治疗。56例(95%)患者获得SVR12,2例(3%)发生病毒学复发(1例依从性差),1例患者获得SVR4后,由于自杀死亡,未获得SVR12。
患者的药物暴露量与1期肾功能障碍研究的数据一致。最常见的不良事件为头痛、乏力、恶心和呕吐。19%的患者发生严重不良事件,均与研究药物无关。
经鼻应用治疗性疫苗可有效降低或清除慢性HBV感染患者的HBsAg
慢性HBV感染患者获得HBsAg清除,是理想的治疗目标,然而应用目前的核苷(酸)类似物(NUC)方案治疗,难以实现。本届AASLD年会上,日本爱媛大学医学研究生院学者报告的一项研究表明,慢性HBV感染患者经鼻应用包含HBsAg和HBcAg的治疗性疫苗(NASVAC),可有效降低或清除HBsAg。
该项开放标签研究纳入服用或未服用NUC的慢性HBV感染患者,将NASVAC与羧乙烯聚合物混合,进行乳化处理以增强NASVAC的免疫原性。经鼻应用NASVAC治疗10次,每2周一次,对NASVAC治疗效果进行评估。
研究结果显示,应用NUC治疗患者(23例)平均年龄为54岁,男/女比例为16/7, ALT水平为19 U/L,HBsAg水平为436 IU/ml;未应用NUC治疗患者(31例)的平均年龄为56岁,男/女比例为15/16,ALT水平为21 U/L,HBsAg水平为1370 IU/mL。应用NUC治疗组的12例患者和未应用NUC治疗组的5例患者已经完成NASVAC治疗结束后6个月的随访。
治疗期间,9.3%的患者有一过性鼻腔不适,但没有观察到其他不良事件或ALT水平升高的发生。治疗结束后6个月时,应用NUC治疗组11例(91.7%)和未应用NUC治疗组的所有5例患者(100%)观察到HBsAg下降,应用NUC治疗组和未应用NUC治疗组的平均HBsAg下降幅度分别为23.5%和44.1%,应用NUC治疗组12例患者中的3例(25%)和未应用NUC治疗组5例患者中的2例(40%)检测出抗-HBs。引人注目的是,最新随访数据表明,未应用NUC治疗的2例患者和应用NUC治疗的1例患者已经获得HBsAg清除,出现抗-HBs,HBV DNA 持续阴性。
RNA干扰用于治疗慢性乙肝患者的初步结果
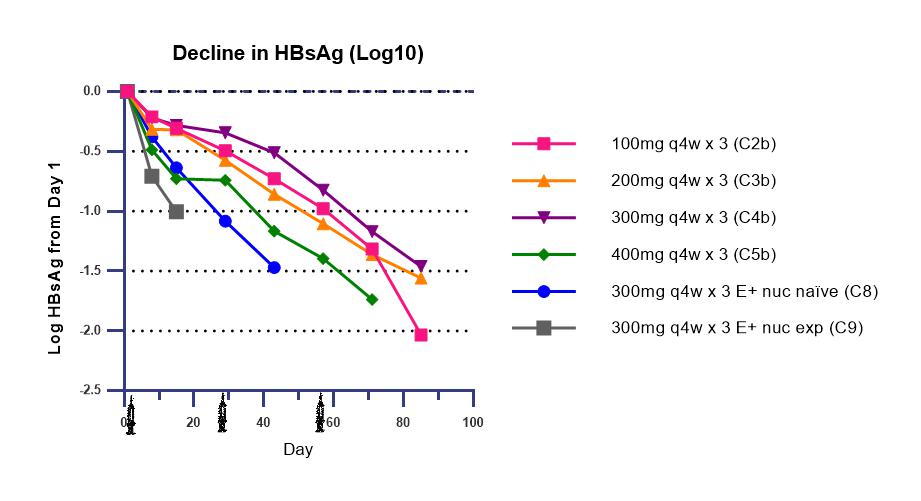
RNA干扰(RNAi)可以使HBV mRNA沉默,从而使HBV的所有病毒产物减少,最突出的是可以减少HBsAg,因此,RNAi有望作为慢性乙型肝炎(CHB)患者限定疗程治疗方案的组成部分,然而,由于需要静脉注射以及安全性问题,RNAi的临床实用性受到限制。ARO-HBV由两种小干扰RNA(siRNAs)组成,每种siRNA直接与N-酰半乳糖胺共轭结合,促使递送至肝细胞。不需要其他递送元件,皮下应用(SQ),旨在沉默来自cccDNA和整合至宿主病毒DNA的所有mRNA。
本届AASLD年会上,新西兰研究人员报告的一项研究表明,正常健康志愿者(NHV)和CHB患者对ARO-HBV的耐受性良好,约11%的SQ注射与注射部位轻微不良事件有关,应用ARO-HBV,每月一次RNAi,可以有效减少可检测的所有病毒产物,包括有效减少HBsAg。ARO-HBV的特点,使其适合用于RNAi,从而有望成为CHB患者的清除HBsAg基础治疗方案。
NHV队列(4例接受ARO-HBV,2例接受安慰剂)接受剂量为35、100、200、300或400 mg的ARO-HBV,单次SQ;CHB队列2b-5b(n=4,HBeAg阳性或阴性,应用或未应用NUC治疗)接受剂量为100、200、300或400 mg的ARO-HBV,每月一次,治疗3次;HBeAg阳性、NUC初治和经治的CHB队列(队列8、9,每个队列4例)接受剂量为300 mg的ARO-HBV,每月一次,治疗3次,未应用NUC治疗的患者从第一天开始,接受NUC治疗。报告结果为3次。
研究结果表明,NHV或CHB队列的受试者发生严重不良事件或脱落。ARO-HBV治疗的不良事件轻微,与安慰剂相似。约11%的注射发生注射部位不良事件,均为轻度。对队列2b-5b(16例接受ARO-HBV)进行分析,基线时,14例检测不出HBV DNA,13例为HBeAg阴性,14例长期应用NUC治疗。CHB患者的平均(最大)HBsAg下降幅度为:队列2b-5b中,应用100 mg ARO-HBV治疗至85天,HBsAg下降2.0(4.0)log10 IU/ml;应用200 mg ARO-HBV治疗至85天,HBsAg下降1.6(2.2)log10 IU/ml;应用300 mg ARO-HBV治疗至85天,HBsAg下降1.5(2.2)log10 IU/ml;应用400 mg ARO-HBV治疗至71天,HBsAg下降1.7(3.0)log10 IU/ml;队列8中,治疗至43天,HBsAg下降1.5(3.0)log10 IU/ml;队列9中,治疗至15天,HBsAg下降1.0(1.3)log10 IU/ml。
至85天时,所有患者的HBsAg下降均> 1.0 log10,第2次和第3次治疗后,观察到HBsAg的更多下降。在24例CHB患者中,21例患者基线时HBsAg水平>100 IU/ml。目前,有17例患者已经达到HBsAg <100 IU/ml,7例患者达到≤10 IU/ml,4例患者达到≤1 IU/ml。接受ARO-HBV治疗后,基线时可以检出其他病毒参数的CHB患者的所有病毒参数均得到改善:7例可检出HBV DNA患者中的2例达到HBV DNA检测不出,14例可检出HBV RNA患者中的8例达到HBV RNA检测不出,15例可检出HBV核心相关抗原(HBcrAg)患者中的3例达到HBcrAg检测不出,不过,11例HBeAg阳性的患者仍然维持HBeAg阳性。
国际多中心Ⅱ期研究:Seladelpar治疗26周可有效减轻PBC瘙痒症状
原发性胆汁性胆管炎(PBC)是一种以肝内胆管破坏为特征、病因不明的炎症性肝脏疾病。在疾病过程中,高达70%的患者可发生瘙痒症状,严重影响患者的生活质量。选择性过氧化物酶体增殖物激活受体(PPAR)δ激动剂—Seladelpar是用于治疗炎症性肝脏疾病的候选药物。
本届AASLD年会上,德国埃朗根-纽伦堡大学研究人员报告的一项国际多中心Ⅱ期研究表明,PBC患者应用Seladelpar治疗26周,瘙痒强度明显减轻。
该项开放标签研究纳入对熊去氧胆酸(UDCA)治疗应答不充分或不能耐受UDCA治疗,碱性磷酸酶(ALP)水平≥1.67倍正常值上限(´ULN)的PBC患者,随机分组至每日接受5 mg或10 mg的Seladelpar治疗,12周后,5 mg组患者基于ALP应答情况,可以将剂量滴定至10 mg(5/10 mg组)。将前26周作为数据分析的关键监管时间点,对瘙痒症状进行评估。患者应用视觉模拟评分(VAS),记录瘙痒强度,范围为从0到100,0表示无瘙痒,100代表难以忍受的瘙痒,并且收集患者的瘙痒问卷[5维(5-D)瘙痒量表和PBC-40问卷]以及病史和不良事件,评估Seladelpar治疗26周对PBC患者瘙痒症状的效果。
研究结果显示,截止2018年7月,119例患者至少接受一次Seladelpar,其中79例(66%)患者报告瘙痒史,对包括5/10 mg组18例患者和10 mg组19例患者,总计37例患者进行26周的期中分析(基线时VAS>0)。5/10 mg组和10 mg组的基线中数VAS分别为15和50,26周时,两组患者的中数VAS分别下降50%和55%。
无瘙痒所致的严重不良事件,20%(24/119)的患者报告瘙痒不良事件,1例剧烈瘙痒患者入选Seladelpar 10 mg组,由于可能与PBC有关的瘙痒加重,于5天后停止治疗。26周时,无患者由于Seladelpar相关的不良事件而中断治疗。
已经启动一项Ⅲ期安慰剂对照研究,评估PBC患者的瘙痒症状,对应用Seladelpar治疗26周的上述研究结果进行验证。
(张福奎编译)
来源中国医学论坛报社,转载请联系授权!
查看更多