查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





导语:新型抗HER2治疗药物不断涌现,HER2阳性MBC的治疗策略如何“因地制宜”?
HER2阳性乳腺癌患者约占所有乳腺癌的15%~20%[1],是最具侵袭性的乳腺癌亚型之一。近20年来,抗HER2治疗药物的不断发展显著改善了HER2阳性乳腺癌的预后。其中各种新型、高活性抗HER2治疗的涌现,以及正在开发的极具前景的诊断工具,将为提高乳腺癌治愈率提供前所未有的机会。2022 ASCO Educational Book发表的一篇报道“Systemic Therapy for HER2-Positive Metastatic Breast Cancer: Moving Into a New Era”指出,当前HER2阳性转移性乳腺癌(MBC)的治疗目标是根据疾病和患者的特征量身定制治疗强度,以提高治愈率,同时将过度治疗风险降到最低,这为制定HER2阳性MBC的治疗策略提示了重要方向。


HER2阳性MBC的治疗排兵布阵
在HER2阳性MBC患者中,一线治疗应为曲妥珠单抗+帕妥珠单抗+多西他赛/紫杉醇(不考虑HR状态)。如果耐受,应给予紫杉烷至少6个周期,然后曲妥珠单抗+帕妥珠单抗维持治疗(HR阳性患者还需联合内分泌治疗),直至疾病进展。在HR阳性患者中,还应针对绝经前和围绝经期女性增加卵巢功能抑制(OFS)。基于新的研究,对于一线治疗中接受过紫杉烷和曲妥珠单抗的患者,一些新的药物为二线治疗和特定脑转移患者的治疗带来新的选择。对于无法获得新型药物的地区,T-DM1仍是HER2阳性MBC的首选二线治疗选择。图卡替尼+卡培他滨+曲妥珠单抗和T-DM1似乎是三线治疗中最有效的治疗选择。三线治疗选择取决于既往二线治疗、患者特征(包括是否存在活动性脑转移)、毒性特征和可及性。在后线治疗中,拉帕替尼是一种可选方案,但最好联合使用(例如,与卡培他滨、曲妥珠单抗或内分泌治疗)。
在晚期疾病背景下,当抗HER2标准治疗都使用过后,奈拉替尼或margetuximab也可作为合理的治疗选择。如果其他抗HER2治疗均已用尽、不适合或不可及,则应考虑在疾病进展后使用曲妥珠单抗。尽管HER2阳性MBC传统意义上被认为是无法治愈的,但近二十年来开发的新型抗HER2靶向治疗正逐步动摇这一认知。事实上,一部分HER2阳性MBC患者在化疗联合抗HER2治疗后能达到持久缓解,类似于治愈。在这种情况下,确定治疗升级强化策略可能有益于最佳“可治愈”患者,可能会彻底改变这些患者的治疗模式。
一线和二线治疗
当患者诊断为HER2阳性MBC时,应予以抗HER2治疗。H0648g研究[2]表明,与单独化疗相比,在化疗基础上加用曲妥珠单抗可改善无进展生存期(PFS)和总生存期(OS)。基于这项研究,曲妥珠单抗正式开启了乳腺癌抗HER2治疗时代,并且研究者在后续的抗HER2治疗探索中,不断尝试着基于曲妥珠单抗的优化治疗方案。
对于既往未经治疗的MBC患者,紫杉烷+曲妥珠单抗+帕妥珠单抗是目前的最佳治疗选择。Ⅲ期CLEOPATRA临床试验[3]结果表明,曲帕双靶联合治疗组相比单靶联合治疗组能显著延长患者的中位PFS(18.5个月 vs. 12.4个月)和中位OS(57.1个月 vs. 40.8个月)。PERUSE临床试验[4]是多西他赛(54%)、紫杉醇(41%)或白蛋白结合型紫杉醇(5%)联合曲帕双靶治疗的Ⅲb期研究,结果显示,紫杉醇组的中位PFS为23个月。虽然关于化疗的最佳持续时间尚未达成明确的共识,但如果可能,建议维持治疗至少6个月。并且根据受体状态,使用双靶联合或不联合内分泌治疗进行维持治疗。
曲帕双靶联合内分泌治疗的作用已在随机Ⅱ期PERTAIN试验[5]中进行了探索。该研究将绝经后患者分为两组:曲帕双靶加芳香化酶抑制剂或曲妥珠单抗加芳香化酶抑制剂。在三药组中观察到PFS显著获益(中位PFS,18.9个月 vs. 15.8个月)。该试验中一半的患者在内分泌治疗前接受了化疗,研究结果为诱导化疗后使用抗HER2和内分泌治疗双重阻断作为维持治疗策略增加了证据。
尽管曲帕双靶在无化疗情况下的作用尚未在大型Ⅲ期研究中进行探索,但有一项小型、随机Ⅱ期研究[6]提示抗HER2双靶阻断应该联合化疗。该研究纳入80例老年/虚弱患者随机分配接受节拍口服环磷酰胺加曲帕双靶或仅接受曲帕双靶治疗,主要终点为6个月时研究者评估的PFS率,观察到无化疗组为46.2%,化疗组为73.4%,且两组的中位PFS分别为5.6个月和12.7个月(HR=0.65;p=0.12)。
T-DM1的Ⅲ期MARIANNE试验[7]中,曲妥珠单抗+紫杉烷、T-DM1、T-DM1+帕妥珠单抗组的中位PFS分别为13.7个月、14.1个月和15.2个月(各组间无显著差异),各组中观察到相似的OS。尽管T-DM1不劣于曲妥珠单抗+紫杉烷,但基于CLEOPATRA研究中,曲帕双靶联合多西他赛相比曲妥珠单抗+多西他赛具有明确的显著获益,T-DM1并未作为大多数患者一线治疗的优选。
对于既往接受过新辅助和/或辅助曲帕双靶为基础的治疗,并且在完成治疗12个月后出现转移复发的患者,可以考虑使用紫杉醇或多西他赛联合曲帕双靶进行一线治疗。无治疗间期小于6个月的患者可接受“二线”治疗。然而,无治疗间期在6~12个月之间的患者的最佳治疗仍然是一个有争议的问题。因此,一线治疗的最佳选择应基于既往治疗。
根据Ⅲ期EMILIA试验[8]的结果,在过去10年中,T-DM1被认为是以曲妥珠单抗和紫杉烷为基础治疗后疾病进展患者的最佳治疗选择。相比拉帕替尼+卡培他滨,T-DM1的中位PFS显著改善(9.6个月 vs. 6.4个月),中位OS也有获益(29.9个月 vs. 25.9个月)。尽管在接受T-DM1的患者组中报告了较高比例的血小板减少和转氨酶升高事件,但总体而言,3~4级不良事件发生率较低。
最近,以新一代ADC药物为代表新型抗HER2药物,显示出非常好的活性,相关药物有很多临床研究在进行中。
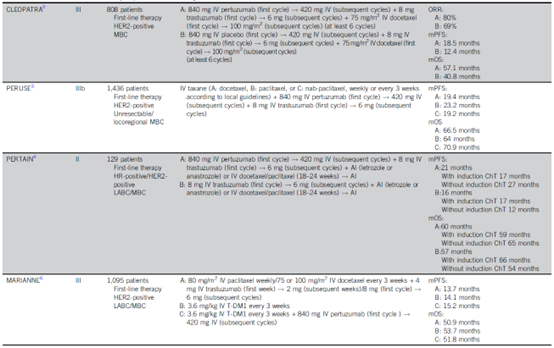
表1. HER2阳性MBC的一线治疗方案的关键临床研究
三线治疗
目前有多种药物可用于HER2阳性MBC患者的后线治疗。图卡替尼的HER2CLIMB研究[9]中,图卡替尼+曲妥珠单抗+卡培他滨相比安慰剂+曲妥珠单抗+卡培他滨显著改善患者的中位PFS(7.8个月 vs. 5.6个月)和中位OS(21.9个月 vs. 17.4个月)。并且图卡替尼联合给药的耐受性良好,因不良事件导致的停药率较低。
尽管治疗地位并不明确,但是拉帕替尼在晚期后线中仍然可供选择。在酪氨酸激酶抑制剂(TKI)初治患者中,与单用拉帕替尼相比,拉帕替尼+曲妥珠单抗可显著改善患者的PFS(HR=0.73;p=0.008),OS在数值上也有改善趋势(HR=0.75;p=0.106)[10]。奈拉替尼是一种不可逆的泛HER TKI,在Ⅲ期NALA研究[11]中,患者随机分配接受卡培他滨与拉帕替尼或奈拉替尼治疗,但奈拉替尼组的PFS仅获得小幅度显著改善(HR=0.76;p=0.0059),无OS获益,且发生显著毒性。因而奈拉替尼相比其他TKI在临床实践中的地位尚不明确。
Margetuximab是一种曲妥珠单抗衍生物片段可结晶工程抗体,Ⅲ期SOPHIA试验[12]中,既往接受过二线或二线以上抗HER2治疗的患者被随机分配接受margetuximab加化疗或曲妥珠单抗加化疗,结果表明,margetuximab联合化疗显著改善了PFS(5.8个月 vs. 4.9个月;HR=0.76;p=0.03),但未证实显著的OS获益。
疾病进展后继续抗HER2治疗被认为是标准临床实践。如上述抗HER2治疗均已使用过,或者不适合、不可及,则应考虑采用基于曲妥珠单抗的序贯策略(联合不同化疗)。最后,可能考虑SYD985,其Ⅲ期TULIP试验[13]纳入既往在转移背景下接受过二线或以上治疗的HER2阳性MBC患者分别接受SYD985或医生选择的治疗,研究达到了主要终点,PFS获得了小幅度的显著改善(中位PFS,7.0个月 vs. 4.9个月)。
三阳性乳腺癌
HER2阳性/HR阳性(三阳性)乳腺癌约占所有HER2阳性乳腺癌的50%,研究表明在内分泌治疗基础上加用抗HER2靶向治疗可延长三阳性MBC患者的PFS。并且PERTAIN4和ALTERNATIVE试验已证实在曲妥珠单抗+芳香化酶抑制剂基础上加用帕妥珠单抗或拉帕替尼的抗HER2双靶阻断比抗HER2单靶阻断+内分泌治疗更有效。此外,SYSUCC-002试验随机分配了392例三阳性MBC患者接受一线曲妥珠单抗联合内分泌治疗或化疗,结果表明无化疗方案非劣效于曲妥珠单抗联合化疗,且毒性更易于管理。基于这些数据,国际指南建议在不适合化疗的三阳性MBC患者中可以考虑无化疗方案[1]。
免疫疗法
较高浸润性淋巴细胞的肿瘤微环境可能预测HER2阳性早期和晚期乳腺癌患者更好的长期预后。基于这些考虑,以及抗HER2单克隆抗体免疫相关的ADCC作用机制,假设在抗HER2治疗中观察到的长期缓解可归因于免疫相关机制。在这种情况下,联合免疫治疗理论上可以与抗HER2药物发挥协同作用,从而提高长期应答率。目前许多试验正在验证这一假设。例如,NRG-BR004 Ⅲ期试验正在评估在一线紫杉醇+曲妥珠单抗+帕妥珠单抗治疗中加用阿替利珠单抗的获益。而基于KATE2试验的证据,KATE3 Ⅲ期试验已经启动,旨在评估T-DM1联合阿替利珠单抗在PD-L1阳性、HER2阳性MBC患者中的疗效和安全性。值得注意的是,迄今为止在HER2阳性乳腺癌中观察到免疫治疗的临床结果并不一致,例如在PD-L1阳性、HER2阳性MBC患者中能观察到一定程度的活性,但无论PD-L1状态如何,在标准新辅助治疗基础上加用免疫检查点抑制剂后,早期病理学完全缓解并无改善。此外,治疗指数更高的新一代ADC与免疫检查点抑制剂结合的相关研究探索也正在如火如荼地开展中。
乳腺癌脑转移的预防和治疗
1.发病率和流行病学
发生脑转移的风险因素包括HER2阳性或三阴性亚型、年轻、高组织学分级、淋巴结阳性和炎性乳腺癌诊断等。监测、流行病学和最终结果数据库中基于人群的研究报告[14]显示,11.5%的新发HER2阳性MBC患者在初次就诊时伴有脑转移。患者一旦发生转移性疾病,脑转移的风险会随着时间的推移而累积,HER2阳性乳腺癌患者的累积发生率高达50%。
2.HER2阳性乳腺癌脑转移的预防
包括辅助曲妥珠单抗、拉帕替尼、帕妥珠单抗或T-DM1均不能降低CNS复发风险。例如在KATHERINE试验中,观察到T-DM1组超过一半的远处复发是CNS复发。而ExteNET研究[15]报告了奈拉替尼辅助治疗预防CNS的可能性,在对295例HR阳性/HER2阳性、曲妥珠单抗治疗后不到1年和新辅助治疗后有残留疾病的患者亚组进行的事后分析中,奈拉替尼组的CNS转移发生率为0.8%,而安慰剂组为3.6%。CompassHER2 RD临床试验正在评估在新辅助治疗后T-DM1基础上加用图卡替尼的疗效和安全性,并将评价CNS复发作为次要终点(NCT04457596)。
在转移情况下,CLEOPATRA试验[16]报告曲帕双靶联合化疗组可能延迟脑转移的发生(至CNS转移的中位时间,11.9个月 vs. 15.0个月;HR=0.58;p=0.0049);但是,两组之间CNS作为疾病进展首发部位的总体发生率相似(单靶组12.6% vs. 双靶组13.7%)。在比较拉帕替尼+卡培他滨与T-DM1的EMILA研究中,未观察到CNS进展的显著差异;然而,在基线时稳定脑转移患者中,T-DM1组的OS更优。NALA试验[17]中,奈拉替尼+卡培他滨组与拉帕替尼+卡培他滨组相比,需要对有症状的CNS转移进行干预的患者比例明显减少(22.8% vs. 29.2%),提示奈拉替尼潜在的CNS预防获益。对于HER2CLIMB研究[17]中的基线脑转移患者,与安慰剂+卡培他滨+曲妥珠单抗相比,图卡替尼+卡培他滨+曲妥珠单抗治疗后至CNS进展或死亡的时间显著延长(HR=0.339;中位数,4.0个月 vs. 9.6个月;p<0.001,活动性脑转移患者;HR=0.406;中位数,5.6个月 vs. 13.9个月,p=0.01,稳定/接受过治疗的脑转移患者)。并且在一项事后分析中,纳入了所有随机分配的患者,无论基线时是否存在脑转移,图卡替尼组至新发脑转移或死亡的时间也显著延迟(HR=0.52;p=0.005)。总体而言,HER2CLIMB研究提供了潜在CNS预防作用的最令人信服的证据。
3.HER2阳性乳腺癌脑转移的治疗
新发或进展性脑转移患者的治疗仍然需要多学科共同努力。治疗方式的选择和顺序(例如,手术切除、放疗、全身治疗)取决于脑转移的阶段(首次脑转移诊断与后续CNS进展)、数量、大小和位置,以及相关症状、既往治疗,以及全身和/或局部治疗有效的可能性。对于手术切除的患者,必须重新检测雌激素受体、孕激素受体和HER2状态,因为约15%的病例在原发性疾病到脑转移发生过程之间可能获得HER2阳性。
在HER2阳性乳腺癌脑转移全身治疗方面,已在活动性脑转移患者中评价了多种HER2靶向TKI的活性。最初的试验评估了拉帕替尼单药或联合卡培他滨治疗,拉帕替尼+卡培他滨报告的CNS客观缓解率为18%~66%,取决于患者是经治还是放疗初治。随后,TBCRC 022临床试验[18]评估了奈拉替尼和以奈拉替尼为基础的联合治疗,在49%未接受过拉帕替尼治疗的患者和33%拉帕替尼经治患者中观察到对奈拉替尼+卡培他滨的中枢神经系统客观缓解。吡咯替尼是一种新型抗HER2靶向治疗药物,已在中国获批用于既往接受过治疗的HER2阳性MBC患者。在Ⅱ期PERMEATE研究[19]中,吡咯替尼+卡培他滨在CNS放疗初治患者中的CNS客观缓解率为74.6%,在CNS放疗后疾病进展的患者中为42.1%,研究结果支持了该方案的CNS治疗活性。最后,在HER2CLIMB试验[20]中,针对基线时有可测量的活动性CNS转移的患者,图卡替尼组的CNS客观缓解率为47%,对照组为20%(p=0.03),图卡替尼组的缓解持续时间更长(颅内缓解的中位持续时间为8.3个月 vs. 3.0个月)。在所有291例基线时存在脑转移的患者中(中位数,21.6个月 vs. 12.5个月;HR=0.6;p<0.001),以及在174例基线时存在活动性脑转移的患者中(中位数,21.4个月 vs. 11.8个月;HR=0.52;p<0.001),图卡替尼组相比安慰剂组的组间OS均存在显著差异。
尽管单克隆抗体不能穿过完整的血脑屏障,但肿瘤的发生实质上破坏了血脑屏障的完整性,使得大分子似乎可以穿过。目前有多个证据支持单克隆抗体和ADC药物的CNS活性。PATRICIA试验[21]评估了曲帕双靶联合递增暴露是否具有治疗CNS转移的活性,尽管CNS客观缓解率为中等(11%),但6个月时的临床获益率为51%。在T-DM1的单臂、Ⅲb期KAMILLA研究[22]中,在约三分之一具有可测量病灶的脑转移患者中观察到中枢神经系统反应。最后,新出现的证据支持了新型ADC药物在脑转移患者中的作用,不管是在临床稳定脑转移还是活动性/进展性脑转移患者中。
总体而言,在HER2阳性乳腺癌脑转移背景下,具有CNS活性的全身治疗药物越来越多。考虑到HER2阳性MBC患者中脑转移的高患病率,了解新型抗HER2靶向治疗的CNS活性至关重要。
总结
二十年的研究和临床实践的进展使HER2阳性乳腺癌从预后最差转变为预后最好的乳腺癌亚型,尽管如此,仍有部分患者面临复发。并且,抗HER2治疗也是最昂贵、最冗长和最复杂的治疗方案,因此目前的重点是针对需要强化治疗的患者进行合理的强化治疗,并降低可能获益较少患者的过度治疗。化疗和单克隆抗体双重阻断HER2通路可显著改善HER2阳性MBC患者的预后,而新型、高活性抗HER2药物(如新型ADC药物)的出现则进一步改变和丰富了临床治疗选择。
参考文献
* 本文由阿斯利康提供支持,仅供医疗专业人士参考
审批编号:CN-106935
有效期至:2023-12-7
查看更多