查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





胃癌是全球发病率第5位、病死率第3位的恶性肿瘤,也是我国最常见的消化道肿瘤,降低我国胃癌的发病率和病死率成为亟待解决的重大公共健康问题。
如何应对胃的癌前状态和病变成为胃癌筛查和预防工作中的重要环节,但目前我国尚缺乏完整的针对胃的癌前状态和病变的系统性共识。
近日,由国家消化系疾病临床医学研究中心(上海)牵头,消化病、病理学、消化内镜、健康管理等领域专家共同讨论,在前期共识基础上,结合我国胃黏膜癌前状态(萎缩和肠化生)和癌前病变(IN)的发病现状,提出针对胃黏膜癌前状态和癌前病变的诊治要点和随访策略,以期对该类疾病的防控发挥指导作用,从而实现早期阻断和干预胃癌发生。
本共识采用国际通行的Delphi方法达成相关陈述建议,包括临床证据的评估和推荐等级建议。临床证据质量的评估采用建议评估、发展和评价的分级(grading of recommendations assessment, development and evaluation,GRADE)系统,分为低、中、高3个等级,推荐等级由共识制定专家讨论决定。本共识内容分为胃黏膜癌前状态和癌前病变的定义、诊断和分期、治疗、监测和随访4个部分,共24条陈述建议。
本期我们先来看看后12条建议。
三、胃黏膜癌前状态和癌前病变的治疗
【陈述13】根除H.pylori是治疗CAG的首要措施,可部分逆转胃黏膜萎缩,从而降低胃癌前状态进展为胃癌的风险。
证据质量:高
推荐等级:高
早在1994年国际癌症研究机构和WHO就将H.pylori定义为Ⅰ类致癌原。H.pylori感染是胃癌发生的环境因素中最重要且可控的因素,并且是慢性胃炎、消化道溃疡发生的主要病因。根除H.pylori可改善胃黏膜炎症反应,延缓或部分逆转胃黏膜萎缩。大量研究表明,检测和根除H.pylori可降低萎缩性胃炎等无症状感染者的胃腺癌发病率,且根除H.pylori的收益与该地区的胃腺癌发生率相关。2018年日本一项横断面研究对232份胃黏膜活检标本进行分析,标本来源包括H.pylori根除3年后的萎缩性胃炎患者和同期未根除H.pylori的萎缩性胃炎患者,发现H.pylori根除有助于减少萎缩黏膜部分基因位点的甲基化,从而逆转胃黏膜萎缩,阻断"Correa肠型胃癌演变"进程。
【陈述14】根除H.pylori尽管很难短期逆转肠化生,但是对于并存肠化生的萎缩有干预作用。
证据质量:中
推荐等级:中
尽管大量证据表明根除H.pylori有助于逆转胃的癌前状态,阻断Correa肠型胃癌演变进程,但部分研究认为H.pylori根除对Correa进程的阻断可能存在"不可逆点",即H.pylori根除仅对某阶段病变有逆转效应,超过该阶段则失去逆转效应。2017年一篇包括52 363例受试者的meta分析认为,根除H.pylori患者患胃腺癌的风险显著低于对照组(RR=0.56,95%CI 0.48~0.66,P<0.01),萎缩性胃炎患者可从根除H.pylori中受益,从而降低胃癌发生风险,而肠化生或IN患者则获益不明显。然而,韩国近期一项对598例受试者进行为期10年随访的队列研究,认为H.pylori根除对萎缩和肠化生均有逆转作用,H.pylori根除后3~5年胃窦和胃体的肠化生可消失。尽管对肠化生患者行H.pylori根除的获益仍存在争议,但目前认为其对延缓并存肠化生的萎缩和减轻胃部炎症均有积极作用。
【陈述15】根除H.pylori有助于阻断LGIN进展为HGIN或胃癌。
证据质量:低
推荐等级:中
最新欧洲指南建议,对于合并H.pylori感染的LGIN应于内镜下诊疗后进行根除。国外文献报道,根除H.pylori可降低HGIN或胃癌切除后复发的概率,且根除H.pylori可在一定程度上改变IN进展为胃癌的过程。然而近期几项meta分析并不支持H.pylori根除降低LGIN黏膜的胃癌发生率的结论,仅支持H.pylori根除对萎缩性胃炎和肠化生的积极作用。因此,H.pylori根除对LGIN的阻断作用仍有待进一步研究。
【陈述16】胃黏膜HGIN和早期胃癌建议首选ESD治疗。
证据质量:高
推荐等级:高
治疗早期胃癌传统的方法是外科根治切除术,手术切除病变以后5年生存率可达90%以上,但外科手术破坏了胃的正常解剖结构,导致患者的远期生理功能受到很大影响,手术后残胃亦属于癌前病变。ESD具有创伤小、恢复快、费用低和并发症少等优势,是治疗消化道早期肿瘤安全、有效的方式。与内镜黏膜切除术( endoscopic mucosal dissection, EMR)相比,ESD治疗表浅型癌的整块切除率和治愈性切除率均更高。Chiu等比较了74例经ESD治疗和40例外科切除早期胃癌的资料,结果表明外科治疗组平均手术时间和平均住院日均显著长于ESD治疗组,并发症的发生率显著高于ESD治疗组,而术后3年存活率两组差异无统计学意义,提示ESD治疗早期胃癌可以达到与外科手术相同的疗效,但ESD治疗组术后出血的发生率显著低于外科手术组,平均手术时间和平均住院日均显著短于外科手术组。因此,HGIN和早期胃癌首选ESD治疗。
【陈述17】对于内镜下有清晰边界的胃黏膜LGIN,可考虑内镜微创治疗。
证据质量:中
推荐等级:中
既往研究表明,38%~75%的LGIN会自然消退,19%~50%会持续存在。未消退的LGIN病例中,有23%会在10~48个月内进展为恶性,另有报道LGIN人群中胃腺癌的年发生率为0.6%。第1版欧洲癌前病变指南中仅推荐对内镜下边界清晰的HGIN和早期胃癌行内镜微创治疗。在2019年的新版指南中将界限清晰的LGIN也列入推荐治疗行列,原因在于LGIN有相当高的恶变风险,且活检中有清晰边界的LGIN在局部非活检区域可能已进展为HGIN或早期胃癌。因此,对内镜下有清晰边界的胃黏膜LGIN,可考虑内镜微创治疗。
【陈述18】癌前病变和早期胃癌行内镜治疗后,根除H.pylori有助于防止胃癌复发和异时性胃癌的发生。
证据质量:高
推荐等级:高
癌前病变和早期胃癌多采用EMR或ESD进行治疗。然而,临床研究发现早期胃癌行ESD治疗后,仍有部分患者在胃内其他部位发生新的胃癌(异时性胃癌),其原因可能为胃癌患者的周边胃黏膜存在癌前病变。此外,早期胃癌内镜治疗后原发部位仍有可能复发。其中,H.pylori感染与病变复发存在密切的相关性。2018年发表的一项随机、双盲、对照研究纳入了470例内镜下切除的早期胃癌或HGIN患者,分为H.pylori根除组和安慰剂组,经过平均5.9年的随访观察发现,H.pylori根除组194例患者中有14例发生了异时性胃癌(7.2%),显著低于安慰剂组的13.4%,风险比为0.50(95%CI 0.26~0.94)。因此,推荐早期胃癌行ESD术后伴H.pylori感染者行H.pylori根除治疗,防止胃癌复发和异时性胃癌的发生。
【陈述19】胃黏膜保护剂、叶酸、中药制剂对包括CAG在内的胃癌前状态有一定治疗作用。
证据质量:低
推荐等级:中
既往研究认为叶酸治疗胃癌前状态能使抑癌基因p53表达明显升高,Bcl-2癌基因蛋白的表达下降,即叶酸通过增强癌前病变上皮细胞的凋亡而预防胃癌发生。我国慢性胃炎共识中指出,某些维生素和微量元素硒可能降低胃癌发生的危险性,对于部分体内低叶酸水平者,适量补充叶酸可改善CAG的组织学改变;胃黏膜保护剂可改善胃黏膜屏障,促进胃黏膜糜烂愈合,但对萎缩的改善作用尚有争议。CAG的中医诊疗共识意见中,将CAG分为肝胃气滞证、肝胃郁热证、脾胃虚弱证、脾胃湿热证、胃阴不足证、胃络瘀血证六型,分别采用柴胡疏肝散、化肝煎合左金丸、黄芪建中汤、连朴饮、一贯煎合芍药甘草汤、失笑散合丹参饮加减治疗。中成药如胃复春、摩罗丹等主治萎缩性胃炎。然而,目前缺乏关于胃黏膜保护剂、叶酸、中药对胃癌前状态治疗作用的高质量研究,值得引起关注。
尽管环氧合酶抑制剂可能具有一定减缓癌前状态发展的作用,但尚无证据支持人群的大规模使用。一项包括52 161例胃癌高危患者的回顾性研究表明,长期使用NSAID(包括阿司匹林)可降低相关胃癌发生率,推测环氧合酶抑制剂可通过抑制与癌症相关的前列腺素、细胞因子和血管生成因子,从而降低癌变发生率。目前尚无高质量的前瞻性试验确定环氧合酶抑制剂对癌前状态有抑制作用。环氧合酶-2选择性抑制剂预防胃癌发生的作用也未得到证实,仍需进一步研究确定环氧合酶-2抑制剂(如塞来昔布)在药物干预癌前状态中的作用。
四、胃黏膜癌前状态和癌前病变的监测和随访
【陈述20】累及全胃的重度CAG(OLGA系统和OLGIM系统分期为Ⅲ和Ⅳ期)建议每1~2年复查高清内镜,轻中度、局限于胃窦的CAG建议每3年复查胃镜。
证据质量:中
推荐等级:高
萎缩和肠化生的严重程度与胃癌发生存在相关性,OLGA系统和OLGIM系统分期为Ⅲ和Ⅳ期患者的胃癌发生风险显著增加,胃窦和胃体黏膜广泛萎缩也是胃癌的危险因素。目前认为肠型胃癌的发生包括从H.pylori相关性胃炎、萎缩性胃炎、肠化生到IN的多步过程,对处于癌前阶段的胃癌高危人群进行监测随访有助于早期胃癌的诊断与治疗。尽管全球各地区H.pylori感染率有较大差异,但胃癌前状态在各地区的普通人群中均较常见。据报道,CAG患者的胃癌年发生率为0.1%~0.25%,肠化生患者的胃癌年发生率为0.25%。一项日本研究认为,广泛黏膜萎缩患者的胃癌5年累积发病率更高,达1.9%~10%,肠化生患者达5.3%~9.8%。癌前状态的进展程度同胃癌家族史一样,被认为是胃癌的危险因素之一。对于局限于胃窦的生理性轻中度萎缩性胃炎患者,无须复查胃镜;局限于胃窦的病理性轻中度萎缩性胃炎患者,建议每3年复查胃镜;对于单一黏膜部位肠化生伴胃癌家族史、或存在顽固H.pylori相关胃炎的患者,可考虑3年内复查胃镜;对于伴有肠化生的轻中度萎缩性胃炎患者,可每2~3年复查胃镜;对于累及全胃的重度CAG伴肠化生患者,则建议每1~2年复查高清胃镜。
【陈述21】肠化生的随访策略取决于胃黏膜萎缩的严重程度,伴有肠化生的轻中度萎缩性胃炎可每2~3年复查胃镜。
证据质量:中
推荐等级:中
萎缩和肠化生的严重程度与胃癌发生存在相关性,OLGA系统和OLGIM系统分期为Ⅲ和Ⅳ期患者的胃癌发生风险显著增加,胃窦和胃体黏膜广泛萎缩也是胃癌的危险因素。尽管胃黏膜单一部位的肠化生患者也存在胃癌风险,但多数情况下该类患者无须进行监测,特别是内镜检查已排除严重萎缩性胃炎者。对于单一黏膜部位肠化生伴胃癌家族史或持续存在H.pylori相关胃炎的患者,可考虑3年内复查内镜;对于伴有肠化生的轻中度萎缩性胃炎患者,可每2~3年复查胃镜。
【陈述22】高清染色内镜显示边界不清的LGIN建议每年复查高清染色内镜,边界清晰、未行内镜治疗的LGIN建议每6个月复查高清染色内镜。
证据质量:低
推荐等级:中
普通内镜下边界不清的LGIN应进行高清染色内镜检查并广泛活检取样,若经病理证实为LGIN,则应在1年内再次进行内镜检查;高清染色内镜探查到边界清晰的LGIN,经病理证实后,建议与患者沟通后行局部微创治疗;若探查到边界清晰、未行内镜治疗的LGIN则建议每6个月复查高清染色内镜。因目前LGIN转归的临床研究证据有限,对于LGIN的处理需要谨慎。
【陈述23】行内镜下治疗的IN或早期胃癌,建议治疗后3~6个月复查高清染色内镜,并按照胃黏膜的基础状态确定随访间隔。
证据质量:中
推荐等级:中
IN或早期胃癌于ESD或EMR治疗后出现复发和异时性肿瘤的风险很高,据报道发生率为10%~20%。因此有必要进行定期内镜随访,以早期发现病变并及时采取内镜下治疗。尽管关于早期胃癌ESD术后随访时间的研究较少,但从目前研究表明大多数术后复发或异时性肿瘤发生在手术后的第1年。因此,建议对行内镜下治疗IN或早期胃癌的患者于术后3~6个月复查高清染色内镜,如未发现病变,则按照胃黏膜萎缩或肠化生的状态确定复查间隔,必要时每年进行复查。
【陈述24】合理的胃黏膜癌前状态和癌前病变的监测、随访,对于胃癌发生风险较高的对象尤其具有较好的卫生经济学效益。
证据质量:中
推荐等级:中
不同国家地区的经济发展水平和胃癌患病率不同,针对胃黏膜癌前状态的监测方案也有所不同。一项针对美国人群进行的胃黏膜癌前状态和癌前病变监测的建模发现,对50岁以上经EMR治疗的IN患者行定期监测具有成本效益优势,效益比为39 800美元/质量调整生命年(quality-adjusted life years,QALY)。欧洲一项成本效益分析对50~75岁胃黏膜癌前状态患者行每3年1次胃镜检测(对比方案为无检测),效益比为18 336欧元/QALY,低于成本效益阈值36 575欧元。研究显示在中低风险胃癌地区的癌前状态人群中每1~3年进行1次检测是符合卫生经济效益的。我国为胃癌高发地区,因此其成本效益可能更高。基于我国国情,初步制定了我国胃黏膜癌前状态和癌前病变的处理和监测流程(图3)。
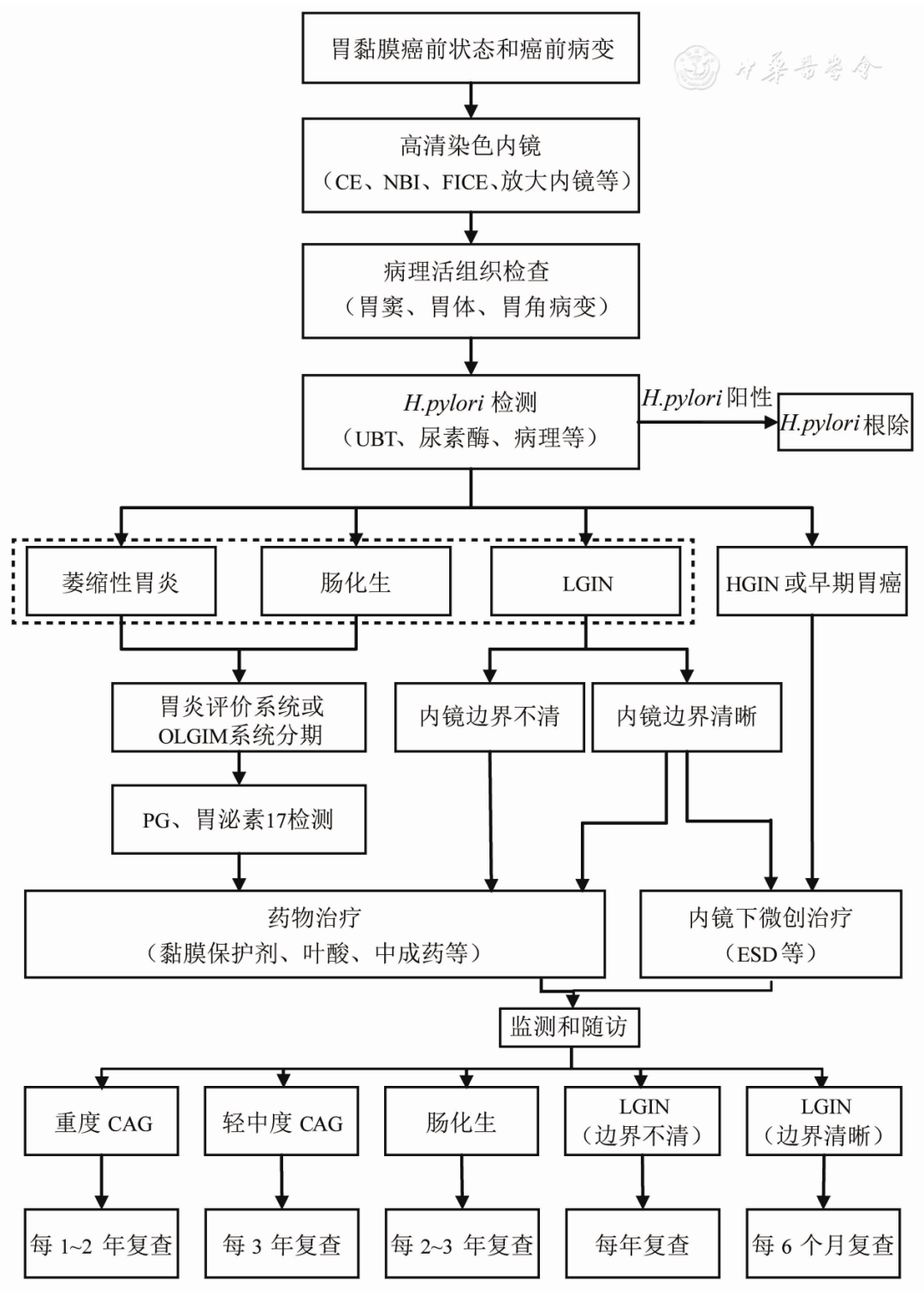
注:CE为化学染色内镜;NBI为窄带成像技术;FICE为内镜电子分光图像处理;H.pylori为幽门螺杆菌;UBT为尿素呼气试验;LGIN为低级别上皮内瘤变;HGIN为高级别上皮内瘤变;OLGIM为基于肠化生的胃炎评价;PG为胃蛋白酶原;ESD为内镜黏膜下剥离术;CAG为慢性萎缩性胃炎;虚线框内为胃癌前状态和癌前病变
▲图3 胃黏膜癌前状态和癌前病变的处理和监测流程
五、结语
本共识是我国首部关于胃黏膜癌前状态和癌前病变处理策略的专家共识,针对癌前状态的定义、诊断和分期、治疗、监测和随访制定了详尽的推荐意见。本共识尚存在一些局限性,如部分条目尚缺乏有力的临床证据支撑,尤其是缺少国内的高质量研究结果,但不妨碍本共识对于该类疾病临床诊治的指导意义,期待其在我国今后胃癌防控工作中发挥积极的作用。
参与本共识意见制定的专家(按姓氏汉语拼音排序):陈旻湖(中山大学附属第一医院消化科),陈卫昌(苏州大学附属第一医院消化科),陈烨(南方医科大学南方医院消化科),杜奕奇(海军军医大学长海医院消化科),房静远(上海交通大学医学院附属仁济医院消化科),李汛(兰州大学第一医院普外科),李兆申(海军军医大学长海医院消化科),令狐恩强(解放军总医院消化科),陆红(上海交通大学医学院附属仁济医院消化科),吕宾(浙江中医药大学附属第一医院消化科),吕农华(南昌大学第一附属医院消化科),沙卫红(广东省人民医院消化科),唐承薇(四川大学华西医院消化科),王贵齐(中国医学科学院肿瘤医院内镜科),吴开春(空军军医大学西京医院消化科),许建明(安徽医科大学长海医院消化内科),曾志荣(中山大学附属第一医院消化科),张国新(南京医科大学第一附属医院消化科),张振玉(南京市第一医院消化科),郑建明(海军军医大学长海医院病理科),周丽雅(北京大学第三医院消化科),周平红(复旦大学附属中山医院内镜中心),朱惠云(海军军医大学长海医院消化科),祝荫(南昌大学第一附属医院消化科),左秀丽(山东大学齐鲁医院消化科)
主要执笔者:杜奕奇(海军军医大学长海医院消化科),朱惠云(海军军医大学长海医院消化科),周显祝(海军军医大学长海医院消化科),朱春平(海军军医大学长海医院消化科)
本文来源:中华消化杂志, 2020,40(11) : 731-741.
查看更多