查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





骨巨细胞瘤(GCTB)是一种罕见的局部侵袭性骨肿瘤,肿瘤可破坏骨组织并侵及周围的软组织,导致疼痛,活动受限,甚至发生转移。外科手术是标准的治疗方式,但15%~50%[1-3]的患者会出现术后复发。对于无法手术的患者,更缺乏有效的治疗手段。
2019年11月,一项发表在《柳叶刀·肿瘤学》(Lancet Oncol)的研究证实了地舒单抗治疗GCTB患者的有效性及安全性,这也是迄今发表的有关地舒单抗治疗GCTB样本量最大、随访时间最长的研究[4]。地舒单抗是核因子κB受体活化因子配体(RANKL)的全人化单克隆抗体,对可溶性、跨膜形式的人RANKL具有高度亲和力和特异性,通过抑制GCTB基质细胞分泌的RANKL可显著减少或消除破骨细胞样肿瘤相关巨细胞,使骨质溶解减少,控制疾病进展,改善临床结局。
郭卫 教授
北京大学人民医院骨肿瘤科主任,骨肿瘤研究室主任
北京大学人民医院骨科教研室主任
北京大学二级教授,主任医师,博士生导师
亚太地区骨肿瘤学会(APMSTS)前任主席
国际保肢学会(ISOLS)前任主席
中华医学会骨科学会骨肿瘤学组组长(2005-2017)
中国医师学会骨科分会骨肿瘤专业委员会主任委员
中国抗癌协会骨肿瘤和骨转移瘤专业委员会主任委员
国际骶骨骨盆肿瘤研究协作组(Sacral and Pelvic Tumor Study Group) 主席
SICOT中国部骨肿瘤专业委员会主任委员
中国抗癌协会肉瘤专业委员会副主任委员
海峡两岸医药卫生交流协会骨科专业委员会副主任委员
中国医疗保健促进会软组织肿瘤分会副主任委员
中国医师学会骨科分会3D打印专业委员会副主任委员
这项多中心、开放标签的II期临床研究,从12个国家共计30个研究中心纳入经组织学确诊为GCTB,并且可通过影像学检查进行评估的患者。入组标准为成人或骨骼已成熟的青少年(≥12岁),体重≥45 kg,KPS评分≥50%(或ECOG评分0、1或2)且一年内经影像学检查评估为活动性病变者。符合条件的入组患者被分为3个队列,队列1为不可手术切除的GCTB患者,队列2为可手术切除但术后可能存在严重并发症的GCTB患者,队列3为既往开展的一项地舒单抗相关研究纳入的GCTB患者。
队列1和队列2接受地舒单抗治疗(120 mg皮下注射,每四周1次),并在第8天和第15天接受负荷剂量(120 mg皮下注射),队列3不接受负荷剂量。主要研究终点为地舒单抗治疗的安全性,通过不良反应事件的类型、发生率和严重程度评价;次要研究终点为队列1患者疾病进展的时间和队列2患者在入组6个月时仍未接受手术治疗者所占的比例。
2008年9月9日至2016年2月25日,研究共纳入532例患者(队列1为267例,队列2为253例,队列3为12例)。截止2017年2月24日,中位随访时间为58.1个月(IQR为34.0~74.4),其中队列1为65.8个月(IQR为40.9~82.4),队列2为53.4个月(IQR为28.2~64.1),队列3为76.4个月(IQR为61.2~76.5)。所有队列中位治疗时间为32.3个月(IQR为16.3~59.9),其中队列1的中位治疗时间为44.4个月(IQR为23.8~69.3),队列2为20.1个月(IQR为13.4~45.6),队列3为71.4个月(IQR为48.9~76.5)。
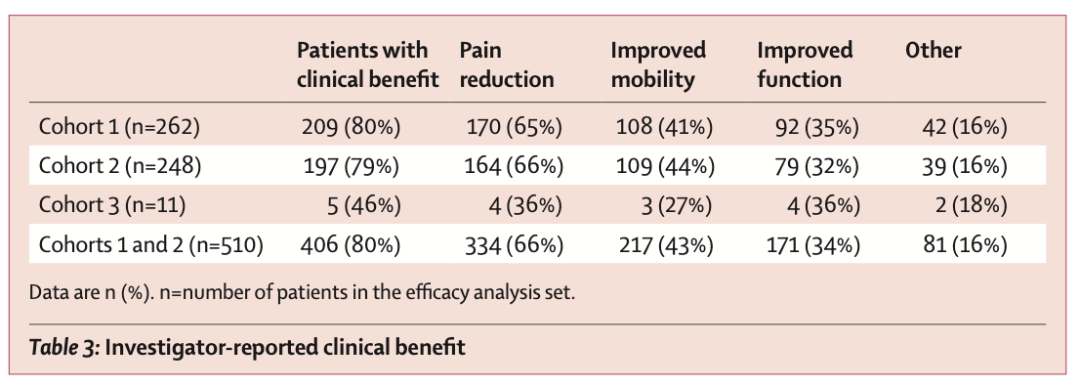
队列1患者疾病进展或复发的中位时间未达到(28例出现进展或复发);队列2患者接受了至少1次地舒单抗治疗后,在入组6个月时仍未接受手术治疗者所占比例为92%(95% CI 87%~95%)。队列1和队列2接受地舒单抗治疗患者中获得临床症状改善的比例为80%,包括疼痛缓解(66%)、骨关节活动能力提升(43%)、功能改善(34%)及其他(16%)。队列1和队列2接受地舒单抗治疗患者中疾病进展的比例小于1%。
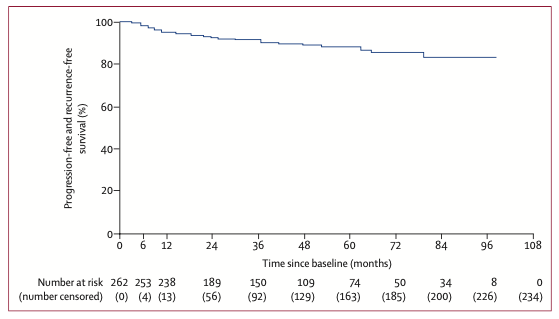
图1 队列1患者疾病进展或复发的时间(第一治疗阶段)
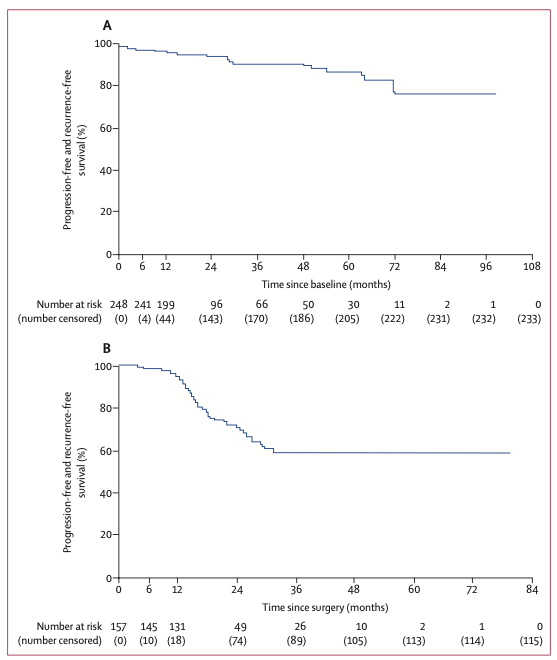
图2 队列2患者疾病进展或复发的时间(A为248例所有进行有效性分析的患者,B为157例接受手术治疗的患者)
表1 研究者评估的患者获益
治疗期间,不良反应与之前的报道一致,未见新的不良反应事件。用药期间需要定期进行牙齿卫生检查并保持良好的口腔健康,同时补充钙剂和维生素D。
本研究是迄今为止最大规模的GCTB临床研究,研究证实了地舒单抗治疗GCTB的有效性和安全性。在先前发表的有关接受地舒单抗预防骨相关事件的骨转移晚期肿瘤患者的研究仅使用地舒单抗治疗约24个月,因此,本研究提供了更长时间治疗的更多安全数据。
本中心回顾性统计了上百例手术风险高、复发风险高或是术后严重影响生活质量的GCTB患者使用地舒单抗进行新辅助、辅助治疗的疗效和安全性数据,涉及骶骨、盆骨、桡骨等骨巨细胞瘤。术前新辅助使用地舒单抗可使肿瘤外科边界清晰实现外科降级、缩短手术时间、减少术中出血、利于修复重建,尤其对于骶骨GCTB患者选择地舒单抗新辅助联合保守手术能够在降低复发率的基础上保留更多的正常功能。同时本中心患者使用地舒单抗术后辅助治疗的复发率和中位复发时长也优于历史无新辅助、辅助治疗数据。本中心中国人群数据也应证了该研究队列2中的研究结果,同样证明地舒单抗应用于中国可切除GCTB患者的疗效和安全性。
参考文献:
[1]Szendroi M. Giant-cell tumour of bone. J Bone Joint Surg Br 2004; 86: 5–12.
[2]Xu SF, Adams B, Yu XC, Xu M. Denosumab and giant cell tumour of bone—a review and future management considerations. Curr Oncol 2013;20: e442–47.
[3] Malawer MM, Helman LJ, O’Sullivan B. Sarcomas of bone. In: DeVita VT, Lawrence TS, Rosenberg SA, eds. Principles & practice of oncology, volume 2. Philadelphia, PA: Lippincott Williams & Wilkins, 2008: 1794–834.
[4] Chawla S, Blay JY, Rutkowski P, et al. Denosumab in patients with giant-cell tumour of bone: a multicentre, open-label, phase 2 study. Lancet Oncol. 2019;20(12):1719-1729.
查看更多