查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





乳腺癌(BC)是女性高发瘤种,严重威胁女性健康。高达60%~70%的晚期BC患者会出现骨转移,进而发生骨痛、骨折、脊髓压迫等临床症状,严重影响患者的生活质量和长期生存。核因子κB受体活化因子配体(RANKL)/核因子κB受体活化因子(RANK)通路已被证实在骨代谢过程中起到关键作用,RANKL抑制剂地舒单抗通过特异性阻断RANK及其配体RANKL结合,抑制骨破坏,在治疗骨转移、延缓及降低骨相关事件(SREs)风险方面应用广泛。
除此之外,临床前研究发现,除了成骨、破骨细胞以外,免疫细胞也表达RANK/RANKL,该通路或能发挥一定的免疫调节作用。本文梳理了RANKL/RANK通路在乳腺肿瘤免疫治疗领域相关研究进展,以期为临床实践提供一些思路。

张莉莉 教授
江苏省肿瘤医院
江苏省肿瘤医院内科主任医师,硕士生导师,病区主任
中国抗癌协会乳腺癌专业委员会委员
江苏省肿瘤专业质控中心乳腺癌质控专家委员会主任委员
江苏省医学会肿瘤化疗与生物治疗分会乳腺癌学组副组长
中国医师协会肿瘤医师分会乳腺癌学组委员
中国女医师协会临床肿瘤专业委员会常委
江苏省肿瘤防治联盟乳腺癌专家委员会委员
主要从事乳腺癌的临床、科研及教学工作,擅长乳腺癌的内科诊治,主持及参与多项乳腺癌相关的科研课题,承担多项乳腺癌相关新药、新方案的国际及国内多中心临床研究。
2020年,BC在全世界范围内发生病例数首次超过肺癌,成为全球最常见的癌症,约占新发癌症病例的11.7%(图1),占女性新发癌症病例的24.5%1(图2)。
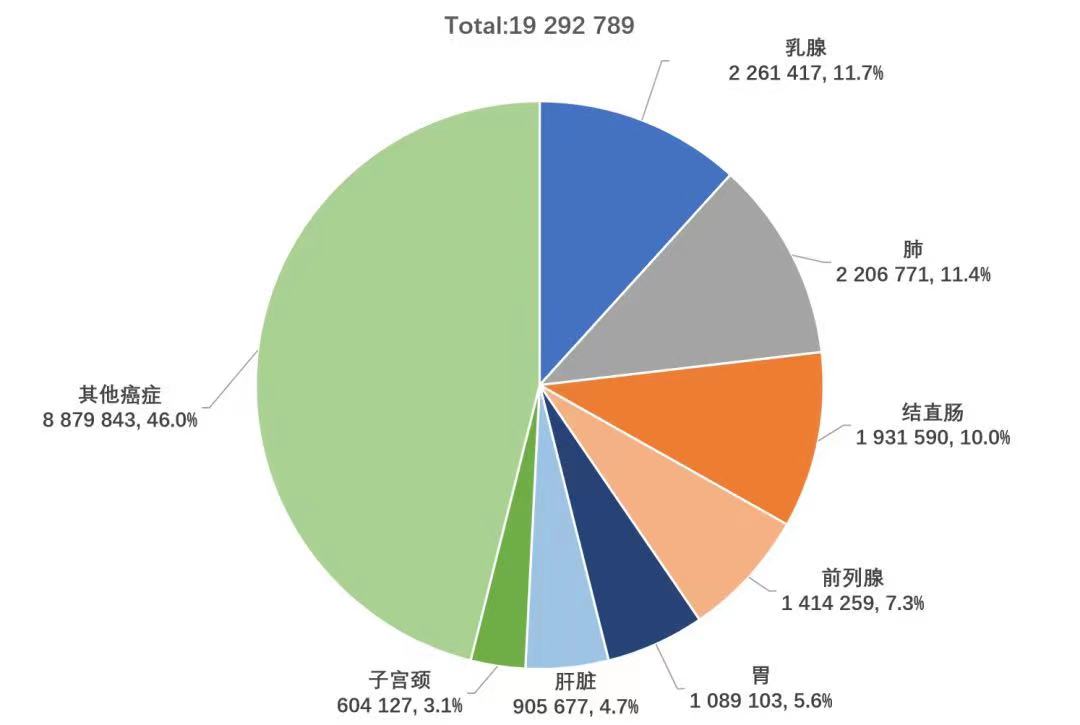
图1. 2020全球各瘤种发生例数统计
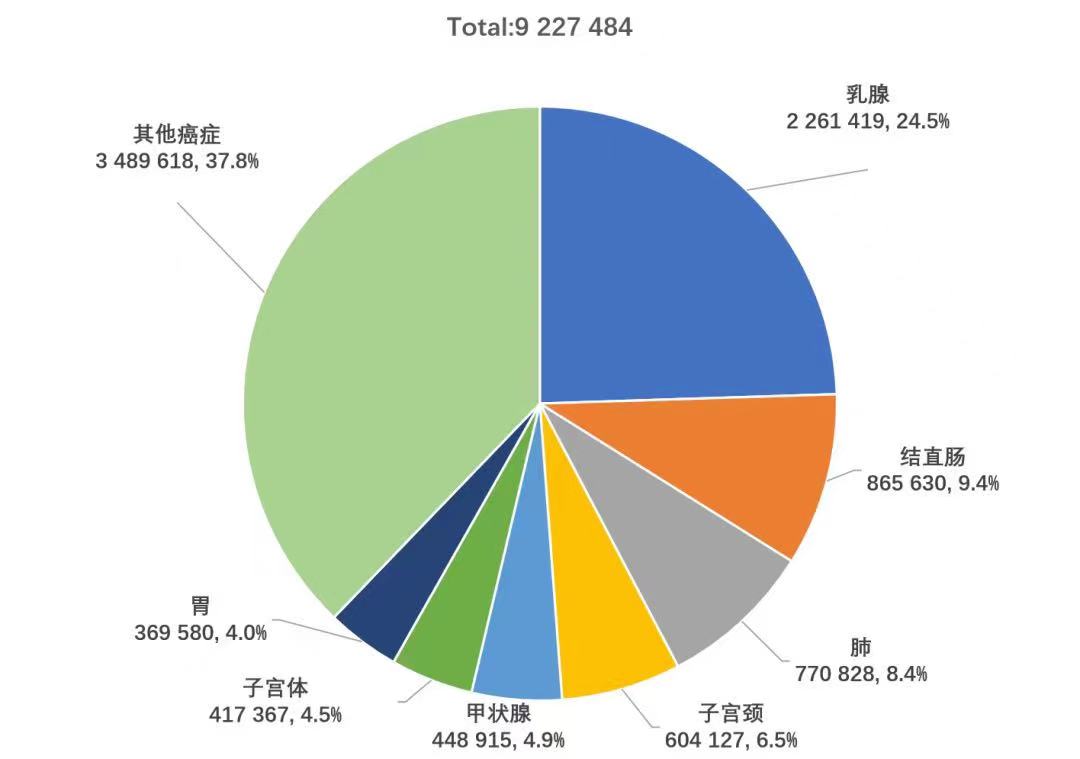
图2. 2020全球女性各瘤种发生例数统计
大多数BC具有免疫浸润低,对免疫治疗不敏感的特点。即使在免疫原性相对较高的三阴乳腺癌(TNBC)患者中,免疫治疗获益人群也十分有限,RANKL/RANK通路已被证实参与多种免疫过程,有研究发现RANKL抑制剂或能发挥一定免疫调节作用,提高肿瘤免疫活性2。
BC免疫治疗获益人群有限
KEYNOTE-355 帕博利珠单抗联合化疗对比化疗一线治疗TNBC的临床试验中,仅综合阳性评分(CPS)≥10 的人群显示总生存期(OS)获益,总人群未显示OS获益3 。Impassion130研究中,阿替利珠联合白蛋白紫杉醇(A+nP)一线治疗TNBC患者也只有PD-L1+的患者获益,随后从美国食品药品监督管理局(FDA)撤回了相关适应证申请。帕博利珠单抗单药二线治疗TNBC的KEYNOTE-119试验中,ITT人群也未显示其治疗效果优于化疗组,仅分层分析显示PD-L1+CPS≥20的患者客观缓解率(ORR)、无进展生存期(PFS)、OS得到显著改善。然而PD-L1+CPS≥10的人群只占总人群的38%,PD-L1+CPS≥20的人群只占18%4,免疫治疗的获益人群有限。如何扩大获益人群,针对BC免疫微环境特点,免疫治疗联合其他方案或能带来新的突破。
免疫联合RANKL抑制剂
或可提高BC患者获益
●基础研究:RANKL/RANK通路协同参与肿瘤免疫逃逸
有研究报道发现,与RANK+/+小鼠相比,RANK-/-小鼠具有更长的肿瘤潜伏期5, 随后在研究中发现在RANK+/+肿瘤小鼠模型中,单用RANKL抑制剂或PD-L1均未减少肿瘤生长, 而RANKL抑制剂+PD-L1抑制剂可降低50%肿瘤生长,提示RANKL/RANK通路或是肿瘤细胞实现免疫逃逸的另一路径;但在RANK-/-肿瘤小鼠模型中使用PD-L1抑制剂即可显著抑制肿瘤生长,进一步验证了RANKL/RANK信号通路参与了免疫逃逸2(图3)。
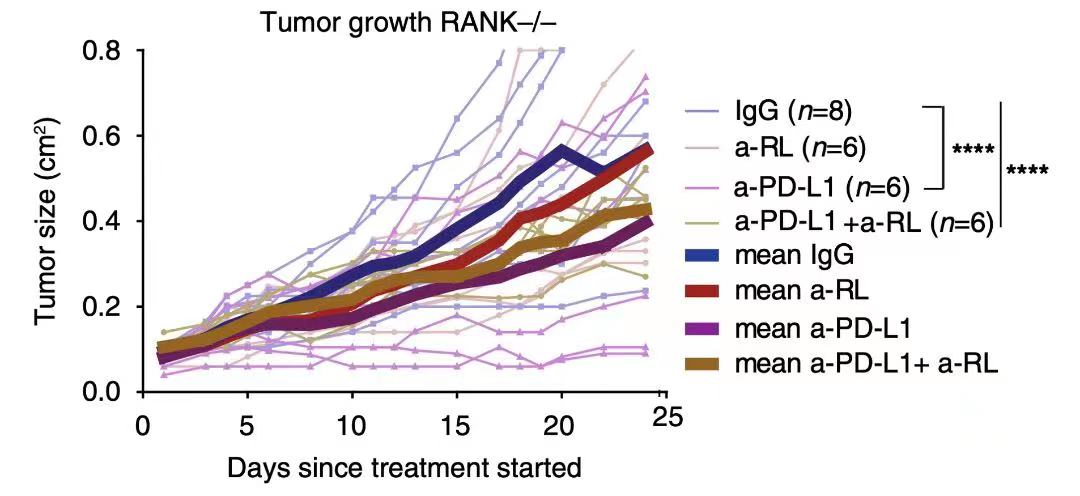
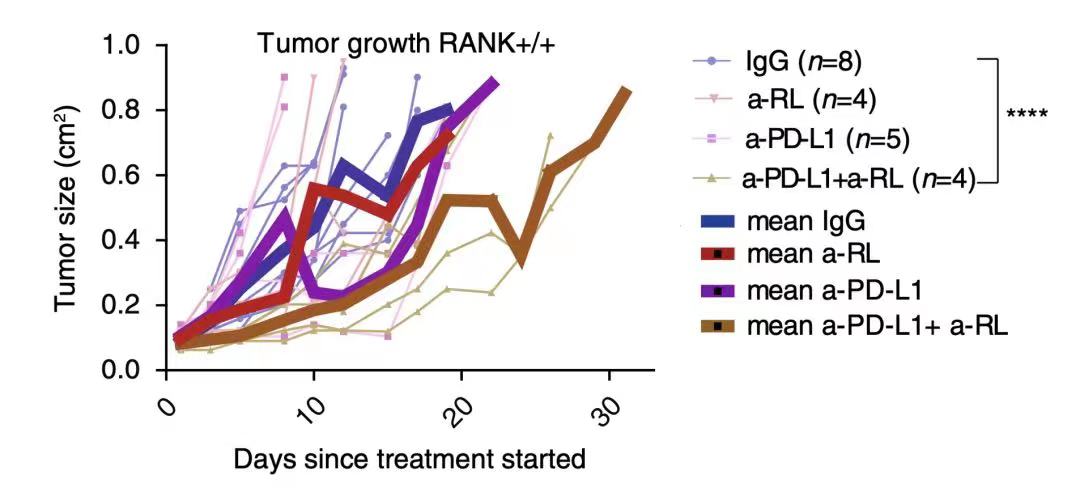 图3. IgG:空白对照组;a-RL:单用RANKL抑制剂组 ;a-PD-L1:单用PD-L1抑制剂组;a-PD-L1+a-RL:PD-L1抑制剂和RANKL抑制剂联合使用组
图3. IgG:空白对照组;a-RL:单用RANKL抑制剂组 ;a-PD-L1:单用PD-L1抑制剂组;a-PD-L1+a-RL:PD-L1抑制剂和RANKL抑制剂联合使用组
●临床研究:RANKL抑制剂可能通过调节免疫微环境协同免疫检查点抑制剂(ICIs)发挥抗肿瘤作用
2020年12月发表在Nat Commun杂志上的D-BEYOND研究显示:使用RANKL抑制剂地舒单抗新辅助治疗早期BC患者,Ki-67没有明显影响,说明地舒单抗不能直接抑制肿瘤细胞增殖;但是肿瘤浸润淋巴细胞(TILs)水平,特别是CD8+T细胞显著增加2(图4)。
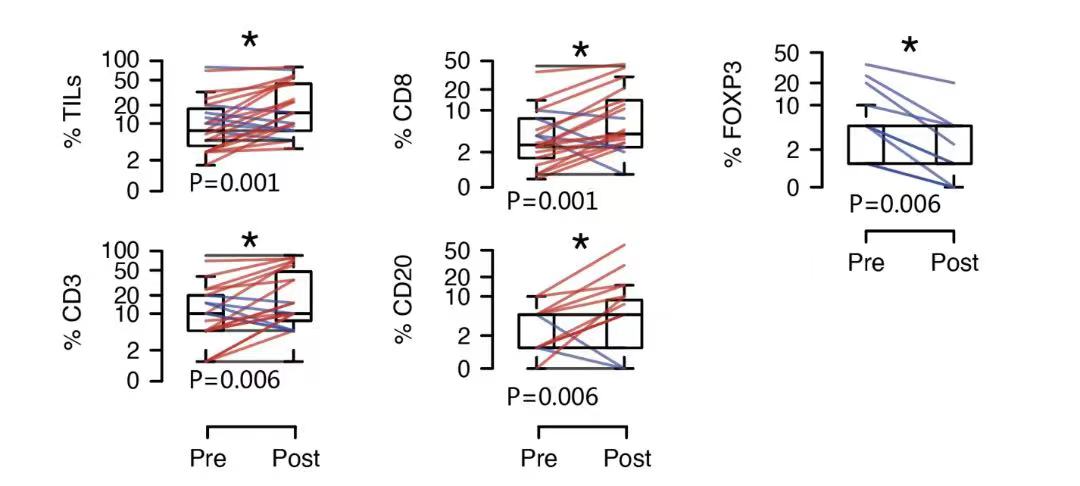
图4. CD3标记T细胞;FOXP3标记Treg细胞;CD20标记B细胞;CD8标记T细胞
2021SABCS大会报道的另一项在早期HER-2阴性BC患者中开展的临床研究(D-Biomark),同样证实了地舒单抗(试验组)可以提高TILs6(图5)。
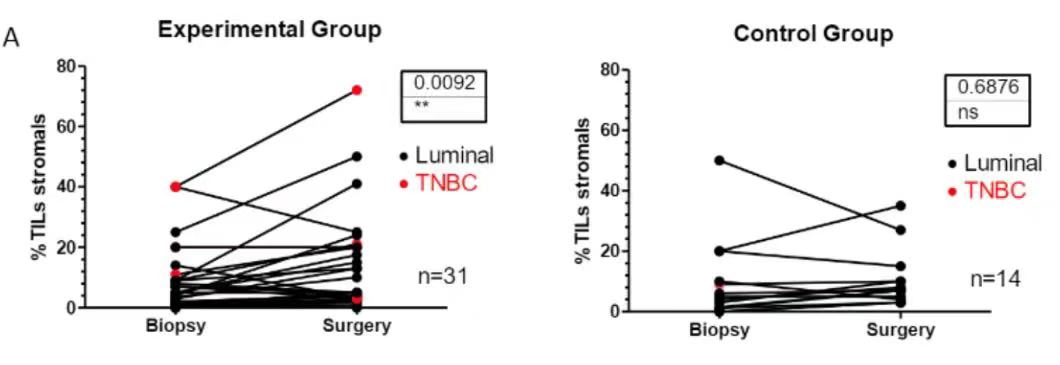
图5. Biopsy:基线水平;Surgery:试验组第1、8天分别接受120 mg地舒单抗皮下注射,Control组不接受治疗,2~4周后手术,取血液、肿瘤样本
关于RANKL抑制剂解除免疫抑制的机制:肿瘤细胞中RANK高表达导致免疫微环境受到抑制2,相关促炎细胞因子/趋化因子的表达,导致肿瘤微环境募集了更多肿瘤相关巨噬细胞(TAMs)、肿瘤相关中性粒细胞(TANs),从而干扰T细胞的募集和活性,形成免疫抑制。RANKL抑制剂阻断RANKL/RANK通路,增加T细胞浸润,从而解除由于RANKL/RANK过表达引起的免疫抑制(图6)。该理论可能能够支持RANKL抑制剂联合ICI使BC患者从中获益。
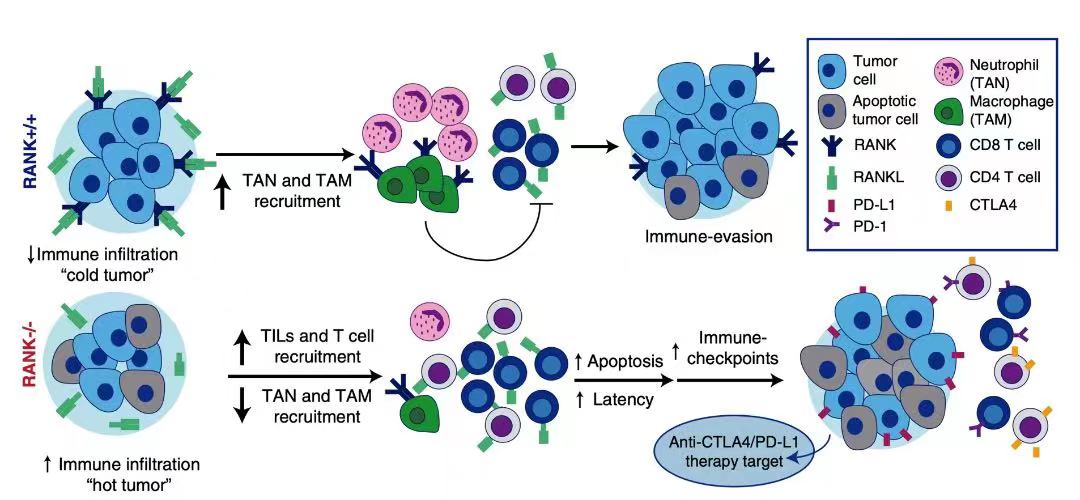
图6. RANK通路在BC中的免疫调节作用
▼专家点评▼
RANKL/RANK通路在骨代谢中发挥关键调节作用,地舒单抗作为全人源单克隆抗体,特异性阻断RANKL/RANK通路,在治疗骨转移方面发挥重要作用,已有多项研究表明与唑来膦酸相比,地舒单抗疗效更优,能够显著延长首次发生SRE的时间超过8.2个月。
另外RANKL/RANK信号通路通过多种方式参与乳腺肿瘤的起始和进展过程,同时在免疫系统中,该通路参与了淋巴结发育、单核细胞、树突状细胞、T细胞的活化以及中枢、外周免疫耐受的建立7。目前看来,抑制RANKL/RANK信号通路除了预防SREs方面的作用外,在乳腺肿瘤的抗肿瘤治疗中也非常值得关注。RANKL抑制剂地舒单抗可能通过增强免疫应答并使耐药肿瘤对免疫治疗产生应答,与ICIs联用可能对于乳腺肿瘤具有协同增效作用,这或许是一种值得探索的治疗策略。
目前针对多种瘤种的临床试验正在进行中,2021年WCLC大会上报道地舒单抗联合ICI可延长高骨肿瘤负荷(HBTB)(≥3处骨转移)晚期非小细胞肺癌(NSCLC)患者生存期8,这无疑加强了我们对这一治疗方案的探索信心,为了阐明这种双通路抑制策略在肿瘤治疗中的优势机制,需要开展更多的研究,解决临床实践问题9。我们期待更多的试验数据支持指导临床用药探索。
参考文献:
1.
2. Gómez-Aleza C, et al. Nat Commun, 2020, 11: 6335.
3. Cortes J, et al. Lancet, 2020, 396: 1817-1828.
4. Cortes J, et al. 2019 ESMO Abstract LBA 21
5. Yoldi G, et al. Cancer Res, 2016; 76: 5857–5869.
6. Andrea V, et al. 2021 SABCS Abstract #866
7. Gómez-Aleza C, et al. Oncoimmunology, 2021, 10: 1923156.
8. 2021 World Conference on Lung Cancer
9. Simatou A, et al. Int J Mol Sci, 2020, 21: undefined.
▼往期精彩回顾▼
牛晓辉教授:精准骨靶向药物——RANKL抑制剂地舒单抗的研发历程
查看更多