查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





来源:药明康德
近日,美国FDA宣布,批准诺华(Novartis)集团公司Advanced Accelerator Applications的Lutathera(lutetium Lu 177 dotatate)治疗生长抑素受体阳性的胃肠胰腺神经内分泌肿瘤(GEP-NET)。这也是美国FDA批准的首款多肽受体放射性核素疗法(PRRT)。
神经内分泌肿瘤(NET)是一类罕见的肿瘤,能病发于胃肠道、胰腺、肺等诸多器官中的神经内分泌细胞。罹患这类肿瘤的患者表现不一,有些患者会由于体内激素的过度产生而出现症状,而有些患者则能多年无症状。虽然这类肿瘤并不常见,但一旦患病,就会给患者的生命带来很大的影响,据估计,一旦肿瘤出现分化,发生远端转移,这些患者的5年生存率就会只有35%。创新疗法也就成了这些患者的救命稻草。
本次获批的Lutathera是一款放射性药物,能结合肿瘤细胞表面的生长抑素受体,并进入细胞,通过放射性对肿瘤细胞造成损伤。之前,它曾获得美国FDA的孤儿药资格,也曾获得优先审评资格。
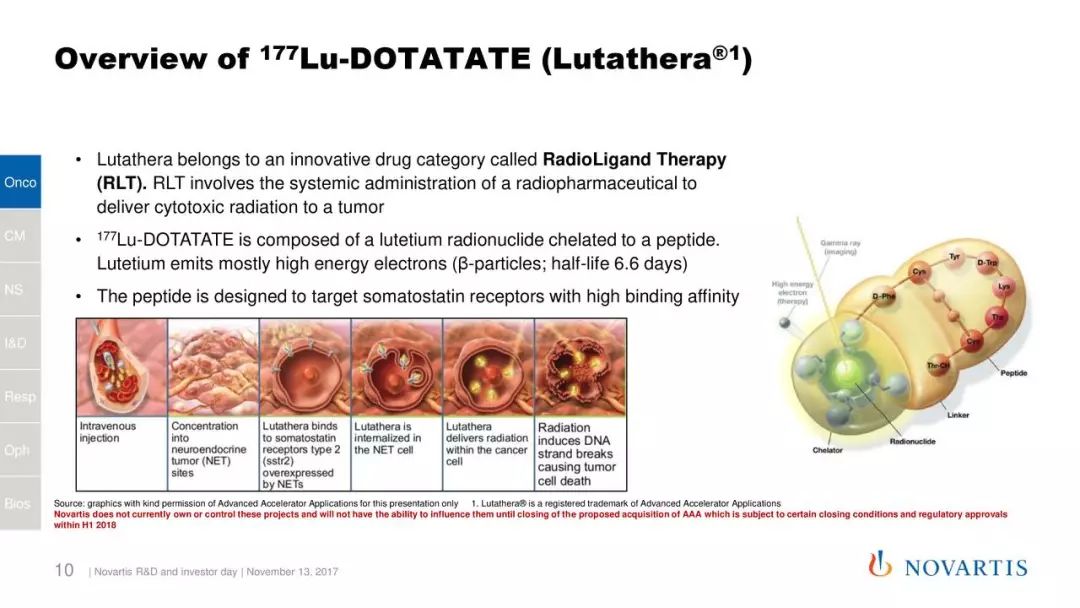 Lutathera的作用机理(图片来源:诺华)
Lutathera的作用机理(图片来源:诺华)
在两项关键的3期临床试验里,这款新药的疗效得到了验证。在第一项试验中,与最佳的标准护理手段(每四周30mg octreotide LA)相结合,Lutathera显示出了良好的效果,能降低79%的疾病进展或死亡风险(HR 0.21,95% CI:0.13-0.32;p<0.001);在第二项试验里,在1214名生长抑素受体阳性的肿瘤患者中,Lutathera在360名GEP-NETs患者组成的亚群里,让16%的患者出现部分肿瘤缩小。值得一提的是,第二项临床试验招募的患者是FDA“扩大使用”(expanded access)项目的一部分,该项目能让罹患严重而危及生命疾病的患者获得在研新药,进行治疗。基于这两项试验的数据,FDA也决定批准这款新药上市,造福患者。
“GEP-NETs是一类罕见的癌症,在初始治疗失败后,肿瘤会继续生长,而患者的治疗选择很有限,”美国FDA肿瘤学卓越中心主任和血液病学与肿瘤学产品办公室执行主任Richard Pazdur博士说道:“这项批准为这些罕见癌症的患者带来了新的治疗方案。这也彰显了FDA愿意考虑‘扩大使用’项目中的数据,来支持新疗法的批准。”
 Lutathera有望给更多患者带来治疗的希望(图片来源:Carcinoid Cancer Foundation)
Lutathera有望给更多患者带来治疗的希望(图片来源:Carcinoid Cancer Foundation)
“Lutathera的获批标志这一个重要的成就,也是对NET癌症群体的一个重要创新,” Advanced Accelerator Applications的主席兼总裁Susanne Schaffert博士说道:“在30多年来,诺华一直开发NET和类癌综合征的疗法,支持NET群体。我们将一道推进创新核医学疗法,治疗NET在内的多种肿瘤类型。我想不到有什么更好的方法,来庆祝我们两家公司的合作与未来。”
我们祝贺诺华与Advanced Accelerator Applications斩获这款新药的获批,也期待更多创新疗法能层出不穷,造福患者。
查看更多