查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过








各种细菌细胞膜上的PBP数目、相对分子质量、对β内酰胺类抗生素的敏感性不同,但分类学上相近的细菌,其PBP 类型及生理功能基本相似。例如大肠埃希菌有7 种PBP,其中PBP1a,PBP1b,PBP2,PBP3 具有转肽酶的活性,PBP1a和PBP1b 与细菌的伸长有关,PBP2与细菌的形状有关,PBP3 与细菌的分裂有关,PBP4,PBP5,PBP6 则与羧肽酶等的活性有关,可以控制细胞壁交叉连接的程度。PBP1,PBP2,PBP3 是细菌的存活、生长繁殖所必需,PBP4,PBP5,PBP6 则重要性略差。β内酰胺类抗生素与PBP 结合后,先引起细菌形态的改变,最终导致细菌被杀灭。不同抗生素与PBP 结合的主要部位亦有不同,如头孢噻吩与PBP1a,PBP1b 有高度亲和力,使细菌生长繁殖和伸长受抑制,并溶解死亡细胞。美西林则主要与PBP2 结合,细菌形成大圆形细胞,对渗透压的改变较稳定,细菌可继续生长几代后才溶解死亡。多数青霉素类或头孢菌素类抗生素达一定浓度时主要与PBP1 和(或)PBP3 结合,形成丝状体和球形体,然后细菌发生变形萎缩,逐步溶解死亡。肠球菌属的PBP不易与头孢菌素类结合,造成肠球菌属对头孢菌素类天然耐药。(摘自汪复,张婴元《实用抗感染治疗学》)

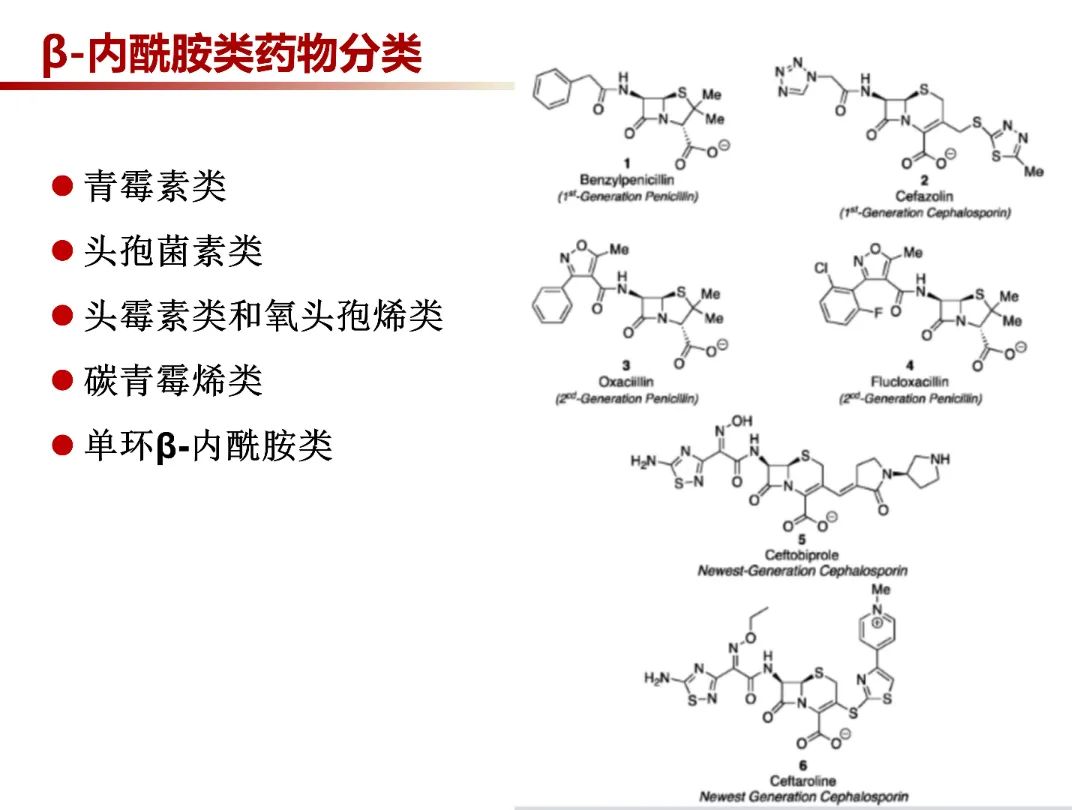
β-内酰胺类药物共同点是化学结构上都有β-内酰胺环,其侧链的改变形成了具有不同抗菌谱和抗菌作用的抗生素。这类抗菌药物具有杀菌活性强、毒性低、适应证广及临床疗效好的优点。
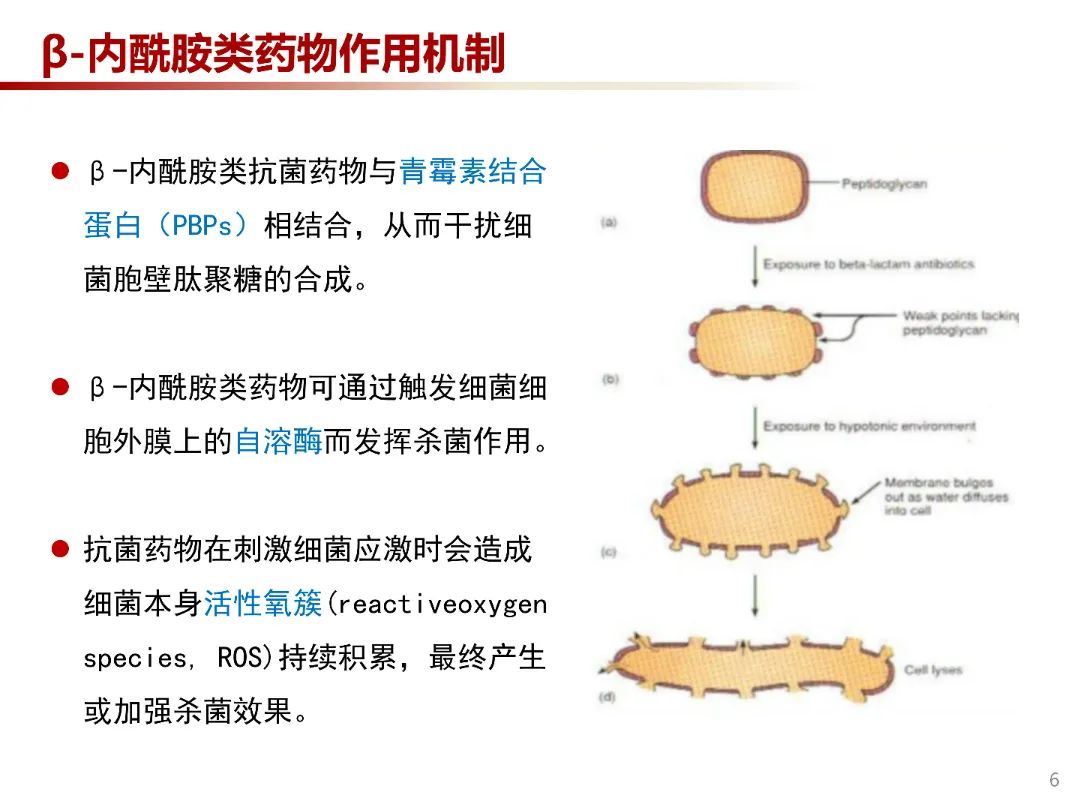
青霉素类、头孢菌素类和其他ß 内酰胺类抗生素相同,均系通过与位于细菌细胞膜上的PBP紧密结合,干扰细菌细胞壁的合成而产生抗菌作用。
不同的β内酰胺类抗生素,结合的PBP类别不同,如哌拉西林,为酰脲类青霉素,与PBP3有高度亲和力,与PBP2有中度亲和力,高浓度时与PBP-1a、1b 也有较强的亲和力。由于其与铜绿假单胞菌生存所必需的PBP 形成多位点结合,并对细菌细胞膜具有强大的穿透作用,因此哌拉西林对假单胞菌属具强大抗菌作用。对于产ß 内酰胺的铜绿假单胞菌,则要考虑使用加酶抑制剂的制剂,如哌拉西林/他唑巴坦。
头孢菌素的作用机制与青霉素相同,主要通过干扰细菌细胞壁主要成分-肽聚糖的合成发挥抗菌作用。头孢菌素类化学结构中β 内酰胺环的酰胺基与肽聚糖五肽相似,头孢菌素类可与PBP 共价结合使其灭活,因此影响了肽聚糖的合成。每种细菌含不同的PBP,各种PBP 在维持细胞壁完整性中的作用亦不同。不同的头孢菌素品种与不同菌种的PBP 结合使菌体形成丝状体、球状体,最终细菌溶解破裂死亡。如头孢噻肟作用于PBPIb 及PBP3。头孢他啶与PBP3 和PBP1a 具高度亲和力。亚胺培南与大肠埃希菌的PBP1a、1b、2、4、5 和6,以及铜绿假单胞菌的PBP1a、1b、2、4 和5 具有高度亲和力,其致死效应主要由于与PBP2和PBP1b 的结合。头孢吡肟(Cefepime)与细菌的PBP3 有强大的亲和力,对PBP2 也有比较好的亲和力。氨曲南主要通过与大肠埃希菌等需氧革兰阴性菌的PBP3紧密结合发挥抗菌作用,但不能与需氧革兰阳性菌和厌氧菌的PBP结合,因而对这些细菌无抗菌作用。(摘自汪复,张婴元《实用抗感染治疗学》)
当细菌暴露与β-内酰胺类药物环境中,细菌胞壁合成受阻,结构松散,无法承受胞内渗透压而膨胀,再加上自溶酶等作用下导致细菌裂解死亡。
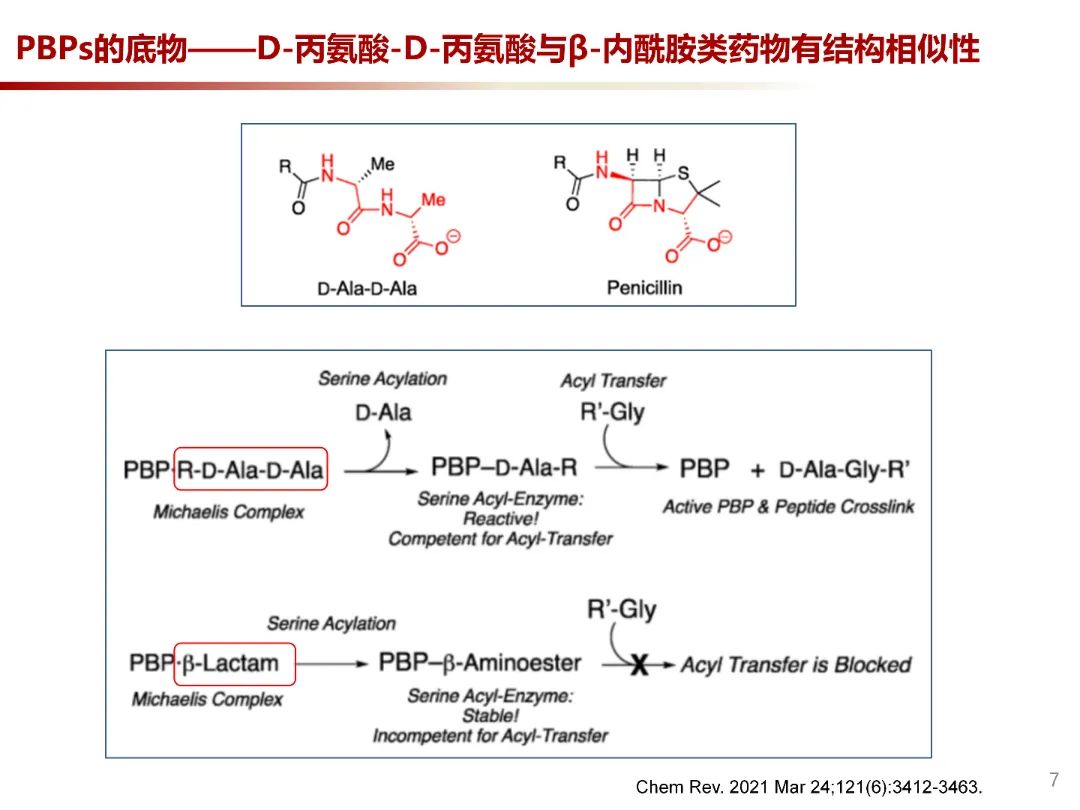
大部分细菌PBP的活性中心是丝氨酸,β-内酰胺类药物通过其β-内酰胺环中的羧基和细菌对应的PBP的丝氨酸羟基共价结合形成丝氨酸酯。PBP与底物R-D-Ala-D-Ala结合形成Michaelis 复合物,活性位点丝氨酸催化后打开β-内酰胺环,得到酰基酶中间体。PBP家族分为催化肽聚糖聚合PBP和重塑PBP。聚合的PBP将酰基部分转移到相邻肽聚糖链的桥肽的末端甘氨酸残基的胺上,从而实现交联反应。当PBP与β-内酰胺类结合形成Michaelis 复合物后,与 PBP转换相反的是,活性位点丝氨酸的 β-内酰胺酰化后,末端D-Ala 基团没有离开,因此,β-内酰胺衍生的酰基酶不能进行酰基转移,进而影响细菌细胞壁合成。
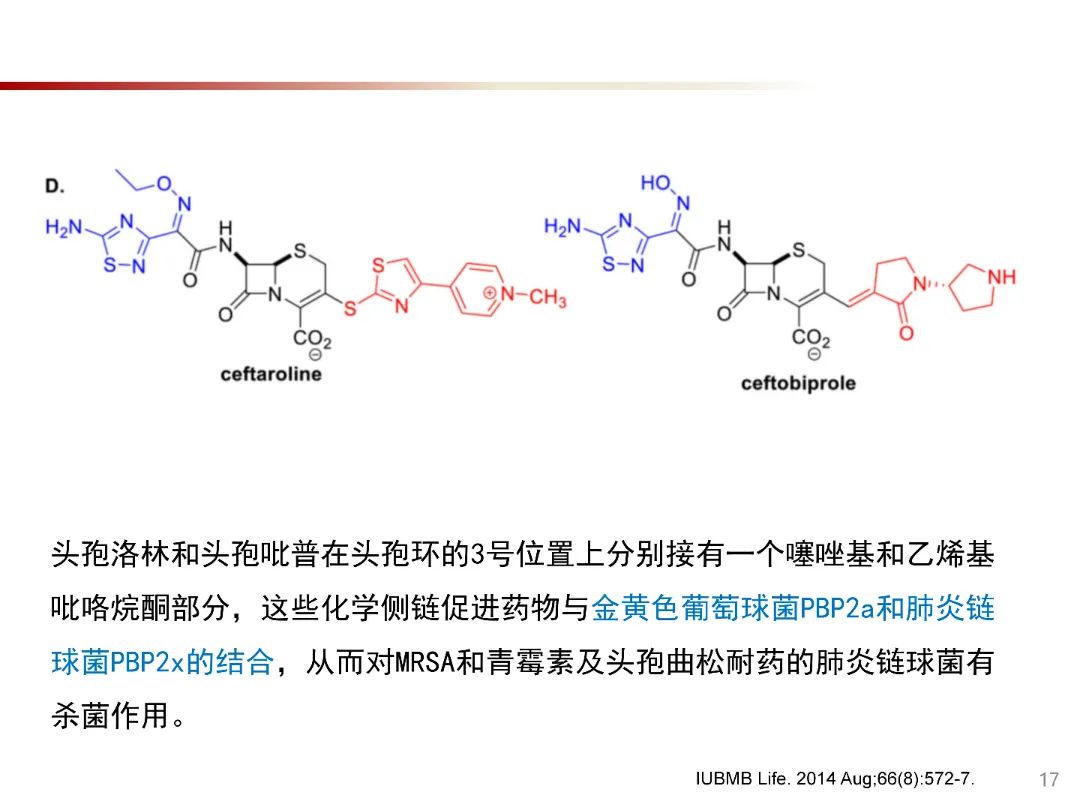
PBP的改变与药物的亲和力降低是革兰阳性球菌对β-内酰胺类耐药性的重要机制之一。革兰阴性菌对β-内酰胺类主要耐药机制是产生β-内酰胺酶,除此之外,革兰氏阴性菌的细胞壁含有外膜,可以有效阻止抗菌药物进入细菌。通过靶位点PBPs改变,使已经进入菌体内的抗菌药物不能与PBP位点结合,从而不能继续发挥杀菌作用。

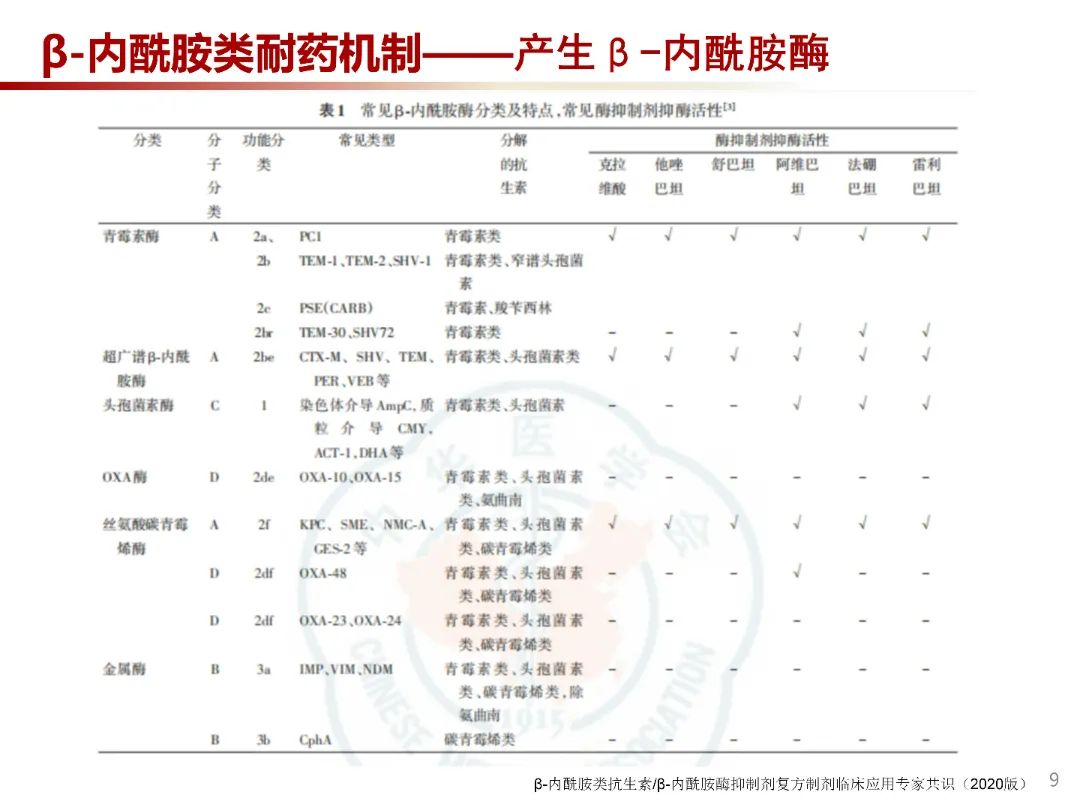
β-内酰胺酶可以水解β-内酰胺类药物的β-内酰胺环,使其失去抗菌活性。β-内酰胺酶的主要分类方法有Ambler法和Bush-Jacoby法。Ambler法根据β-内酰胺酶末端的氨基酸序列特征的分子生物学分类,将β-内酰胺酶分为丝氨酸酶(A类、C类和D类酶)及金属酶(B类酶)。Bush-Jacoby法根据β-内酰胺酶的底物、生化特征及是否被酶抑制剂所抑制的功能分为青霉素酶、广谱酶、超广谱β-内酰胺酶(ESBL)、头孢菌素酶(AmpC酶)和碳青霉烯酶等。
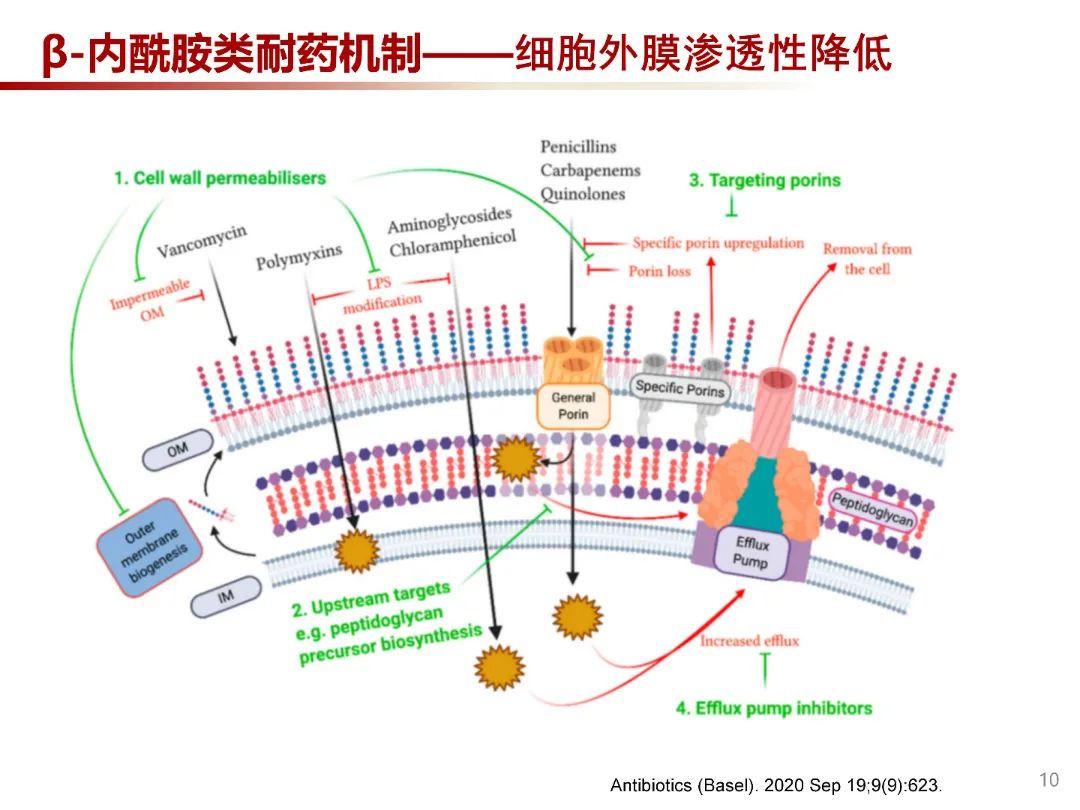
革兰阴性菌细胞壁外包裹一层外膜(Outer membrane,OM),由脂多糖、磷脂及膜蛋白等成分组成的不对称双层,充当渗透屏障并阻止抗菌药物达到其目标。抗甲氧西林金黄色葡萄球菌(MRSA)的首选治疗药物的糖肽类抗生素万古霉素对革兰阴性菌具有天然耐药,因万古霉素相对分子量较大,无法突破OM渗透屏障,因此对革兰阴性菌无效。多粘菌素药物所带正电荷与外膜上的负电荷脂多糖结合,进而破坏细胞膜发挥杀菌作用。疏水性抗生素如氯霉素和氨基糖苷类,利用通过脂质的扩散途径进入菌体。β-内酰胺类药物及喹诺酮等亲水性抗生素可通过膜孔蛋白进入菌体。此外,外排泵的表达能够有效地降低细菌内药物浓度,是主要耐药机制之一。
PBP介导的耐药主要见于革兰阳性菌,也有革兰阴性菌中PBP介导耐药的例子。下面介绍一些常见细菌PBP及其功能。


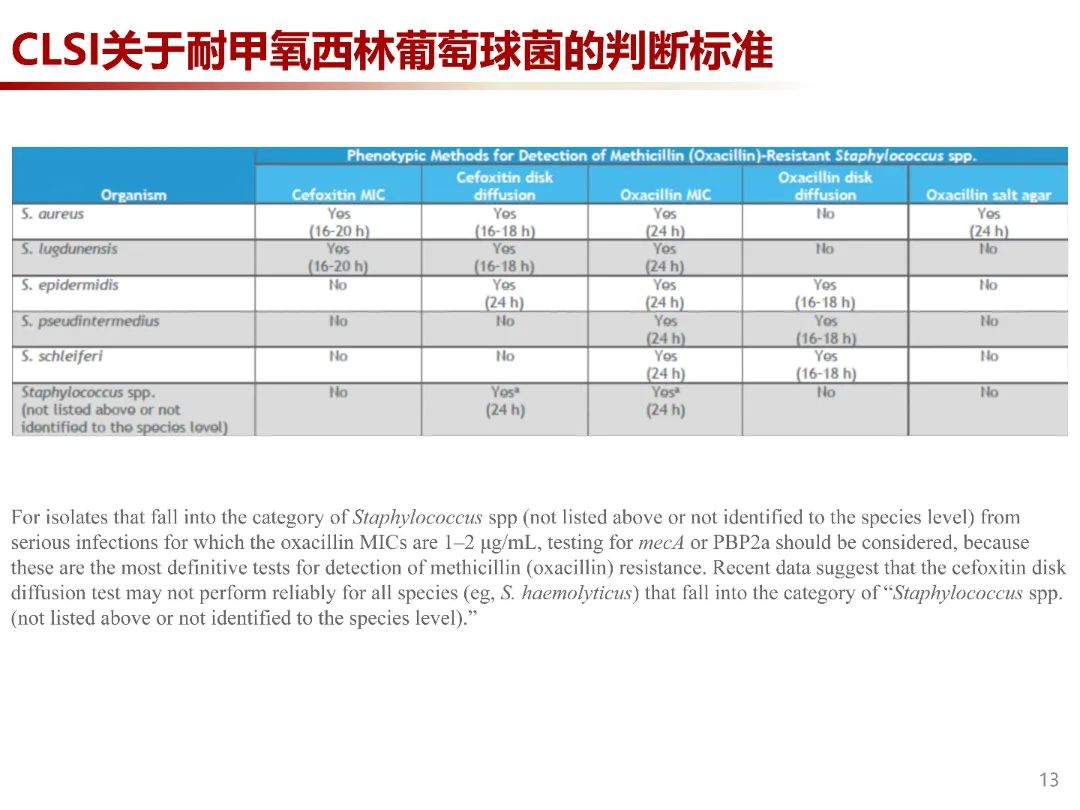
葡萄球菌对β-内酰胺的耐药性最常见是通过mecA 基因获得,该基因编码PBP2a,导致细胞壁组成发生改变,对β-内酰胺药物的亲和力降低。PBP2a检测对于MRSA诊断、抗菌药物的管理及减少耐药性传播具有重要意义。目前对于PBP实验室检测方法有十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)、免疫蛋白印迹、免疫荧光蛋白等,但这些方法需要特定仪器,操作烦琐,主要用于科学研究。现较成熟的方法是PBP2a单克隆抗体乳胶凝集法,市场上已有相应商品化试剂盒。

肺炎链球菌对青霉素等β-内酰胺类抗生素耐药的机制主要与PBP的改变有关,肺炎链球菌青霉素耐药株由于其青霉素结合蛋白PBP-1a、-1b、-2x、-2a、-2b 和3 发生突变所致,而高水平耐药可由于上述PBP 中多个PBP 发生改变引起。PBP1a 和2x 的改变可引起对头孢噻肟和头孢曲松的高水平耐药, PBP2x 的改变可引起对苯唑西林的耐药。

长期以来,肺炎链球菌被认为是对青霉素最敏感的微生物之一,1960年代首次发现青霉素不敏感的肺炎球菌 (PNSP) ,此后多种 PNSP 菌株在世界范围内传播。2021年中国耐药监测网数据显示,非脑膜炎PNSP在儿童和成人患者中分别约占2%和5%。
β-内酰胺类抗菌药物对肺炎球菌PBP具有特定的亲和力,如青霉素对PBP2b,头孢噻肟对 PBP2x 和 PBP3。PNSP 的特征是由种间重组产生的镶嵌PBP2x、PBP2b和PBP1a基因,这些改变的程度决定了该基因型对β-内酰胺药物不敏感的范围和浓度,如PBP1a嵌合程度增加了对青霉素和头孢噻肟的耐药性。当肺炎链球菌对青霉素高度耐药(≥2μg/ml)时,说明不止一种PBP发生了改变,可能一种PBP发生几处基因嵌入。此外,肺链的fib基因座(fibA和fibB)参与肽间桥的形成,fib的失活会减少胞壁肽的交联,即使存在低亲和力的嵌入式的PBP,也会造成青霉素耐药性。

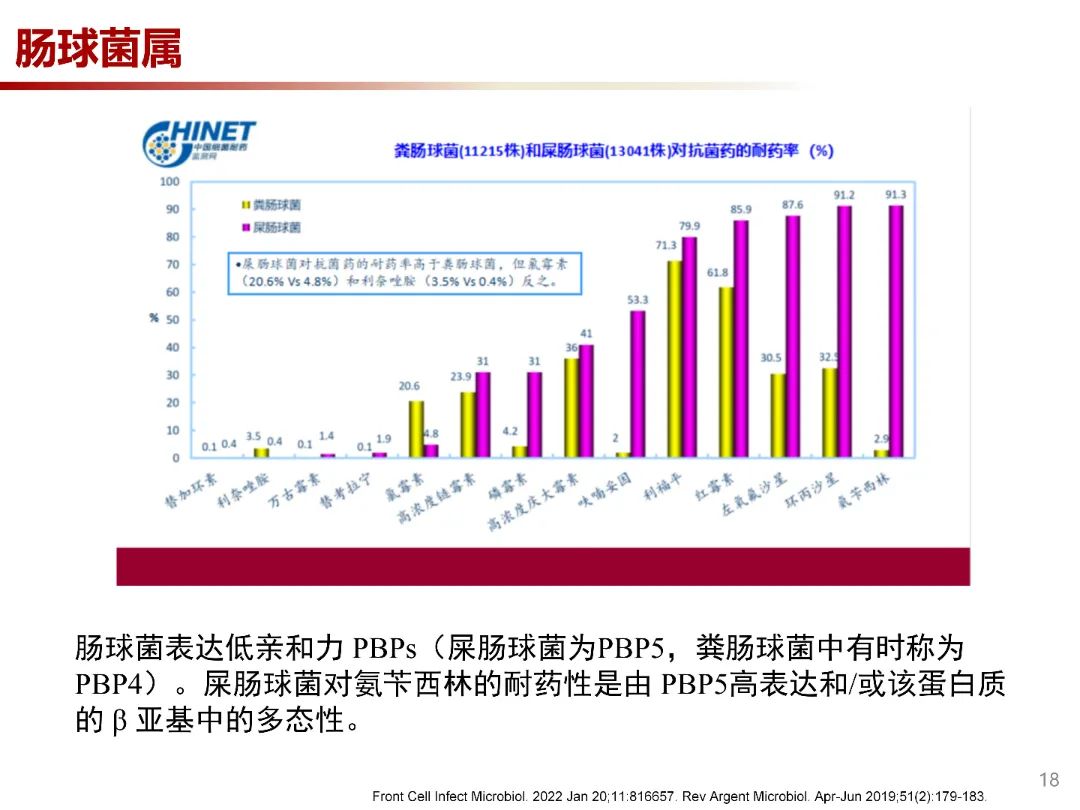
肠球菌表达低亲和力PBP(屎肠球菌为PBP5,粪肠球菌中有时称为PBP4),表现出对青霉素和氨苄西林的敏感性降低,以及对大多数头孢菌素和所有半合成青霉素的高水平耐药性。2021年中国耐药监测网数据显示,屎肠球菌对氨苄西林耐药率达91.3%,而粪肠球菌为2.9%。屎肠球菌对氨苄西林的高水平耐药性由PBP5的产生增加和/或该蛋白质的 β 亚基中的多态性。屎肠球菌PBP5点突变导致青霉素的MIC从4μg/ml上升到16μg/ml,甚至>1000μg/ml。同时降低了头孢菌素及其他β-内酰胺类抗生素的亲和力。
1980年代发现产β-内酰胺酶肠球菌,这种抗性机制在粪肠球菌中比在屎肠球菌中更常见,但产β-内酰胺酶的肠球菌比较少见,这种菌株的特点是对青霉素、氨苄西林和哌拉西林耐药,但对亚胺培南和β-内酰胺类/酶抑制剂如氨苄西林-舒巴坦敏感,因此不构成治疗挑战。
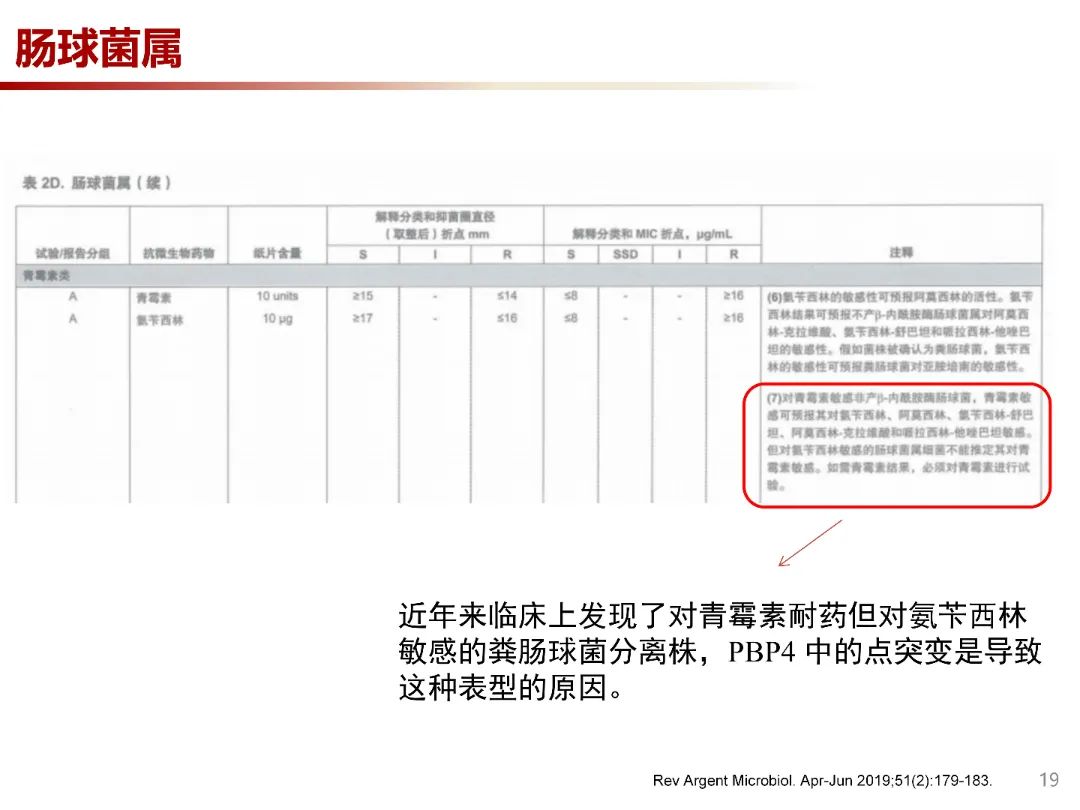
根据CISI建议,对青霉素敏感非产β-内酰胺酶肠球菌,青霉素敏感可预测其对氨苄西林、阿莫西林、氨苄西林-舒巴坦、阿莫西林-克拉维酸和哌拉西林-他唑巴坦敏感。但对氨苄西林敏感的肠球菌属不能推定其对青霉素敏感。原因是近年来临床上发现了对青霉素耐药但对氨苄西林敏感的粪肠球菌分离株,PBP4 中的点突变是导致这种表型的原因。
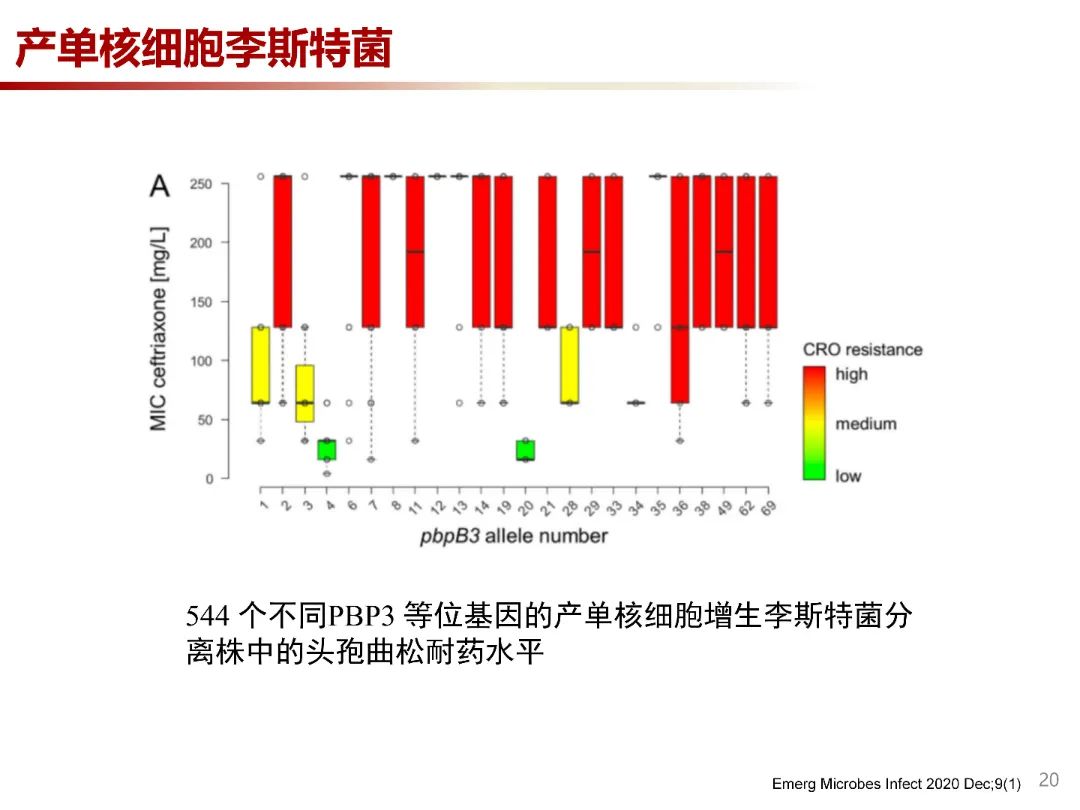
产单核细胞李斯特菌对第三代头孢菌素如头孢曲松具有内在耐药性,lmo0441 基因编码的低亲和力的PBP3耐药性的关键决定因素,有学者观察到不同ST型产单核细胞李斯特菌的耐药性水平在 4 mg/L 和 >128 mg/L 之间变化很大,可能存在其他头孢菌素耐药性的遗传变异,例如其他PBP、某些转运蛋白或调节剂。
绝大多数革兰阴性菌对β-内酰胺类药物耐药原因是产β-内酰胺酶,PBP结构改变引起耐药现象比较少见。在大肠埃希菌中,多数青霉素类或头孢菌素类抗生素与PBP1或PBP3结合,使菌体形成丝状体和球形体,发生萎缩,溶解死亡。亚胺培南对大肠埃希菌的抗菌效力部分归因于它的主要靶点是PBP2。

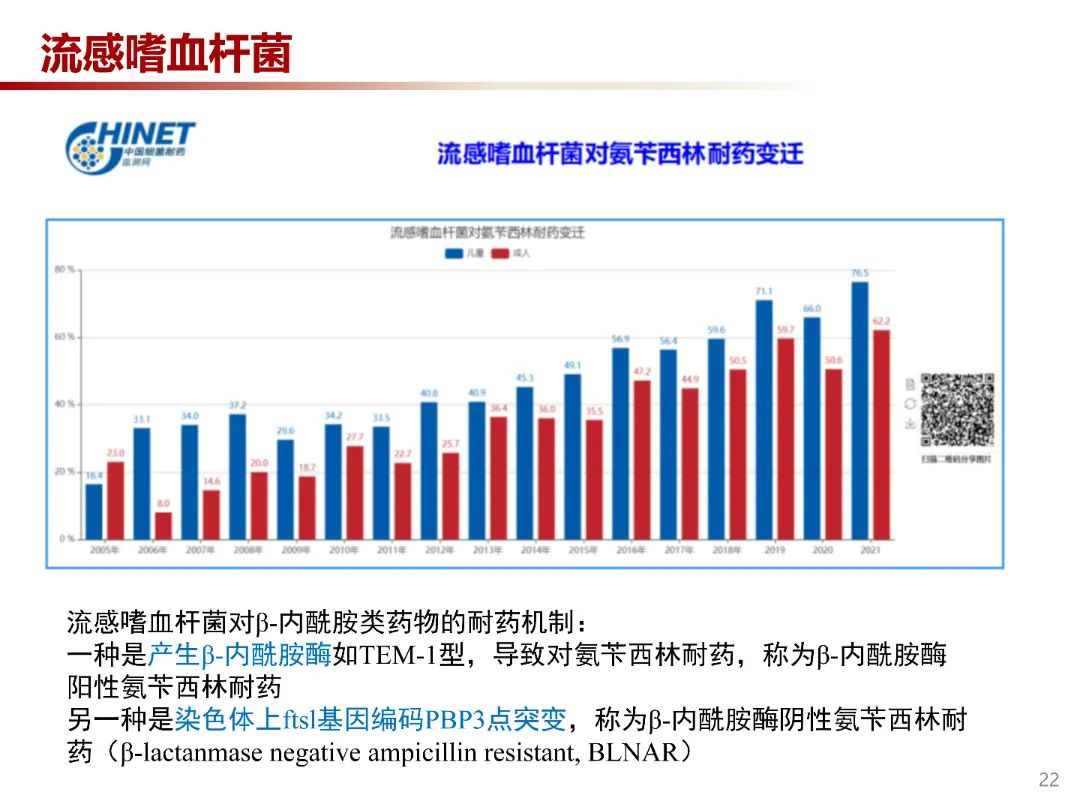
氨苄西林是治疗流感嗜血杆菌感染的首选药物,从2021年中国耐药监测网数据来看,流感嗜血杆菌对氨苄西林耐药率逐年增高。流感嗜血杆菌对氨苄西林耐药的主要机制为产β-内酰胺酶如TEM-1型,另一种是染色体上ftsl基因编码PBP3点突变,对氨苄西林和其他β-内酰胺类抗生素的敏感性降低,称为β-内酰胺酶阴性氨苄西林耐药(β-lactanmase negative ampicillin resistant, BLNAR)。
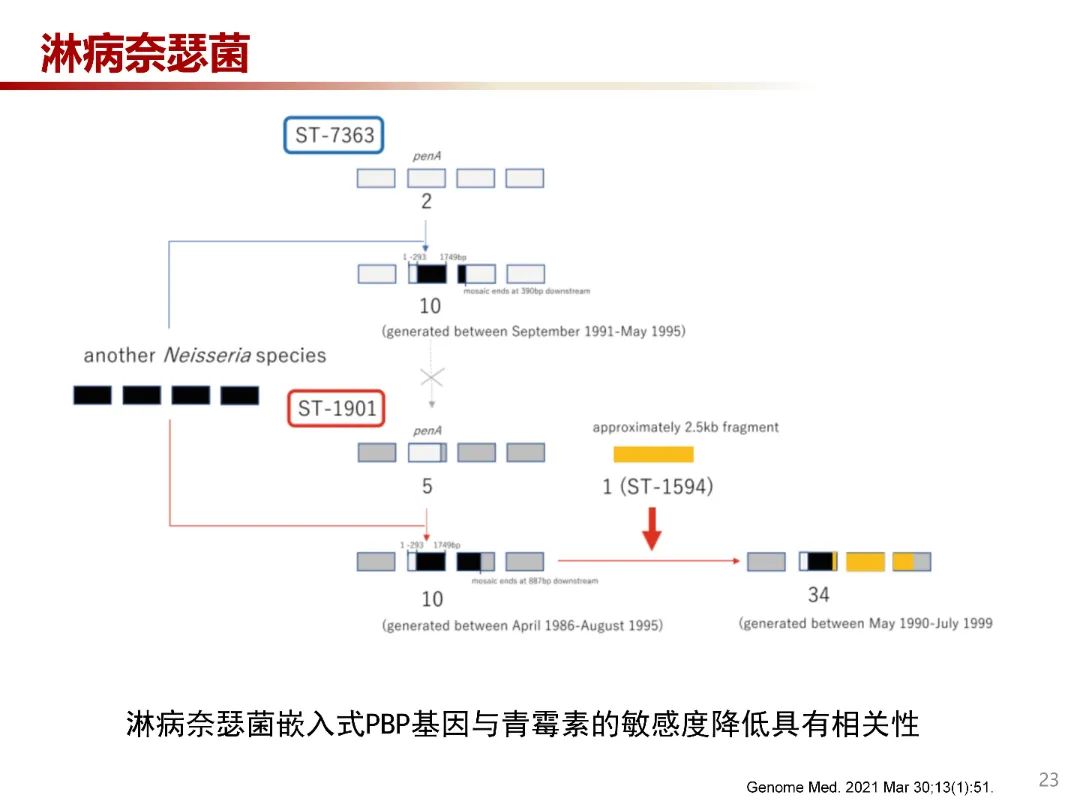
淋病奈瑟菌的ponA和penA基因分别编码PBP1和PBP2,PBP基因中耐药部分从亲缘关系紧密且对青霉素更耐药的共生奈瑟菌属细菌中获得。淋病奈瑟菌嵌入式PBP基因与青霉素的敏感度降低具有相关性。

单独使用青霉素(或氨苄西林)或与氨基糖苷类联合使用是治疗肠球菌感染的经典方案,β-内酰胺类药物作用于细菌细胞壁,使氨基糖苷类抗生素穿透疏散细胞壁达到其作用位点,由此产生协同抗菌作用。但因高水平氨基糖苷类耐药及肾毒性限制了此方案使用。《热病》治疗指南中关于粪肠球菌全身感染备选治疗方案中推荐使用氨苄西林和头孢曲松联合用药。
有研究发现在低阿莫西林浓度下,PBP4和PBP5会部分饱和,但非必需的PBP2和PBP3可以参与构建细胞壁。与头孢噻肟合用会使PBP2和PBP3完全饱和,产生杀菌协同作用。学者评估30例粪肠球菌感染性心内膜炎患者的治疗方案,73.3% 分离株显示联用氨苄西林-头孢曲松具有协同作用。



作者:李倩(梅州市人民医院)、鲁炳怀(中日友好医院)
来源:京港感染论坛
查看更多