查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





北京协和医院 沈东超,崔丽英
2023年4月22日,来自俄亥俄州立大学医学院的Adam Quick教授在AAN年会上带来了有关肌萎缩侧索硬化(ALS)的药物治疗进展。
依达拉奉用于治疗ALS早在2017年即已大放异彩。一项并未公开发表的规模三期试验表明该药对整体ALS患者并无效果,但事后分析显示其在特定亚组中(年龄在20-75岁;ALSFRSR每一项评分不能少于2分,总分至少大于24分;用力肺活量≥80%;根据El Escorial修订标准为明确或可能的ALS;发病不超过2年;ALSFRSR评分在12周观察期减少1-4分)可减缓ALS功能评分量表的变化速率。在为期6个月的研究期间,药物组患者的ALS功能评分量表变化为-5分,而安慰剂组为-7.5分(图1)。
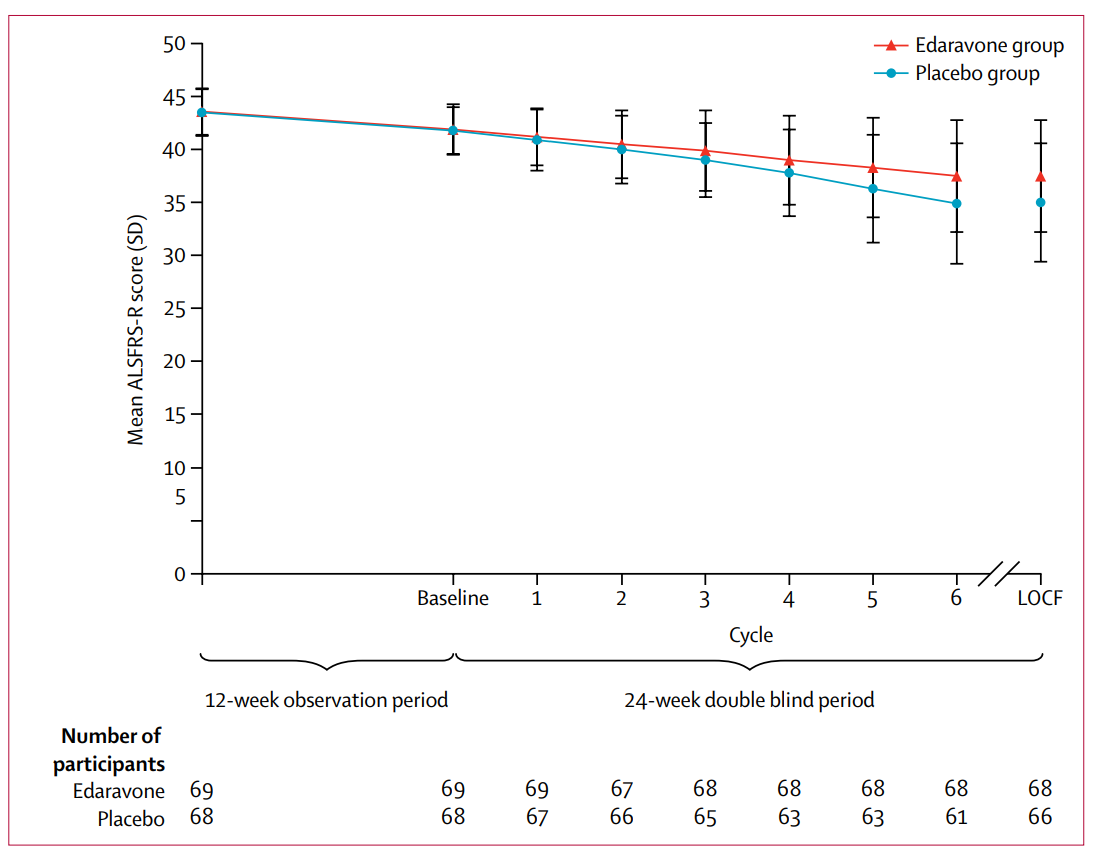
图1. Lancet Neurol. 2017 ;16(7):505-512. 治疗期间的ALSFRS-R评分变化.
然而,静脉注射依达拉奉的治疗方式仍然有一定的挑战性,不甚便捷。去年有关依达拉奉口服制剂的相关研究陆续发表。生物等效性研究表明,105mg的口服剂型与静脉注射提供的剂量相当,安全性研究也提示口服药物安全性与耐受性良好。该研究入组共计185例患者,139例完成了为期48周的研究,94.6%的患者报告了治疗后有不良反应,但均与研究药物无关(图2)。因此,在2022年,口服剂型也被FDA批准用于治疗ALS,在大部分患者中替代了静脉注射版本。
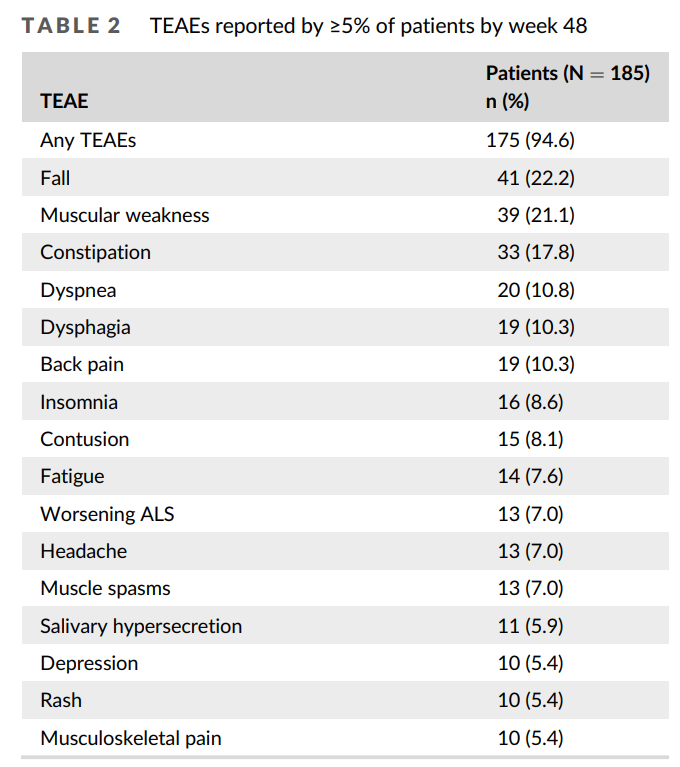
图2. Muscle Nerve. 2023;67(2):124-129. 治疗后48周>5%患者报告发生的不良事件.
有关依达拉奉,Adam Quick教授还提到一项有趣的德国研究。这是一项真实世界的多中心、倾向性评分匹配队列研究,探索了ALS患者长期静脉应用依达拉奉有效性与安全性。入组患者来自德国运动神经元病网络中心,所有受试者均符合El Escorial诊断标准中确诊或拟诊ALS的患者,共计入组130例接受静脉依达拉奉及利鲁唑治疗的ALS患者与130例接受标准治疗(仅利鲁唑)的患者(图3),在疾病起始部位、患者年龄、疾病持续时间及基线ALS功能评分量表上两组高度匹配。研究结果提示,在主要结局方面两组之间没有显著性差异,依达拉奉组患者的功能评分每月下降0.91分,标准治疗组患者每月下降0.85分(图4左)。同时,在治疗开始前与开始后的疾病进展变化速率(图4右)、存活概率(图5)、无创通气生存差异(图6)等方面,两组也没有明显差异。虽然该研究并非安慰剂对照试验,但它为我们提供了更多有关这种药物在真实世界中使用的相关信息。
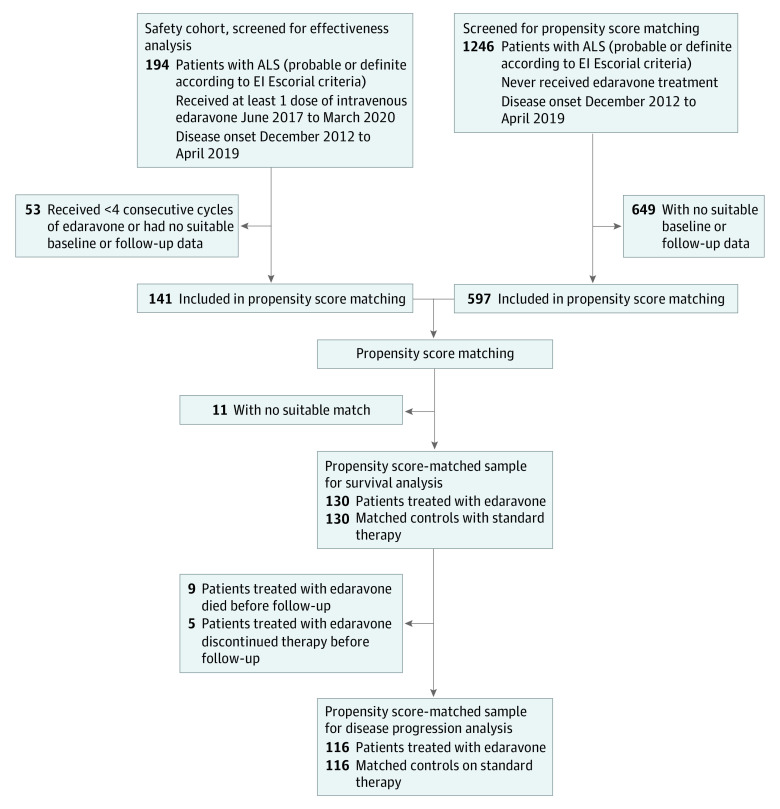
图3. JAMA Neurol. 2022;79(2):121-130. 研究入组分析流程.
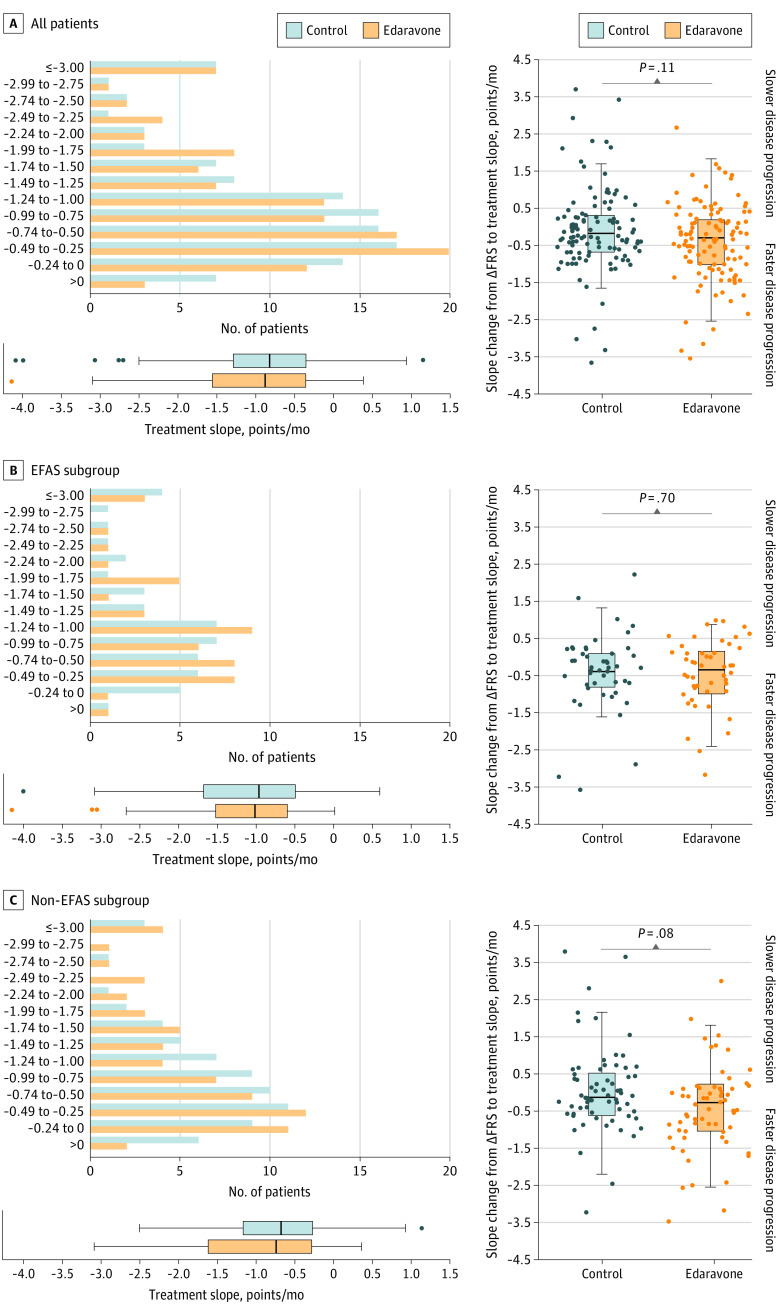
图4. JAMA Neurol. 2022;79(2):121-130.倾向评分匹配样本中的疾病进展比较,左图为ALSFRS-R评分变化,右图为个体患者ALFRS-R评分斜率的变化.
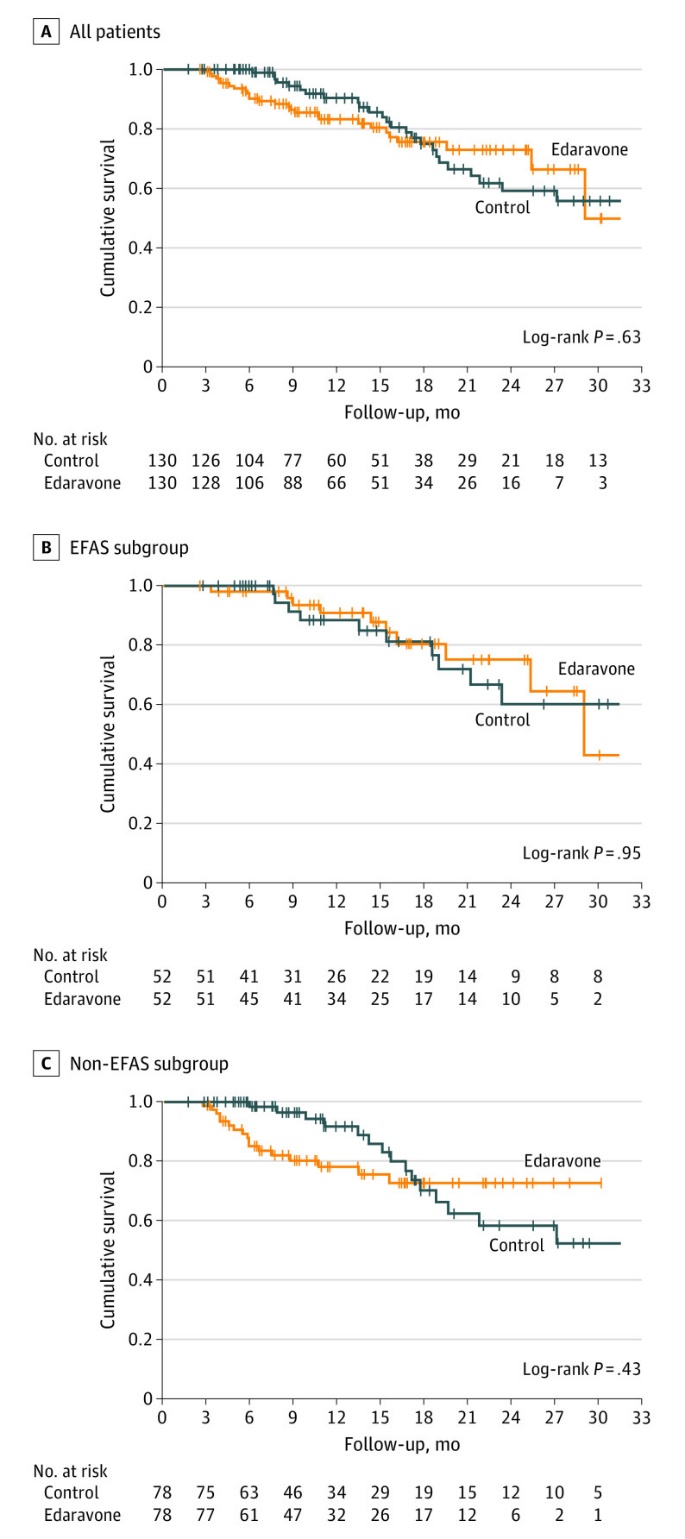
图5. JAMA Neurol. 2022;79(2):121-130. 随访期生存概率的Kaplan-Meier图.
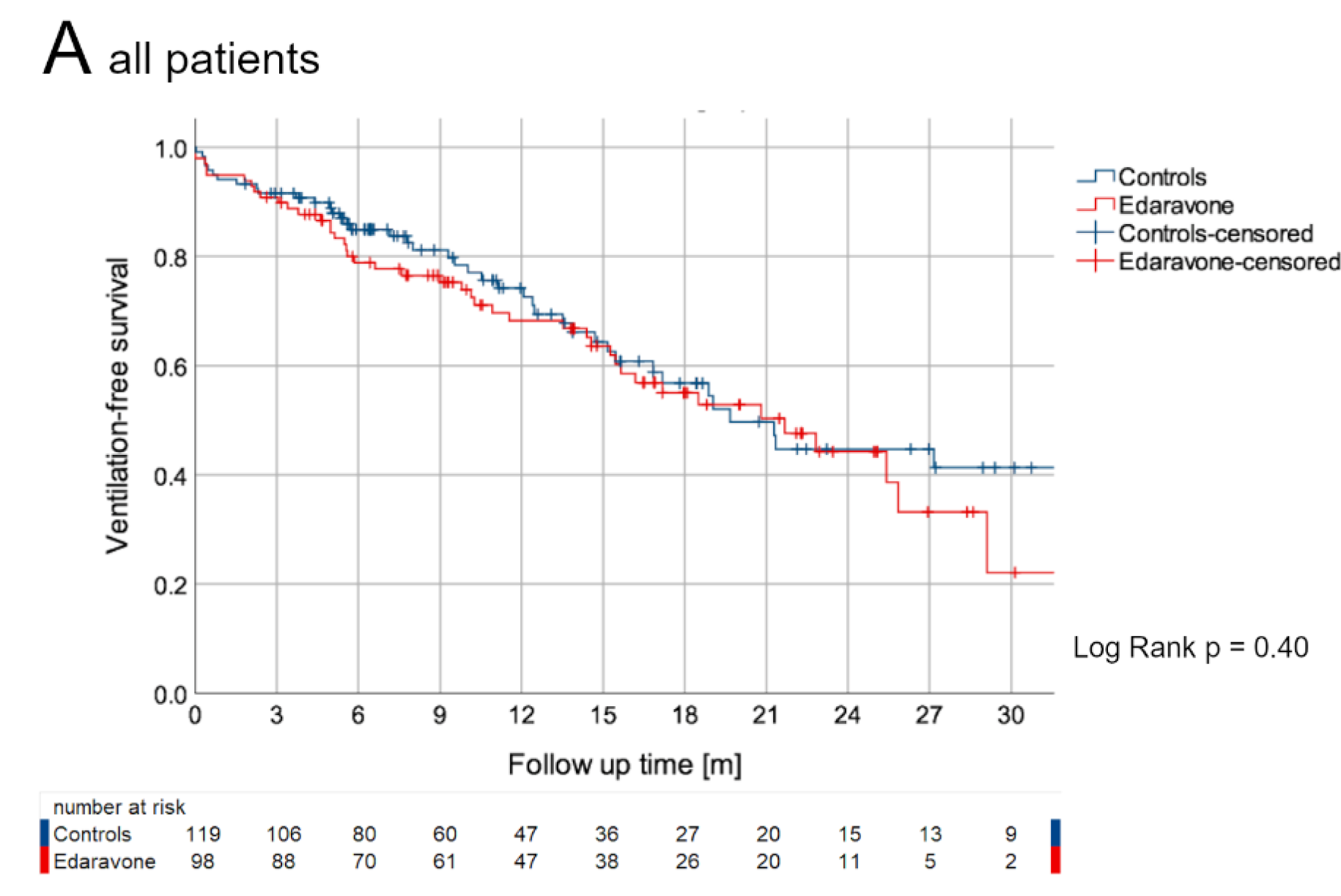
图6.
JAMA Neurol. 2022;79(2):121-130. 随访期无辅助通气生存的Kaplan-Meier图.
Adam Quick教授提到的另外两个药物分别是Tofersen,于2023年4月25日被FDA批准用于治疗SOD1基因突变所致的成人ALS,以及苯丁酸钠/牛磺酸二醇(PB-TURSO),于2022年被FDA批准用于治疗ALS。
SOD1基因突变是首个被发现的与ALS相关的致病性变异,SOD1蛋白异常聚集相关的毒性作用是导致SOD1-ALS的主要原因。在所有ALS患者中,携带致病性SOD1变异的比例约为2%,家族性ALS患者中的携带比例约为20%。Tofersen是一种鞘内给药的反寡义核苷酸(ASO)药物,通过诱导RNase H酶介导的SOD1信使RNA降解来减少SOD1蛋白合成。该项研究于2022年发表于新英格兰杂志。
这是一项为期28周的随机、双盲、安慰剂对照的III期临床试验(VALOR研究),108名患者以2:1的比例随机接受Tofersen100mg(n = 72)或安慰剂(n = 36)治疗,时间持续24周(3次负荷剂量,随后5次维持剂量),患者被允许同时使用利鲁唑和/或依达拉奉。随访期结束后,还有一年的开放标签扩展期(OLE研究),其中治疗组和安慰剂组都能继续使用治疗药物。研究的主要终点是治疗28周后快速进展组患者ALSFRS-R评分较基线的变化,次要终点包括脑脊液中SOD1蛋白总浓度变化、血浆中神经丝轻链(NfL)浓度变化、缓慢肺活量 (SVC) 变化、手持式握力计测量值变化以及至死亡或需永久机械通气的时间。非快速进展组的患者未被纳入主要终点分析,但同样可参与安慰剂对照试验并进入扩展期,其中只有脑脊液中SOD1蛋白总浓度被作为主要终点。
108例SOD1-ALS患者涵盖42种SOD1突变类型,包括快速进展组60例,非快速进展组48例(图7)。自基线至治疗28周时,Tofersen治疗组和安慰剂对照组的ALSFRS-R评分变化之间没有显著性差异(分别降低6.98分vs 8.14分,p=0.97)(图8)。由于主要终点未达到统计学意义,因此在快速进展亚组中,所有次要终点指标均被认为在两组间没有显著性差异,且没有提供P值(图9)。然而值得注意的是,在VALOR研究中接受Tofersen治疗的受试者中,可观察到脑脊液SOD1蛋白总浓度和血浆NfL浓度随时间持续降低,而先前接受安慰剂但在OLE研究中启用Tofersen的受试者中,其脑脊液SOD1蛋白总浓度和血浆NfL浓度也可观察到类似水平的下降(图10)。FDA加速批准tofersen100 mg/15mL注射液用于SOD1基因突变所致的成人ALS也是基于其可减少NfL(神经退行性标志物)。
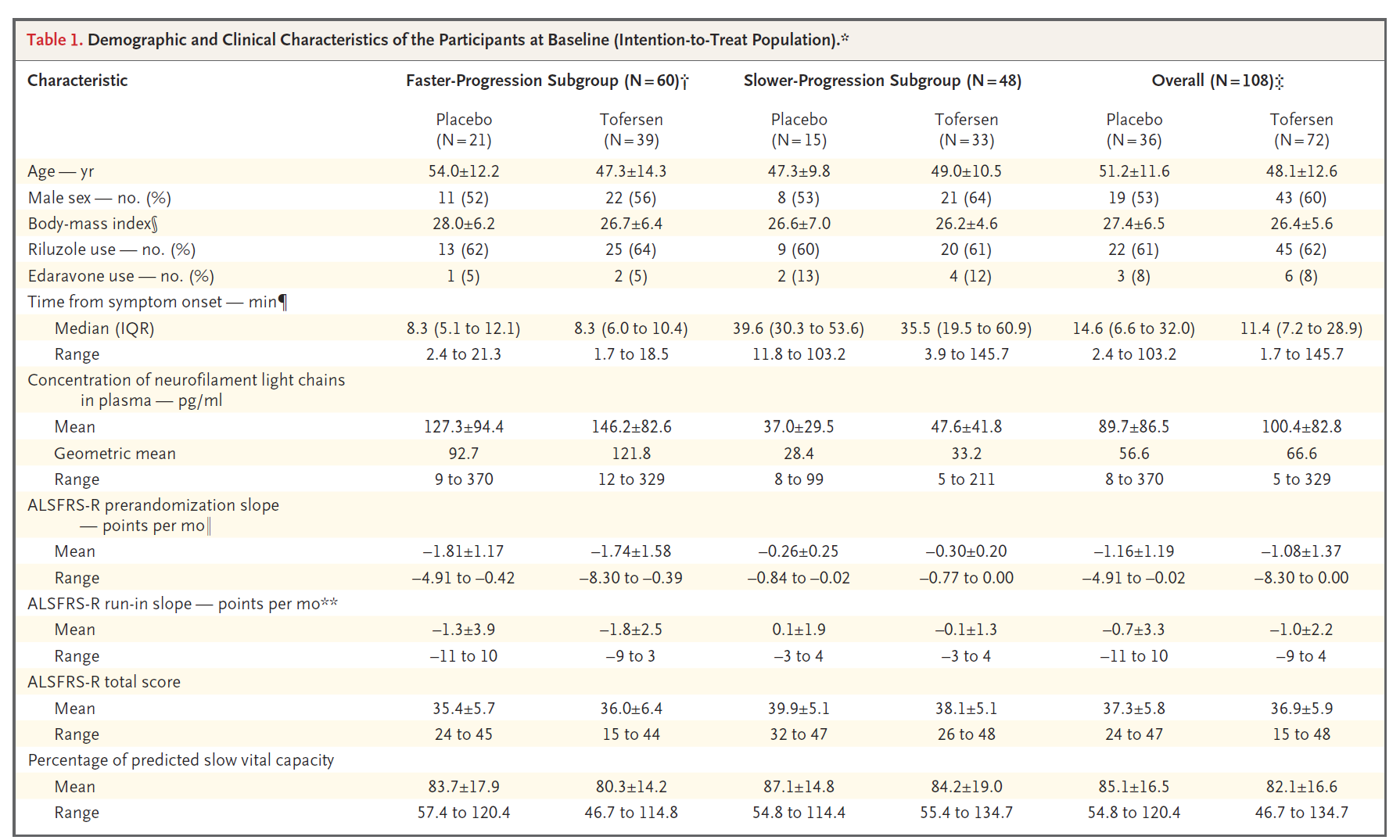
图7. N Engl J Med. 2022;387(12):1099-1110. 意向性治疗人群基线的人口学与临床特征.
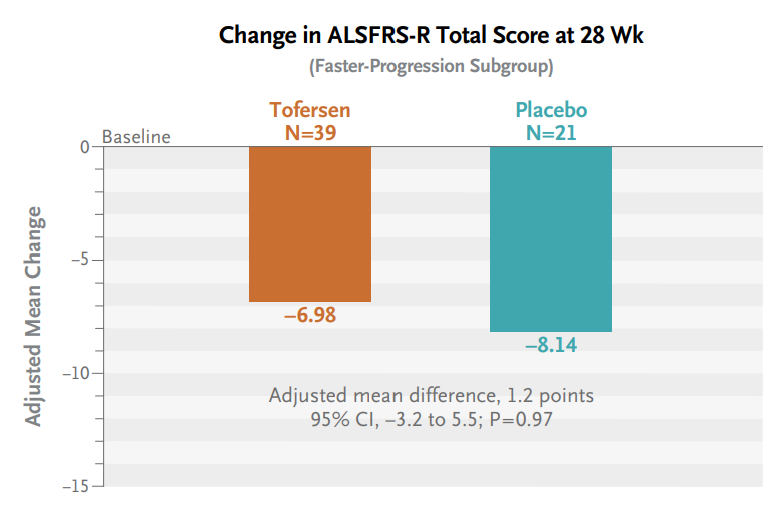
图8. N Engl J Med. 2022;387(12):1099-1110. 研究主要终点为28周时进展组患者ALSFRS-R评分较基线的变化.
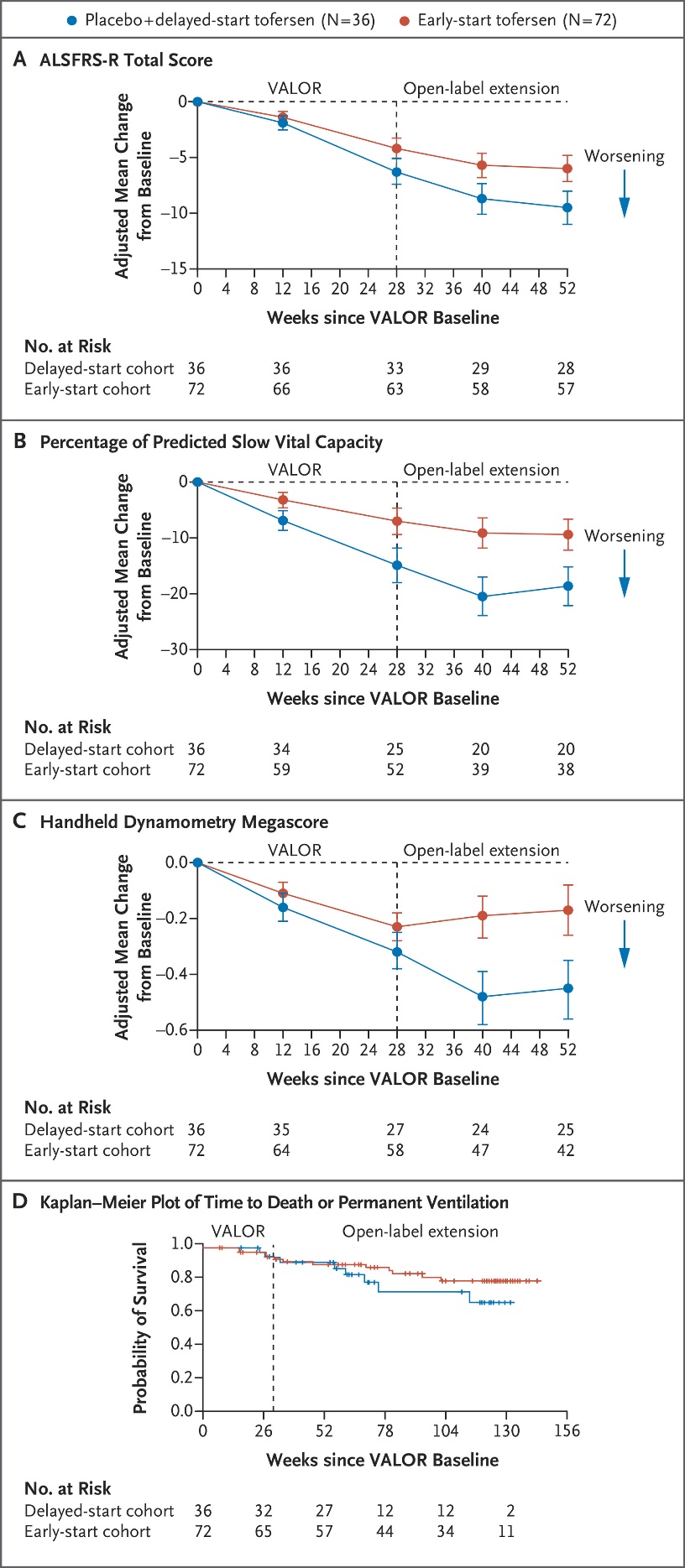
图9. N Engl J
Med. 2022;387(12):1099-1110.临床功能与生存分析:A.ALSFRS-R总评分变化;B.预计缓慢肺活量百分百变化;C.手持式握力计测量值变化;D.至死亡或永久辅助通气时间的Kaplan-Meier图.
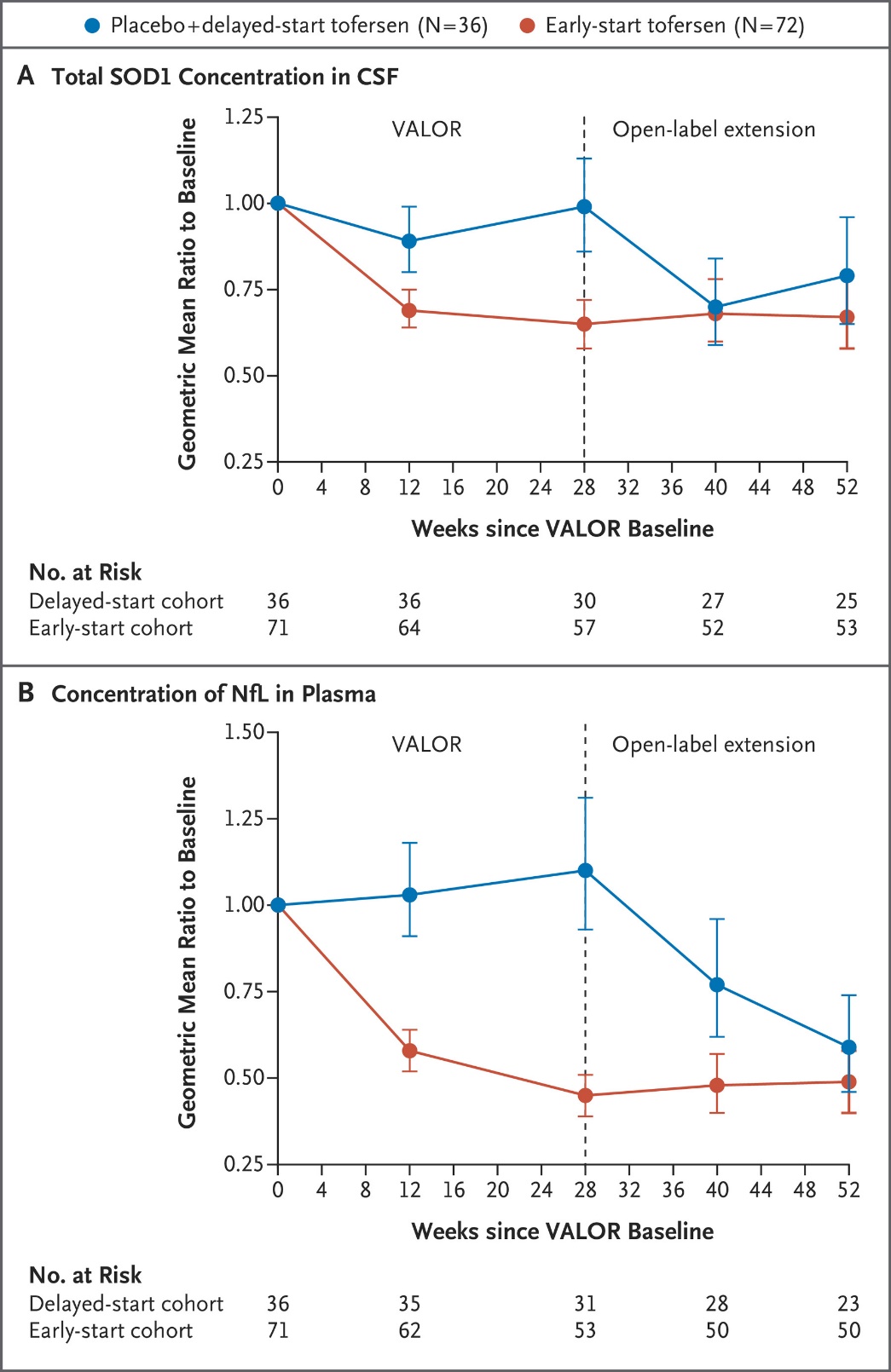
图10. N Engl J Med. 2022;387(12):1099-1110. 脑脊液SOD1蛋白总浓度和血浆NfL浓度变化.
PB-TURSO是第三个获得FDA批准用于ALS治疗的药物。导致获批的数据已于2020年发表(治疗6个月时,药物组与安慰剂组的ALSFR-R评分下降率分别为-1.24分/月vs -1.66分/月,p=0.03,图11),但其于2022年9月才获得正式批准,目前也有了一些新的长期数据于2022年刚刚发布。研究者对进入开放标签阶段的受试者进行了生存分析,随访期三年,随访的4个关键事件包括死亡、气管切开、永久辅助通气及第一次住院。结果显示,药物组与安慰剂组之间的差异趋势随着时间推移继续进展至开放标签阶段。在最初的PB-TURSO治疗组中,发生任一事件的风险降低了47%(图12 A),发生死亡或气管切开/永久辅助通气的风险降低了49%(图12 B)。 因此,很明显,在治疗过程中早期接受药物的人其预后要好于接受安慰剂的患者。
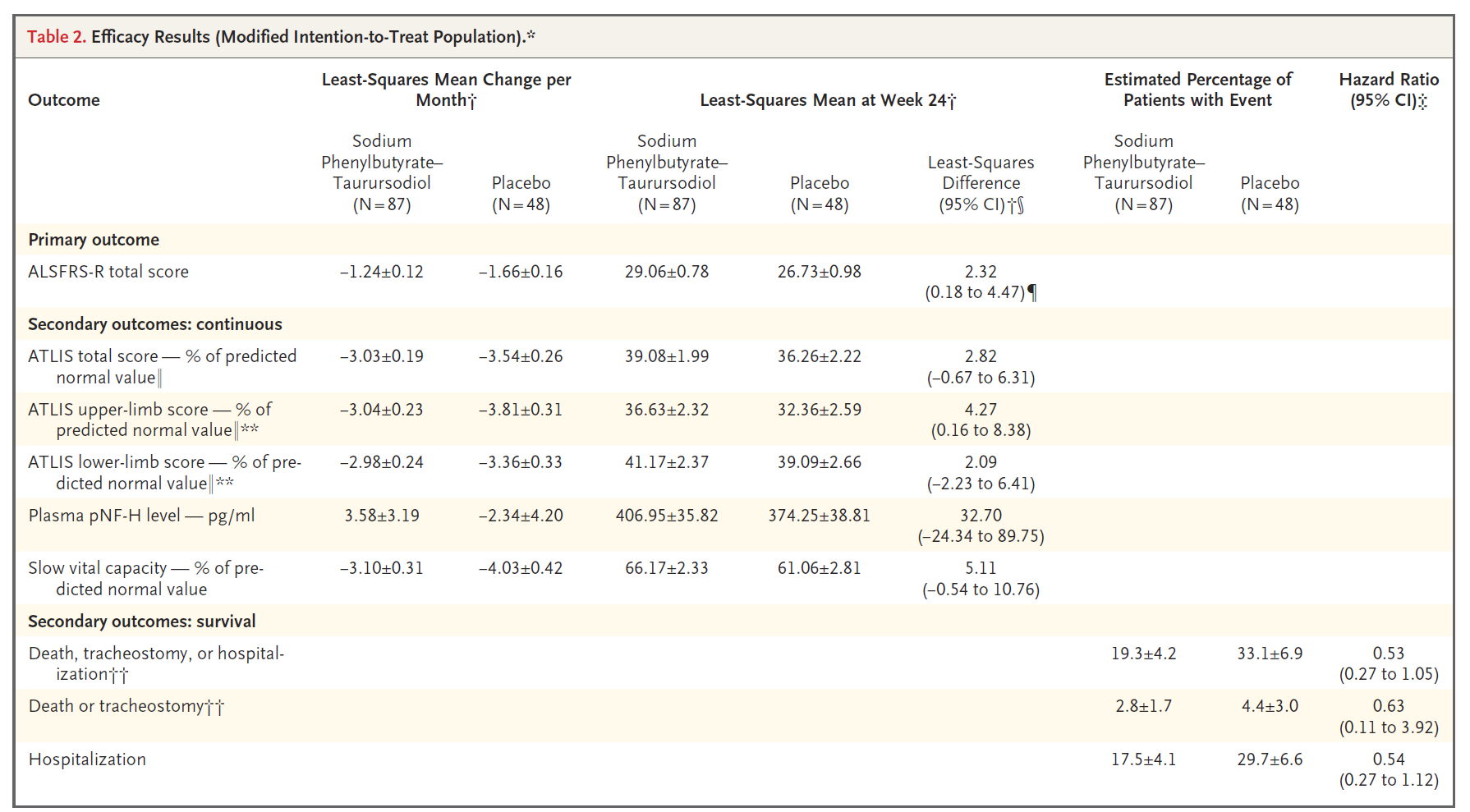
图11. N Engl J Med. 2020;383(10):919-930. 修订后意向性治疗人群的有效性结果.

图12. J NeurolNeurosurg Psychiatry. 2022;93(8):871-875. 至发生关键事件的Kaplan-Meier分析(A发生任一事件,B发生死亡或气管切开/永久辅助通气).
查看更多