查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





靳睿, 王晓晓, 刘峰, 饶慧瑛
北京大学人民医院, 北京大学肝病研究所, 丙型肝炎和肝病免疫治疗北京市重点实验室,非酒精性脂肪性肝病诊断北京市国际科技合作基地
非酒精性脂肪性肝病(NAFLD) 是世界范围内最常见的慢性肝病之一,在一般人群中的患病率约为25%,主要累及肥胖和2型糖尿病(T2DM)患者。其疾病谱包括非酒精性单纯性脂肪肝(NAFL)和非酒精性脂肪性肝炎(NASH),后者进展为晚期肝纤维化、肝硬化或肝细胞癌(HCC)的风险较高[1]。NAFLD的发病机制复杂,现在对其认知仍有限,目前尚未获得美国食品药品监督管理局(FDA)批准治疗NAFLD的药物,相关药物的研发是代谢疾病领域的研究热点之一[2]。本文旨在总结处于研发中的NAFLD/NASH治疗药物及相应靶点,为NAFLD的治疗提供参考。
1 NAFLD的发病机制
NAFLD的发病机制仍无合理的解释,主流假说包括传统的“二次打击”学说及近年提出的“多重打击”学说。在传统的“二次打击”学说中,第一次打击包括久坐不动的生活方式、不良的营养习惯和胰岛素抵抗(IR)引起的以TG为主的肝内脂肪堆积,第二次打击是脂质诱导的反应性氧化代谢产物的过量产生,由于细胞因子介导的炎症、游离脂肪酸氧化、细胞凋亡、坏死炎症和纤维化等多种因素的相互作用,加剧了这种情况的发生[3]。但是目前人们普遍认为“二次打击”学说过于简单化,难以解释NAFLD发病机制的复杂性。已有研究[4]证明氧化应激并不一定伴随着脂质聚集,它本身也能诱导脂肪变性。根据这一推理,更准确的说法是这些事件同时发生,促进了疾病的发生和发展,即 “多重打击”学说[5]。Hebbard和George认为“多重打击”学说是指机体在遗传易感的宿主中对高卡路里饮食、过度进食和久坐不动的生活方式的“综合应答”,这些因素可能导致代谢综合征和肥胖。研究发现过量进食后肠道微生物群失衡,在门静脉循环中细菌产物增多并激活固有免疫系统。这些事件伴随着肌肉中的IR,以应对循环中游离脂肪酸水平的增加,是NAFLD-NASH发病的关键过程之一[6]。IR、氧化应激、炎症、肥胖、代谢综合征、T2DM、脂肪组织分泌的激素、肠道微生物和表观遗传等在内的所有因素均被认为在NAFLD的发生和发展中起着关键作用(图1)[7]。
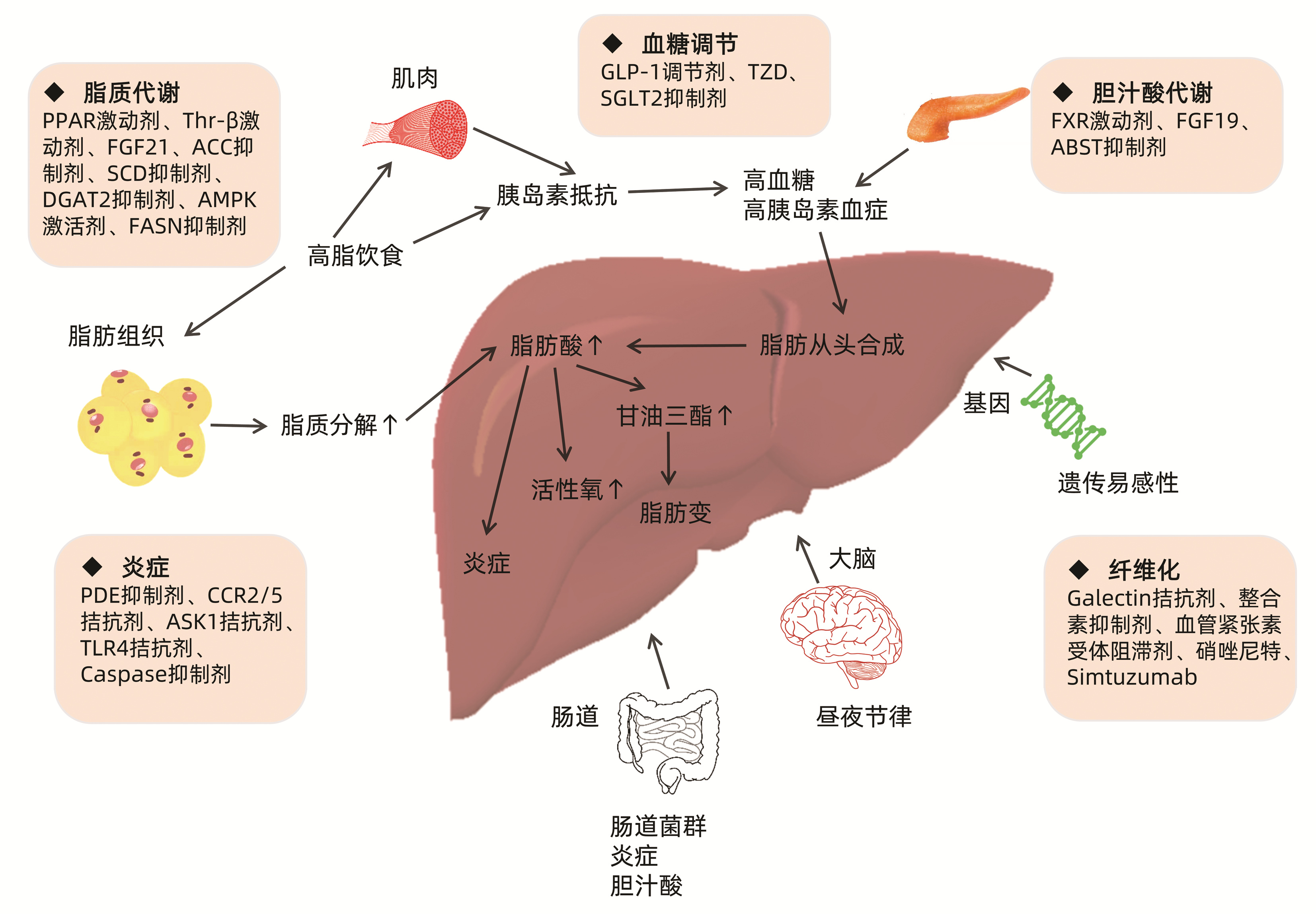
图1 NAFLD的发病机制及药物治疗靶点
Figure 1 Pathogenesis and therapy targets of NAFLD
2 NAFLD的治疗药物及作用靶点
研究发现[8]针对NAFLD的治疗有较多潜在靶点,在目前NAFLD的药物研发中,研究人员通常针对脂质代谢、炎症或纤维化等途径选择相应的治疗靶点。
2.1 靶向代谢的药物
2.1.1 靶向胆汁酸代谢的药物
2.1.1.1 法尼酯X受体(FXR)激动剂
FXR是一种核受体,在肝脏和小肠中高度表达。胆汁酸(BA)是FXR天然配体,其与FXR的结合和激活对调节BA合成、脂质代谢、炎症和纤维化的细胞通路至关重要。奥贝胆酸(OCA)作为FXR的激动剂现已通过两项Ⅱ期研究,尚有两项Ⅲ期研究正在进行。针对NASH患者的国际Ⅲ期临床试验(再生研究)中期分析显示与安慰剂组相比,OCA 25 mg/d持续72周可显著改善肝纤维化(≥1级)[9-10]。但是OCA存在低密度脂蛋白胆固醇(LDL-C)水平升高、瘙痒、费用高等缺点。OCA和阿托伐他汀联合监测血脂的Ⅱ期临床研究 (对照试验,NCT02633956)评估了OCA以及联合使用他汀类药物对无肝脏失代偿证据的NASH纤维化患者LDL-C水平的影响,结果显示阿托伐他汀减轻了OCA诱导的NASH患者LDL-C水平的升高[11]。OCA在肝硬化NASH患者中的Ⅲ期反向临床试验的主要终点是使用NASH临床研究网络评分系统,评估治疗12个月后纤维化组织学改善至少一级的受试者的百分比,其结果将验证OCA治疗在疾病晚期阶段的安全有效性[12]。2020年6月,FDA认为该药物基于替代组织病理学试验终点的预期益处仍不确定,而且治疗收益并没有超过潜在的风险,拒绝批准Intercept生产的OCA治疗NASH。但Intercept 称将公布更多临床数据用以支持此前的申请。
由于OCA具有瘙痒和LDL-C升高等缺点,现已开发选择性非胆汁酸合成的FXR激动剂来解决这些问题。Rohit Loomba于2021美国肝病学会(AASLD)年会期间汇报了关于TERN.101在NASH患者中的Ⅱa期临床试验进展,结果示TERN.101总体安全且耐受性良好,没有因不良事件而停药。治疗可显著降低ALT、校正T1(cT1)弛豫时间和磁共振成像-质子密度脂肪分数(MRI-PDFF)。Cilofexor (GS-9674)、Troifexor、Nidufexor、EDP-305、Px-104、 EYP001、 MET409等在NASH中现已完成Ⅱ/Ⅲ期临床试验,安全性和有效性仍待确定[13]。
2.1.1.2 成纤维细胞生长因子-19 (FGF19)
FGF19是一种内分泌胃肠激素,可通过细胞色素P4507A1抑制胆固醇合成BA和抑制胰岛素诱导的肝脏脂肪生成,其多效性使FGF19激动剂成为一个有吸引力的潜在治疗靶点。Aldafermin(NGM282)是一种FGF19变体,其Ⅱ期NASH试验结果显示可降低ALT水平、减少肝脏脂肪、气球样变并改善纤维化[14]。但2021年5月NGM Bio公司公布了旨在评估Aldafermin治疗F2/3期NASH患者疗效的Ⅱ/Ⅲ期临床试验未达到主要终点,研究失败。
2.1.1.3 顶端钠依赖性胆酸转运体(ASBT)抑制剂
ASBT 抑制剂通过位于回肠腔表面的顶端钠胆汁酸转运蛋白抑制BA再摄取。在高脂饲料喂养的小鼠中,ASBT抑制剂可恢复葡萄糖耐量、降低肝TG和总胆固醇水平并改善了NAS评分。但Volixibat及Elobixibat均因效果不佳已停止针对NASH治疗的药物研发。
2.1.2 靶向脂质代谢的药物
2.1.2.1 过氧化物酶体增殖物激活受体(PPAR)激动剂
PPAR是调节脂质和胰岛素代谢的核受体,属于核激素受体超家族,包括PPARα、PPARβ/δ和PPARγ,它们在不同组织中差异表达,PPAR配体有望成为NAFLD的治疗药物[15]。
尽管有临床前的理论依据,但关于PPARα单一激动剂的临床数据很少。虽然苯扎贝特或非诺贝特等PPARα激动剂现广泛用于治疗高甘油三酯血症,但是目前尚无研究证明对NASH的组织学有所改善。培马贝特(K-877)是一种选择性PPARα调节剂(SPPARMα),2017年于日本获批,Ⅱ期RDBPCT结果显示K-877不会降低肝脏脂肪含量(LFC),但可以显著降低磁共振弹性成像(MRE)测得的肝脏硬度。
选择性PPARδ(SPPARMδ)激动剂Seladelpar (MBX-8025)被寄予厚望,但在NASH患者中的Ⅱ期临床试验(NCT03551522)失败,未到达主要终点,患者LFC的减少程度低于安慰剂组。
PPARα/γ双重激动剂Saroglitazar magnesium在印度批准用于治疗糖尿病患者中的血脂异常。Gawrieh等[16]在NAFLD患者中进行了一项Ⅱ期RDBPCT (NCT03061721),纳入了106例NAFLD/NASH患者,比较三种剂量的Saroglitaza (1、2和4 mg)与安慰剂的作用,以评估Saroglitaza治疗NAFLD/NASH的有效性和安全性。结果显示,4 mg Saroglitaza组可显著改善NAFLD/NASH患者的ALT、LFC、IR和动脉粥样硬化性血脂异常。目前,一项旨在对比Saroglitaza、维生素E和改善生活方式三种治疗方法对NAFLD/NASH的Ⅲ期临床试验尚无结果公布(NCT04193982)。
PPARα/δ双重激动剂Elafibranor(GFT505)可改善NAFLD小鼠模型的脂肪变性、炎症和纤维化[17]。但在AASLD 2020年会上,Harrison教授等[18]报告的Elafibranor治疗NASH(RESOLVE-IT)的Ⅲ期临床试验的中期结果显示,为期72周的Elafibranor(120 mg/d)治疗没有达到NASH缓解且纤维化不恶化的主要终点,RESOLVE-IT试验现已中止。
PPAR泛激动剂Lanifibranor (IVA337,Invetiva Pharm)具有抗纤维化作用[19],已完成为期24周的多中心Ⅱb期RDBPCT临床试验,旨在评估在NASH患者中与安慰剂相比,每天2次服用IVA337 (800 mg和1200 mg)的安全性和有效性,结果显示达到了试验的主要终点和多个次要终点。近日Inventiva公司宣布启动名为NATiV3的Ⅲ期临床试验(NCT04849728),旨在观察Lanifibranor在NASH F2/3期患者中的疗效,主要终点是NASH进程延缓或逆转和肝纤维化的改善,次要终点是肝脏NASH组织学的改善,肝功能指标、糖脂代谢血清学指标的改善。
2.1.2.2 甲状腺激素受体β(Thr-β)激动剂
Thr-β激动剂Resmetirom(MGL3196)用于治疗高脂喂养大鼠的血脂紊乱,可减少肝脏脂肪变性[20]。Ⅱ期临床试验在活检证实的F1~3期NASH和肝脂肪变性≥10%的患者中完成,以MRI-PDFF评估的基线肝脏脂肪分数的变化百分比作为主要结果(NCT02912260)。在NASH患者治疗12周和36周后,Resmetirom治疗显著降低了肝脏脂肪,其不良反应是一过性轻度腹泻和恶心[21]。其Ⅲ期试验(Maestro,NCT03900429)正在进行中,旨在观察Resmetirom治疗NASH合并肝纤维化患者52周的疗效,主要终点是经活检证实NASH改善且至少NAS评分下降2分,不伴有纤维化的恶化,次要终点是纤维化分级下降至少1级且不伴有NASH的恶化和LDL水平升高。另一种Thr-β激动剂VK2809在Ⅱa期研究(NCT02927184)中12周后被证明可以改善LDL-C和降低肝脏脂肪,后续验证正在进行中。此外,处于全球临床开发阶段的口服肝脏靶向性Thr-β激动剂前体药物ASC41在一项Ⅰ期随机、双盲、安慰剂对照的单次和多次递增剂量研究中结果显示可显著降低脂质。
2.1.2.3 成纤维细胞生长因子-21(FGF21)
FGF21是一种肝脏分泌的肽激素,在某些刺激(如禁食、生酮饮食和寒冷暴露)下,可以增加能量消耗,刺激胰岛素敏感性且诱导体质量减轻[22]。在NASH患者中进行为期16周的Ⅱa期试验研究了经皮下注射的FGF21类似物Pegbelfermin (BMS-986036)的安全性和有效性,结果显示一般耐受性良好且显著降低患者LFC[23]。近期结果显示Pegbelfermin在Ⅱb期试验中未达到主要终点, 百时美施贵宝正在终止其研发。Efruxifermin(FGF21融合蛋白)的Ⅱa期试验(NCT03976401)研究结果显示, F1~F3期NASH患者接受治疗16周后,肝脏脂肪显著减少,纤维化获得逆转[24]。据悉,这是首个证实FGF21类似物能够使纤维化消退的临床证据。此外,在一项针对NASH受试者的Ib/Ⅱa期POC研究中,89bio公司的可注射FGF21类似物 BIO89-100 通过MRI-PDFF导致肝脏脂肪分数和体积显著降低,同时具有代谢益处和良好的安全性和耐受性。
2.1.2.4 硬脂酰辅酶A去饱和酶(SCD)抑制剂
胆盐-脂肪酸结合物Aramchol(花生四烯基氨基胆酸)在动物实验[25]中发现对SCD有抑制作用,并显示出对NAFLD的保护作用。2018年Aramchol治疗NASH的Ⅱb期临床试验取得积极结果证实了Aramchol可有效降低肝脏脂肪浸润,并满足了FDA的监管批准终点。我国国家药品监督管理局也已批准Galmed申请的用于治疗NASH和纤维化的Aramchol 的Ⅲ期新药临床试验申请,旨在评估Aramchol(300 mg,2次/d)治疗72周或120周后,在NASH患者中的安全性、疗效及治疗动力学,主要终点是肝脏NASH和纤维化的改善程度(NCT04104321)。
2.1.2.5 脂肪酸合成酶(FASN)抑制剂
脂肪从头合成增多产生了过多的肝内脂肪和脂毒素,FASN抑制剂TVB-2640(ASC40)可用于减少过量的肝内脂肪并直接抑制炎症和纤维化通路。Ⅱa期临床美国队列试验[26](NCT03938246)结果显示12周后,ASC40在NASH患者中以剂量依赖的方式显著降低LFC并改善生化、炎症和纤维化生物标志物。
2.1.2.6 乙酰辅酶A羧化酶(ACC)抑制剂
ACC(ACC1和ACC2)抑制剂是脂肪酸延伸过程中的关键酶。在一项小型的Ⅱ期研究中,当脂肪变性患者服用PAN-ACC抑制剂MK-40741个月后,肝脏脂质从头合成(DNL)减少,但诱导了高甘油三酯血症[27]。来自辉瑞的William P. Esler团队[28]开展的两项平行的Ⅱa期临床试验结果显示,ACC1/2抑制剂PF-05221304单药疗法具有显著的抗肝脏脂肪变性的作用,并改善了一些NASH相关的生物标志物,表明PF-05221304可带来潜在的临床收益,但是高剂量的PF-05221304可能会引起高脂血症进而增加心脏代谢疾病的风险,因此限制了该药物的长期使用(NCT03248882)。相比较而言,PF-05221304和二酰基甘油酰基转移酶2(DGAT2)抑制剂PF-06865571联合用药则避免了这一副作用的产生(NCT03776175)。
2.1.2.7 DGAT2抑制剂
DGAT有两种异构体(DGAT1和DGAT2),是催化TG合成过程中最后一步的关键作用酶。一项关于DGAT2反义抑制剂IONIS-DGAT2 Rx的Ⅱ期RDBPCT[29]结果显示用药组与基线相比LFC显著降低,TG显著减少,有望减缓NAFLD患者的疾病进展(NCT03334214)。2020年9月,DGAT2抑制剂辉瑞PF-06865571片获准在我国开展临床试验。DGAT2抑制剂有望成为治疗NAFLD的候选药物。
2.1.2.8 单磷酸腺苷活化蛋白激酶(AMPK)激活剂
AMPK是一种控制全身能量代谢的酶,PXL770(Poxel)可直接激活AMPK。PXL770通过其直接激活AMPK的独特作用机制,作用于一个重要的生物靶点,该靶点可能治疗包括NASH在内的慢性代谢性疾病。其Ⅱa期临床试验结果显示,与安慰剂相比,PXL770未达到肝脏脂肪改善的主要结果,治疗耐受性良好(NCT03763877)。鉴于PXL770治疗后代谢特征得到改善,AMPK激活可能是T2DM和 NAFLD患者的一个有希望的药理学靶点,也可以考虑用于NASH患者的进一步评估[30]。
2.1.3 靶向血糖调节的药物
2.1.3.1 胰高血糖素样肽-1受体(GLP-1)调节剂
GLP-1类似物通常用于治疗糖尿病,研究表明其也可减少肝脏脂肪。尽管受试者数量很少,一项为期48周的GLP-1类似物利拉鲁肽的临床试验显示相较安慰剂组NASH得到改善[31]。而在NASH患者进行的Ⅱ期临床试验中,使用Semaglutide治疗72周后实现 NASH 缓解的概率显著高于安慰剂组。FDA已授予长效GLP-1类似物Semaglutide用于治疗NASH的突破性疗法认定资格,在我国也启动了Ⅲ期临床试验用于NASH的治疗(CTR20211818)。此外,GLP-1与胃抑制多肽(GIP)和胰高血糖素受体激动剂联合使用可达到协同作用。一项对GIP/GLP-1联合激动剂Tirzepatide的研究[32]显示,NASH的生物标志物得到了改善。最近的数据还表明,GLP-1和胰高血糖素受体共同激动剂Cotadutide可以降低ALT水平并减轻体质量。
GLP-1可被二肽基肽酶-4(DPP-4)快速分解,因此DPP-4的抑制可增强GLP1活性。在NASH小鼠模型中,DPP-4抑制剂可减少肝脏炎症,纤维化和肝肿瘤的发展。目前尚无关于DPP-4抑制剂对NAFLD肝组织学影响的数据。在一项随机对照实验[33]中,与安慰组相比,维格列汀(Vildagliptin)可减少MR评估的LFC,但西格列汀(Sitagliptin)对LFC无影响。
2.1.3.2 噻唑烷二酮(TZD)
MSDC-0602K(Cirius Treeutics)是TZD调节胰岛素增敏剂的线粒体靶点,可调节线粒体丙酮酸载体(MPC),从而改善包括脂质代谢失调、炎症和IR,以及纤维化在内的关键肝脏病理等脂肪肝症状[34]。评估MSDC-0602K在NASH患者中的安全性、耐受性和有效性的为期52周的Ⅱb期临床研究已完成(NCT02784444)[35]。MSDC-0602K治疗组未达到主要临床终点,对NASH肝组织学改善效果不佳。但在T2DM合并肝损伤的患者中,通过非侵入的方式检测肝损伤和糖代谢,MSDC-0602K展现出较好的安全性。目前MSDC-0602K在NASH合并T2DM患者中的Ⅲ期临床试验即将开始招募(NCT03970031)。
2.1.3.3 钠-葡萄糖共转运蛋白2(SGLT2)抑制剂
SGLT2是一种钠依赖性葡萄糖转运蛋白,主要在肾脏的近端小管上皮中表达,负责来自肾小管管腔大部分(>90%)被过滤葡萄糖的再吸收。SGLT2抑制剂可选择性抑制肾脏葡萄糖的再吸收,增加尿葡萄糖排出。在临床试验中,SGLT2抑制剂主要降低肝脏LFC。其中,达格列净和恩格列净显著降低了通过MRI-PDFF评估的肝LFC。在经肝活检证实的NASH合并T2DM患者中,恩格列净在6个月的随访中有效改善了半数患者的肝脏脂肪变性、气球样变和纤维化。
2.2 靶向炎症的药物
2.2.1 磷酸二酯酶(PDE)抑制剂
Tipelukast是一种新型口服生物可利用的小分子化合物,既能抑制PDE3,又能抑制PDE4以及5-脂氧合酶,目前正处于NASH的早期试验阶段(NCT02681055)。生物医药公司MediciNova宣布因Tipelukast在Ⅱa期临床试验的中期分析中达到主要终点,取得了积极结果,将加速开发。
2.2.2 A3腺苷受体(A3AR)激动剂
Namodenoson是一种合成的高选择性A3AR激动剂,通过介导Wnt/β-catenin 通路的失调具有强大的抗炎和抗癌作用。来自以色列的一项多中心、随机、双盲Ⅱ期临床试验[36]旨在评估Namodenoson在治疗NAFLD和NASH患者中的疗效和安全性,结果显示namodenoson可以为通过改善ALT、AST和脂联素等各种肝脏参数为NAFLD患者带来临床益处,同时具有良好的安全性(NCT02927314),其Ⅱb期临床试验已启动(NCT04697810)。
2.2.3 趋化因子受体2/5(CCR2/5)拮抗剂
Cenicriviroc (CVC,Allergan)是一种CCR2/5拮抗剂,主要靶向炎症,还具有抗纤维化和提高胰岛素敏感性的作用[37]。根据Ⅱb期临床试验结果(Centaur研究),与安慰剂组相比,CVC组治疗1年后纤维化显著改善,且降低了全身炎症的生物标志物,其安全性和耐受性与安慰剂组相当。第2年的数据证实了从第1年开始的抗纤维化结果,即CVC的耐受性良好。大多数在第1年达到纤维化应答的CVC患者在第2年仍然保持良好状态,在晚期纤维化的患者中效果更佳[38]。在F2/3期纤维化NASH患者中进行的Ⅲ期临床试验根据Aurora研究第一部分结果,由于缺乏有效性,研究提前终止 (Aurora Study;NCT03028740)[39]。
2.2.4 凋亡信号调节激酶1(ASK1)抑制剂
ASK1被细胞外TNFα、细胞内氧化或内质网应激激活,启动p38/JNK通路,导致细胞凋亡和纤维化[40]。因此,ASK1的抑制认为是NASH治疗的一个靶点。Selonsertib是ASK1的抑制剂,现因在F3/4期纤维化NASH患者中进行的STELLAR3和STELLAR4研究中期分析未达到主要终点而终止。
2.2.5 Toll样受体4(TLR4)拮抗剂
抑制TLR4通路可能是NASH患者预防炎症性肝损伤和肝纤维化的有效治疗手段。JKB-122是一种长效小分子,作为TLR4的弱拮抗剂发挥效能。该药物已在临床前模型中证明具有抗纤维化、免疫调节和抗炎活性,并通过肝保护特性改善肝损伤。我国台湾J制药公司在NASH患者中进行的 Ⅱ 期RDBPCT临床试验[41]结果显示与安慰剂组相比,JKB-121组并没有进一步提高NASH患者的应答率。
2.2.6 半胱天冬酶(caspase)抑制剂
Caspase的激活在凋亡细胞死亡过程中起着核心作用,caspase抑制剂现用于评估NASH和其他形式的肝病。Caspase1/8/9的抑制剂Nivocasan (GS-9450)和泛caspase抑制剂Emricasan (IDN-6556)因不良反应或在NASH患者中治疗效果不佳终止试验。
2.3 靶向纤维化的药物
即使在预防有效及NASH治疗方法可用的情况下,许多患者仍会在没有症状的情况下继续进展,部分患者在初次就诊时就已经诊断为晚期纤维化。因此,通过直接阻断肝星状细胞活化、减少细胞外基质的产生和增加其去除量的疗法来逆转纤维化具有潜在的临床作用。
2.3.1 半乳糖凝集素-3(Galectin-3) 拮抗剂
Galectin-3蛋白在NASH小鼠中表达增加,并诱导肝纤维化的发生,Galectin-3拮抗剂Belapectin(GR-MD-02,Galectin Treateutics Inc.)可显著改善肝组织学,减少胶原沉积[42]。虽然在F3期的NASH患者的 Ⅱ a 期临床试验[43]中没有安全问题,但评估肝纤维化的三种非侵入性试验均未见明显改善。Ⅱ b期临床试验[44]结果也未达主要终点和次要终点(NASH-CX,NCT02462967)。但在另一组无食管静脉曲张的患者中对Belapectin进行的亚组分析显示,2 mg/kg的GR-MD-02可降低HVPG和新食管静脉曲张的发展。评估GR-MD-02预防NASH肝硬化食管静脉曲张的安全性和有效性的试验正在进行中(NCT04365868)。此外,另一种靶向Galectin-3受体的药物GB1211正处于临床评估的早期阶段(NCT03809052)。
2.3.2 整合素抑制剂
整合素是一类膜异源二聚体蛋白家族,在肝星状细胞活化和纤维化形成过程中起重要作用,抑制这些受体蛋白以减少纤维化形成的作用正于NASH在内的许多疾病中评估。整合素抑制剂IDL-2965和PLN-1472在NASH中均处于早期研究阶段。
2.3.3 辛妥珠单抗(Simtuzumab,SIM)
SIM是一种针对赖氨酰氧化酶样酶-2的单克隆抗体,该酶负责胶原的交联,并在纤维化进展过程中过度表达。Simtuzumab有望用于治疗特发性肺纤维化,然而在Ⅱb期临床试验中这种药物在96周的治疗中不能带来改善肝纤维化的额外益处,已退出特发性肺纤维化和NASH治疗试验[45]。
2.3.4 血管紧张素受体阻滞剂
血管紧张素受体也是直接抗纤维化的靶点。血管紧张素受体阻滞剂氯沙坦在NASH患者(NCT01051219)中开始试验,但由于基线血管紧张素受体阻滞剂和血管紧张素转换酶抑制剂使用的高流行率而未能完成[46]。血管紧张素受体阻滞剂氯沙坦目前正在一项儿童NAFLD试验(STOP-NAFLD,NCT03467217)中进行评估。
2.3.5 硝唑尼特
一种被批准用于治疗隐孢子虫病和贾第鞭毛虫病的抗寄生虫药,在临床前模型中可直接抑制细胞培养中的肝星状细胞激活,并减少肝纤维化。NASH(NCT03656068)的Ⅱ期临床试验已完成,结果尚未公布。
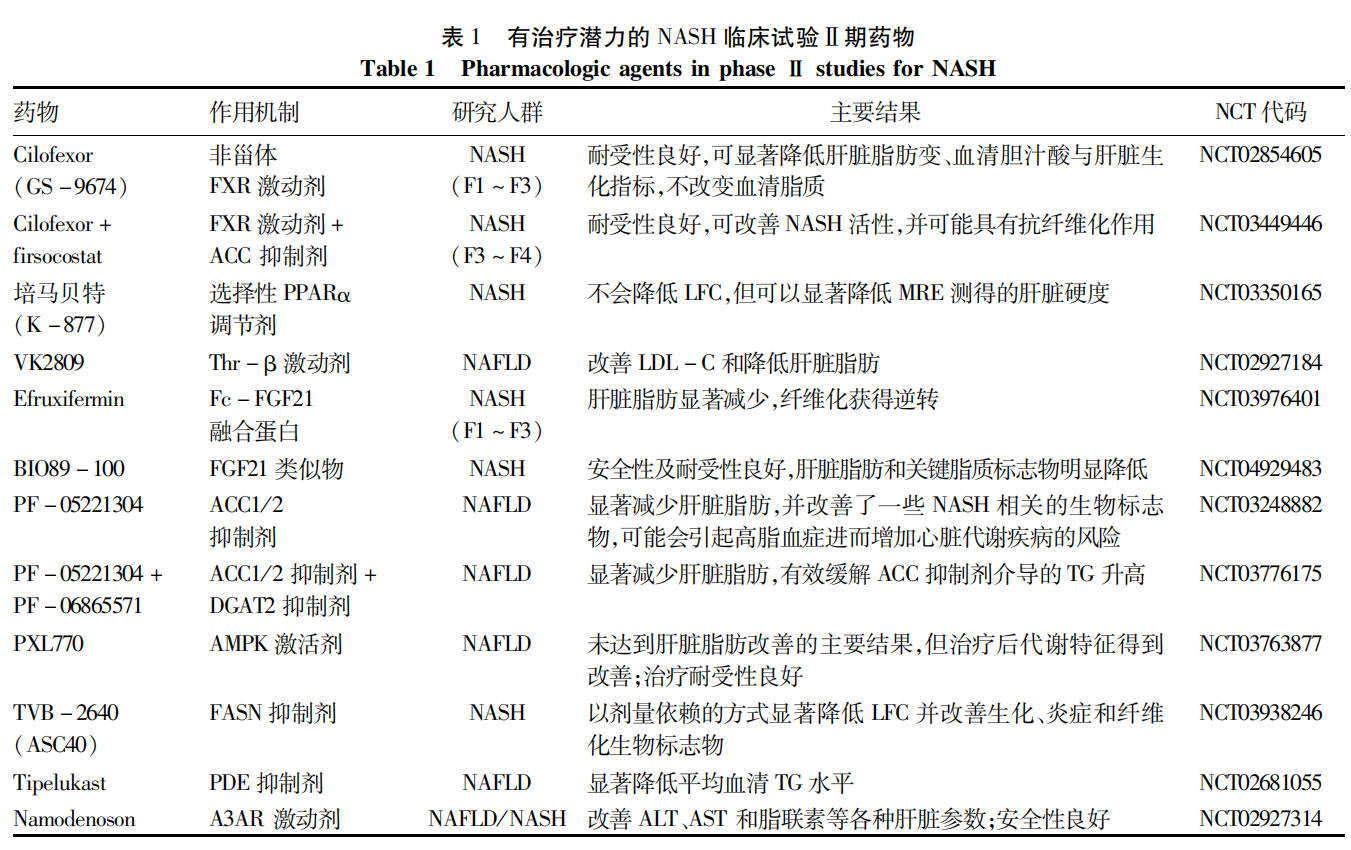
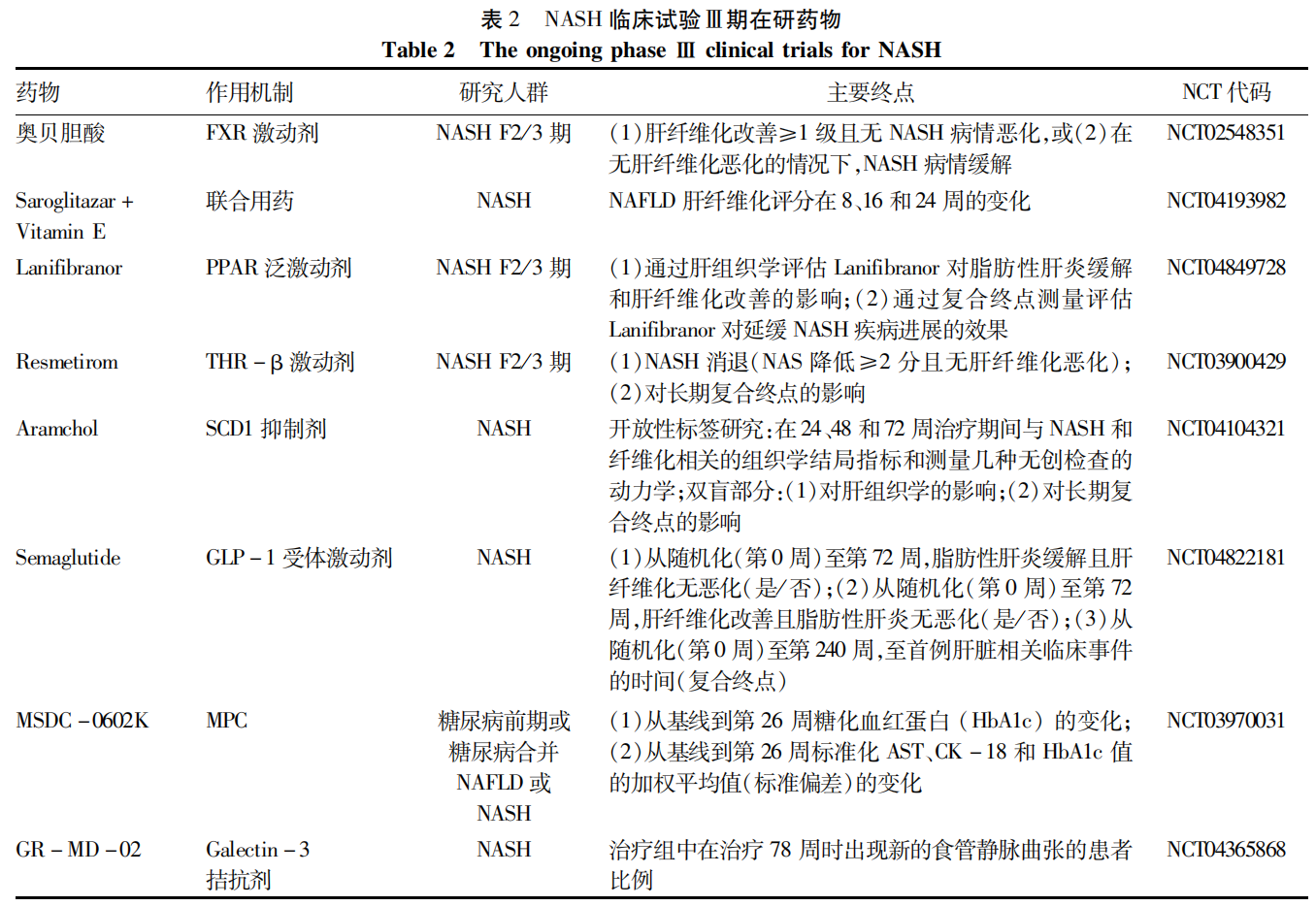
目前有多种药物处于Ⅱa 期和Ⅱb期临床试验中。然而,在Ⅱ期评估的药物治疗中只有一小部分进展到Ⅲ期,进入市场的更少。本文总结了目前有治疗潜力的NASH临床试验Ⅱ期药物以及NASH临床试验Ⅲ期在研药物(表1、2)。
3 小结与展望
为了防止NAFLD发展为肝硬化、肝移植、肝细胞癌和死亡,需要寻找有效治疗NASH的药物。随着人们对NAFLD/NASH的发病机制的不断认知,其药物研究也取得了重大进展。现在研究集中在靶向代谢、炎症以及纤维化等多个潜在的靶点上。总之,随着各种治疗方法的研究,治疗方案也会不断更新。深入了解对某种治疗靶点或靶点组合有良好应答的人群特征,以便能够有效地针对合适的患者使用药物。
点击链接,免费下载全文
靳睿, 王晓晓, 刘峰, 等. 非酒精性脂肪性肝病的药物治疗进展[J]. 临床肝胆病杂志, 2022, 38(7): 1634-1640.
查看更多