查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





相对于药品不良反应监测,药物警戒的内涵有所加深,外延有所扩展。
药品不良反应监测是以“监测”为中心进行的制度安排,强调的是药品上市后的风险管理;
药物警戒则是以“警戒”为中心进行的制度设计,强调的是贯穿药品全生命周期的风险管理。在药物警戒中,监测、分析、识别、评估都是基本手段,风险预警和控制才是最终目的。
21世纪初以来,我国药品不良反应监测工作取得了显著成效。随着国际上对药品风险发生规律的认识及药品监管理念的更新,药物警戒已从传统的上市后药品不良反应监测,拓展到药品研究、生产、销售、使用及监管各环节,包括任何可能影响药品安全的风险因素、不良事件及其防控措施。
欧盟2012年发布的药物警戒实践指南,将药品不良反应定义为“药品产生的非预期且有害的反应”。根据该定义,药品不良反应不仅包括按说明书使用药品引发的有害反应,也包括超说明书用药、药物滥用、用药错误、药品质量缺陷、疗效缺乏、药物相互作用、药物食物相互作用以及职业暴露等引发的有害反应。见图1。
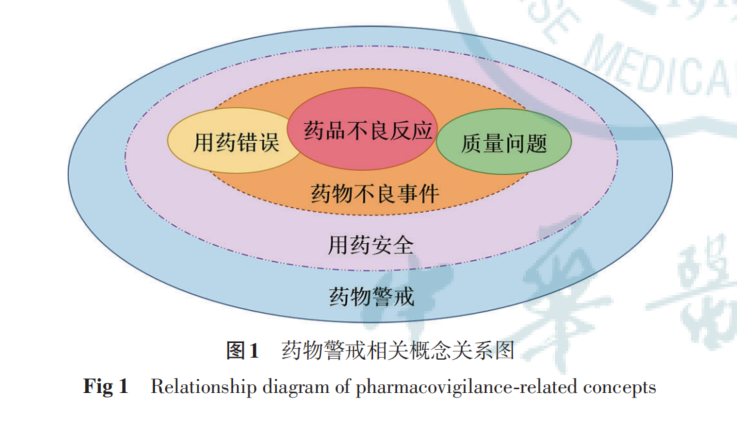
虽然目前我国仍将药品不良反应定义为合格药品在正常用法用量下出现的与用药目的无关的有害反应,但在国家药品监督管理局颁布的《关于药品上市许可持有人直接报告不良反应事宜的公告》和实际工作中,强调的是“应当按照可疑即报原则,直接通过国家药品不良反应监测系统报告发现或获知的药品不良反应。报告范围包括患者使用药品出现的与用药目的无关且无法排除与药品存在相关性的所有有害反应”,以全面收集药品上市后真实世界中药品使用的安全性信息。其工作实质与欧盟药品不良反应定义的范畴是一致的,更能体现保障公众临床用药安全的风险管理目标。
随着《药品管理法》的实施,药品不良反应监测工作扩展到药物警戒范畴。医疗机构作为药品使用的主要场所和药物警戒的关键参与方,应构建本机构的药物警戒体系,以监测、识别、评估、控制药 品不良反应及其他与用药相关的有害反应。医疗机构的所有医务人员,都应该是用药风险的防范者与报告者。
本文节选自《医疗机构药物警戒体系建设专家共识》


换药后剂量怎么调?
查看更多