查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:血管组 应云清
人组织激肽原酶(KLK1)是内源性血管活性丝氨酸蛋白酶,一种参与血管调节的重要因子。在中国,从尿液中提取的激肽原酶——凯力康已被批准用于治疗急性缺血性卒中患者,目前已有60万例患者接受凯力康治疗。2020年发表的Meta分析(Huang et al. JIMR 2020)提示缺血性卒中后使用凯力康可能是有益的。
DM199是第一个重组人激肽原酶药物,研究表明它能够通过增加血流、抑制凋亡/炎症反应、和提高神经可塑性来改善急性缺血性卒中的预后。
ReMEDy是一项随机、双盲、安慰剂对照的临床试验,在澳大利亚的12个中心开展,旨在探索DM199用于治疗缺血性卒中患者的安全性和耐受性。
纳入标准:
1. 年龄≥18岁(无上限);
2. 缺血性卒中发病24h内;
3. NIHSS 6-25分(溶栓或取栓后持续超过1h);
4. 影像学检查;
5. 获取知情同意;
排除标准:
1. 严重残疾(mRS≥4);
2. 治疗期间无法停用ACE抑制剂;
3. 严重过敏体质个人史,如荨麻疹、血管性水肿或其他过敏反应;
4. 目前患有恶性肿瘤,或入组前3年内恶性肿瘤有活动现象;
5. 过去4周内发生严重急性细菌、病毒或真菌的系统性感染;
6. 临床或实验室证据表明入组时急性感染;
7. 已知α1-抗胰蛋白酶缺陷;
8. 确诊HIV、乙肝或丙肝病毒感染;
9. 妊娠、哺乳或在研究期间不愿采取有效避孕措施。
药物使用方法:卒中发病24h内静脉注射DM199或安慰剂,随后每3天进行皮下注射,持续22天。研究期间避免使用ACEI类药物。
主要终点:严重不良事件(SAEs)发生;
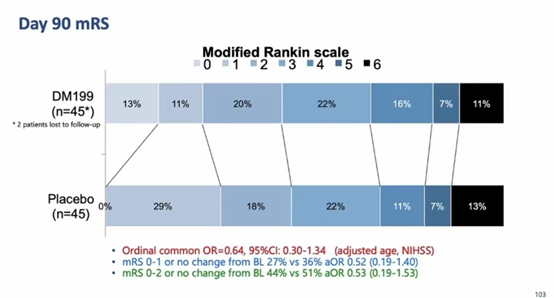
次要终点:90天NIHSS评分,mRs评分,血生物标志物(CRP,MMP等)。
2018年1月到2019年10月,研究共纳入了92例患者,DM199组47例,对照组45例。DM199组和对照组的基线数据相似。
在主要终点中,DM199组20例患者(43%)发生SAEs,对照组14例(31%)患者发生SAEs(P=0.29),两组安全性无显著差异。此外,DM199组和对照组分别有73.9%和48.9%的患者发生非严重不良事件(AEs),最常见的是便秘、恶心、头痛。
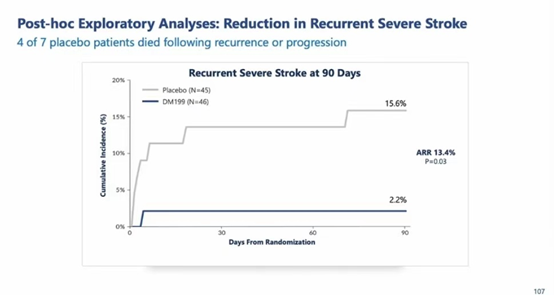
而事后探索性分析发现,DM199减少严重卒中复发(2.2% vs 15.6%,P=0.03)。
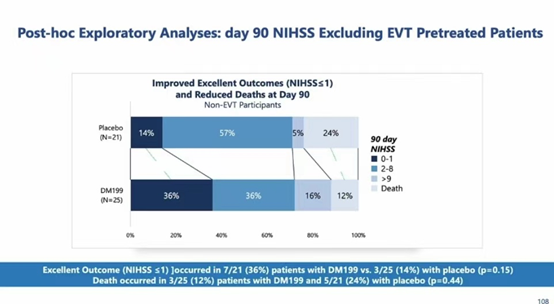
剔除接受血管内治疗的患者后,DM199组NIHSS≤1患者比例更高,死亡患者比例更少,但未达到统计学差异。

研究者认为ReMEDy试验可以证明DM199用于治疗急性缺血性卒中患者的安全性和耐受性。虽然这项试验并不是为了探索DM199是否能够改善患者预后而设计的,但在亚组分析中发现DM199能显著减少患者严重卒中复发率。此外,在未接受机械取栓的患者中,DM199显示出改善预后的可能性。因此,DM199的疗效需要在更大的临床试验中进一步验证。
查看更多