查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者 北京大学肿瘤医院 葛赛 王晰程
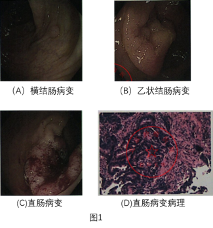
患者男,65岁,体检发现CEA升高,2018年12月行肠镜检查:发现距肛门50 cm可见山田Ⅲ型息肉,表面光滑,充血水肿,无分叶,约0.7×0.6 cm (图1A), 距肛门30 cm可见肿物,表面凹凸不平、糜烂、坏死、质脆、触之易出血,大小约2×3 cm (图1B),病理提示:高级别上皮内瘤变,至少为黏膜内局灶癌变。距肛门13 cm可见巨大溃疡,约占1/2肠壁,表面有污苔、糜烂、坏死,溃疡周围呈环堤样不规则隆起(图1C),病理:中分化腺癌(图1D)。
Q1:什么是同时性结直肠癌?有什么流行病学特点?
同时性结直肠癌(SCRC)是指在首次就诊时,同一患者发现两枚或以上原发肠癌病灶,约占所有CRC的1.1%~8.1%,其中三项样本量超过10000例结直肠癌患者的研究提示SCRC占比约3.1~3.9%,最高报道SCRC同时发现多达6个病灶。男性与女性患病率约1.8:1,平均患病年龄在63岁,患有炎症性肠病、家族性腺瘤息肉病基础的患者罹患SCRC风险更高,报道提示在同时患有炎症性肠病和肠癌的患者中,同时性结直肠癌比例高达20%(22/108),其中患有溃疡性结肠炎的患者出现SCRC的比例更高。
SCRC最常见的发生部位是乙状结肠和直肠,关于两个以上病灶出现在距离相近的同一部位还是不同部位,现有的文献存在较大争议,这也提示了全面术前肠镜检查及术中查体的重要性。与孤立性结直肠癌相比,SCRC累及右半结肠更多,可能与某些遗传易感因素在右半结肠的优势相关。
患者完善胸腹盆CT无远处转移征象,于2018年12月行根治术,术后病理:肿物1(直肠距离断端2.5 cm处),溃疡型中分化腺癌,大小2×2×1 cm,侵犯至直肠旁脂肪(pT3N2bM0);肿物2(距离肿物1约15.5cm处)为溃疡型中分化腺癌,背景为管状腺瘤,大小1.5×1×0.8cm,(pT2N2bM0)。
对肿物1行免疫组化结果为:HER2(0),MLH1(+),MSH2(+),MSH6(+),PMS2(+)。行一代测序(ARMS-PCR)基因测序提示:KRAS12、13、61密码子、NRAS12、13、61密码子、BRAF600密码子全野生型。术后8周期XELOX方案辅助化疗,末次治疗时间为2019年6月。
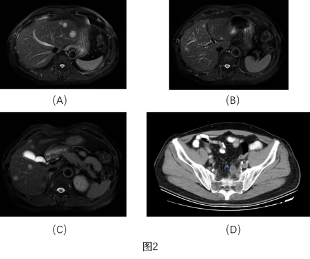
2019年9月,复查无明显复发征象;2020年3月,复查肿瘤标志物:CEA 17.71 ng/ml,CA199 6173 U/ml。肝脏MRI提示多发转移(图2 A-C),直肠上动脉走行区见肿大淋巴结,约22x18 mm(图2D)。胸部CT无转移征象。
MDT考虑患者肝脏转移为潜在可切除,2020年4月开始行第1周期FOLFOXIRI+西妥昔单抗转化治疗,并送燃石医学行二代测序(NGS)基因检测,血液:BRAF V600E(14.47%),TP53拷贝数缺失,TMB 3.99 Muts/Mb,MSS;(肿物1)切片:NRAS p.Q61H错义突变(44.34%),APC移码突变(23.41%),TP53 5号外显子错义突变(26.97%),CCNE1基因拷贝数扩增,TMB 6.98 Muts/Mb,MSS。PD-L1免疫组化:TPS 0%。
Q2:为什么血和肿物出现了不同的测序结果?对下一步治疗有什么影响?
这时首先猜测不同结果是否来源于两个原发肿物的基因背景差别(肿物1 NRAS突变)(肿物2 BRAF突变??)。回顾文献,SCRC同一病例不同病灶间MSI-H、KRAS突变、BRAF突变的一致性分别为9-30%、11-40% 和 0-33%。一项针对20例同时性结直肠癌患者的40个肿瘤组织全基因组测序的结果提示,不同病灶的基因背景大不相同,在20例患者中仅有1例患者两个病灶相同突变基因位点比例超过50%,余下19例患者的两个突变病灶共同突变基因位点不足10%(图3)。文献提示MSI-H的患者在SCRC中占比更高。
同时我们需要考虑二代测序的检测优势,这包括对于低频变体的灵敏度更高,更全面的基因组覆盖(例如非热点突变位点的检测、全基因组的覆盖等),同时对几十万条甚至几百万条核酸序列进行基因检测等等。
治疗方面,患者NRAS、BRAF突变的结果提示我们,相较化疗联合EGFR抑制剂治疗,这类患者化疗联合贝伐珠单抗可能获益更高。
鉴于此,我们再次对肿物2送检NGS检测,并同时第2周期开始更换治疗方案为FOLFOXIRI+贝伐珠单抗治疗,3周期后评效PD(肝S2新发病灶1枚,余病灶部分增大,部分缩小),肿物2行NGS回报:BRAF V600E突变(9.3%),TMB 4.99 Muts/Mb,MSS。测序结果如图4所示。患者目前行肝动脉灌注化疗控制肝脏转移病灶,其间口服呋喹替尼全身治疗,后期可考虑EGFR抑制剂与BRAF抑制剂联合治疗。
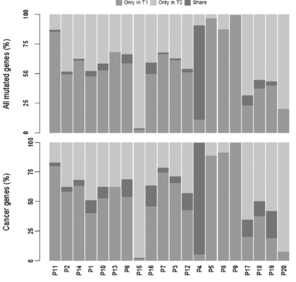
图3 对20例同时性结直肠癌患者NGS测序结果一致性分析
该文献提示:不论是从全部突变基因的角度还是挑选出肿瘤相关基因的角度,20例患者中的18例在不同原发肿物之间的一致性突变比例不足20%(标记为share),这提示很可能多原发肿物来自不同的遗传学背景。
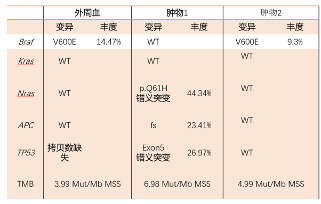
图4 本例患者血液、肿物1、肿物2 NGS测序结果总结
Q3:本例患者对我们带来的进一步思考
1)全结肠镜的运用:
在术前应积极完善全结肠镜检查,对于发现在全部结直肠癌患者中约占比3%的同时性结直肠癌患者非常重要。尤其是老年男性、有炎症性肠病、家族性腺瘤息肉病基础的患者更应重视。对于因肠梗阻等原因急诊手术无法完善术前全结肠镜检查的患者,建议术中探查有无多原发病灶,并在术后3月完善全结肠镜检查。
2)确诊SCRC后推荐对每一个病灶行RAS/RAF及MSI状态检测,以利于后续治疗决策的制定及肿瘤生物学行为推断。
有条件建议对转移灶也进行NGS检测帮助指导治疗。与传统的一代测序等方法相比,NGS检测对低频突变的灵敏度、少见突变位点的覆盖等方面均存在更高的应用价值。像本病例初始我们考虑肿物1分期晚(T3),故送检肿物1和ctDNA的NGS检测。发现血中ctDNA检出BRAF突变与肿物1存在NRAS突变不符。复核分期较早(T2)肿物2发现存在BRAF突变,可解释目前的转移病灶均来源于肿物2。这其实与BRAF突变的恶性生物学行为也非常吻合。
3)文献报道在SCRC人群中RPL22基因p.K15fs位点突变在这组队列中的突变比例为25%(10/40),可能与疾病起源相关,并为提供SCRC的重点筛查人群提供新的思路,尚需进一步分子生物学探索该基因突变与本病发生的相关性。
北京大学肿瘤医院消化内科 平台发布
查看更多