查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





↑↑↑
点我一键到达清单列表
当前,新型冠状病毒病(COVID-19)的大流行仍然是全球公共卫生系统的巨大威胁。最近,COVID-19的大流行在全球范围内出现了许多变异株,特别是新的COVID-19变异株B.1.1529 (Omicron),这是一种备受关注的病毒变异株(VOC),在其刺突蛋白中含有大量的突变,这些突变的位置是由先前感染或疫苗引发的多种免疫反应的靶点,导致了Omicron变异株对人体的中和作用产生了免疫逃逸。令人乐观的是,由Omicron变异株感染产生的疾病症状比之前的毒株更轻,例如无症状、轻症比例的升高和住院率的降低。
然而,考虑到Omicron变异株的超高传播速率,全球卫生系统仍然面临着巨大的压力,因为在一些国家和地区,Omicron变异株在数周内就已超过了Delta和其他病毒变异株。因此,我们在此概述了Omicron变异株的免疫逃逸,低致病性和高传播率特性的分子机理,并在此基础上针对Omicron变异株的防控提供了科学的建议。
新型冠状病毒病(COVID-19)的全球大流行已经持续两年多了。目前,据世界卫生组织(WHO)统计,新冠肺炎已经在全球造成了超过3亿人的感染、540万病例的死亡 。新型冠状病毒的新变种Omicron毒株,最早在Botswana被发现并被上报给WHO,目前已成为最受关注的病毒变异株。然而,Omicron变异株的起源仍然是未知的,因为SARS-CoV-2在传播过程中必须不断变异和进化以适应宿主,而经过基因进化树分析表明,Omicron变异株的基因序列与先前的VOC相比存在着明显的差异(图 1) 。因此,科学家们猜测Omicron变异株很可能由SARS-CoV-2在孤立的人群、免疫功能低下的患者或者未知的动物物种中广泛而独立地进化和变异而来。
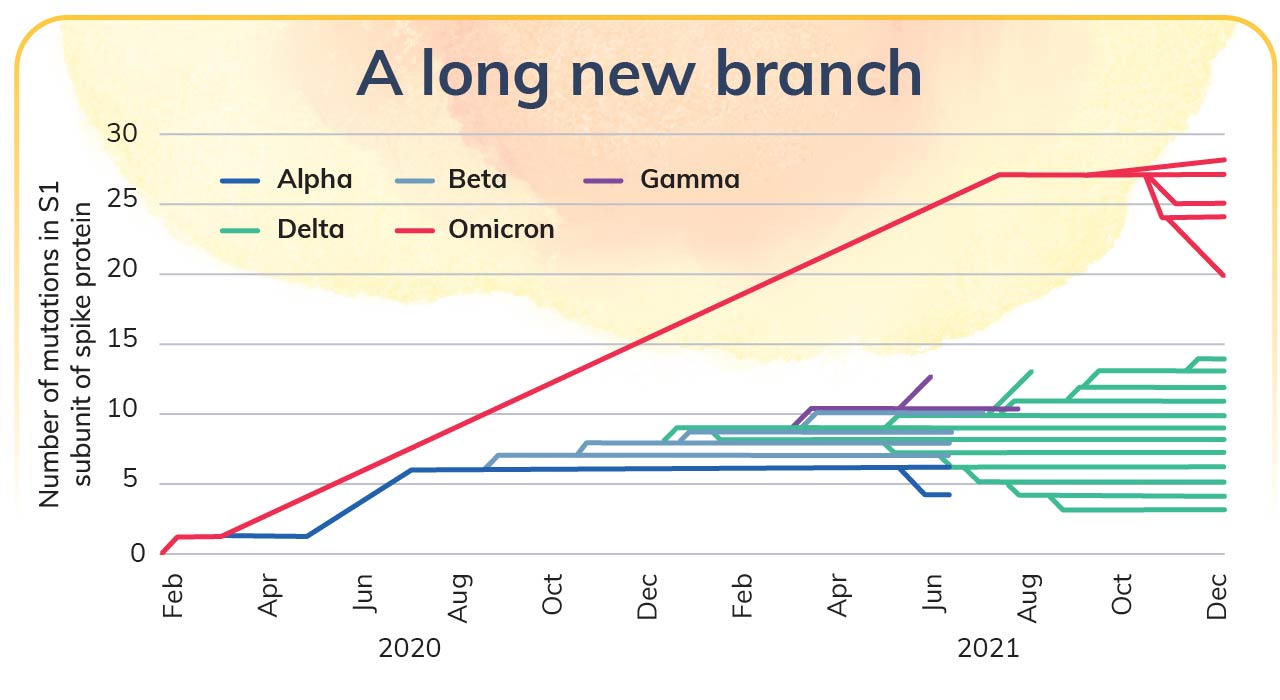
图 1. SARS-CoV-2刺突蛋白S1亚基突变数量的进化树图,Omicron变异株与其他变体存在着明显的距离。每个点代表一种已经测序的病毒。图片引自Kupferschmidt, K的文章。
由于持续的全球传播,SARS-CoV-2会不断地进化成新的变异毒株。第5种VOC,即Omicron变异株,已由WHO发布。目前,在除南极洲以外的每个大陆都发现了这种变异毒株,这表明它具有强大的传播潜力,研究也证实了Omicron变异株的传播能力比Delta变异株高约2~3倍。也有研究表明Omicron变异株的刺突蛋白中的特异性核心独特肽介导了病毒与hACE2的强结合,从而导致病毒与靶细胞的高效融合。Delta变异株与原型相比具有更高的传播能力,然而Delta变异株的RBD与hACE2的结合亲和力与原型RBD相比没有显著变化。随后的研究表明,刺突蛋白中其他区域存在着P681R突变(图 2A),这是S2亚基的切割水平增加的原因,而且拥有D614G/P681R双突变的S2亚基切割水平显著高于的D614G单突变,从而导致Delta变异株的高传播性。Nathaniel L. Miller等人使用氨基酸相互作用(AAI)网络的方法揭示了Omicron变异株中RBD的突变有可能有助于提高其感染能力的两种机制:(1)通过Omicron变异株中RBD的H505突变(图 2A&B)调节Q498 + N501Y协同hACE2的结合效应,从而增强与hACE2的结合;(2)S371L,S373P和S375F突变(图 2A&B)可能为稳定RBD-RBD界面提供适应性优势。Wanchao Yin等人的研究揭示了大多数位于Omicron变异株刺突蛋白表面的突变,使得其与hACE2的结合能力提高了10倍。此外,他们还观察到Omicron变异株特有的hACE2-刺突复合物中不同寻常的RBD-RBD相互作用,支持着刺突蛋白以开放的构象与ACE2结合,为Omicron变异株的高传染性奠定结构基础。Pengcheng Han等人通过解析Omicron变异株RBD与hACE2的晶体和冷冻电镜结构,证明Omicron变异株RBD以与原型相当的亲和力与hACE2结合,这可能是由于免疫逃逸和传播性的多重突变的补偿,Omicron-hACE2和Delta-hACE2的复杂结构揭示了RBD特异性突变如何与hACE2结合的结构基础。
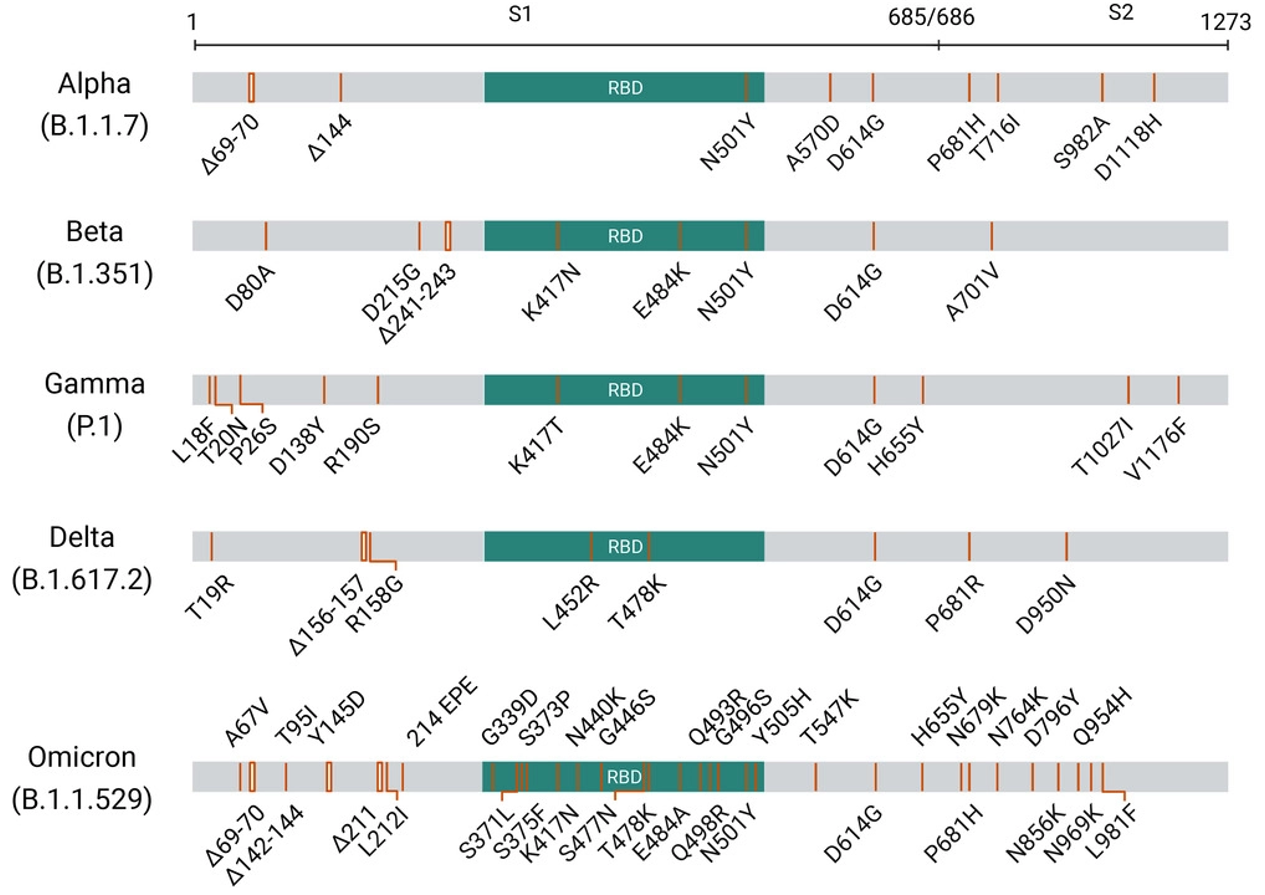
图2A
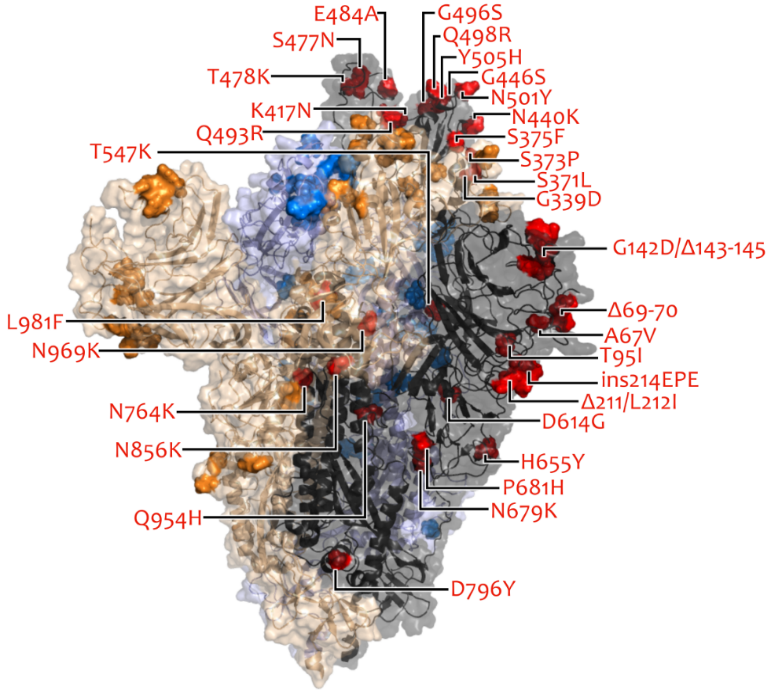
图2B
图 2. A 五个VOC的刺突蛋白序列突变的示意图,图片引自Xuemei He等人的文章。B) 新的SARS-COV-2 VOC,Omicron变异株刺突蛋白上的突变。图片取自COG-UK/Mutation Explorer。
由SARS-COV-2的Omicron变异株会引起较轻的临床疾病症状。Omicron变异株更倾向于感染人的上呼吸道,因为来自一项中国香港的离体实验研究揭示了Omicron变异株在人支气管中的复制速度比Delta变异株快70倍,而在人肺组织中的复制速度比Delta变异株慢10倍,这可能是疾病炎症程度较低的原因之一 。Katherine McMahan等人发现Omicron变异株在叙利亚金仓鼠中的致病性低于先前的SARS-COV-2变异株,因为在Omicron变异株感染中发现鼻腔中的病毒载量较高而肺实质中的病毒载量较低,相同的现象也在小鼠模型上观察到。除了对上呼吸道高度敏感外,Omicron变异株对抗细胞干扰素反应的能力降低,这为临床上观察到的Omicron变异株与Delta变异株相比其致病性显著降低提供了潜在的机制解释。Omicron变异株的刺突蛋白特异性核心中的免疫调节NF9肽没有受到明显的影响,这个结果进一步证明了与其他VOC相比,Omicron变异株的致病性更低。
SARS-COV-2的Omicron变异株表现出强大的免疫逃逸能力。与武汉原始毒株相比,Omicron变异株含有60多个氨基酸的突变,缺失或插入,其中超过50% (34个)位于刺突蛋白上,这是大多数治疗性抗体和疫苗起作用的靶点,这为Omicron变异株的免疫逃逸和对疫苗抗性提供遗传基。通过Omicron刺突自身的三聚体结构或与hACE2和抗Omicron抗体复合物的结构分析表明,大多数Omicron突变位于刺突蛋白的表面,这使得其与ACE2有接近10倍的更强的结合力,但是它们也成为许多治疗性抗体的非活性表位,使得Omicron变异株有对抗治疗性抗体中和作用的能力。通过解析Omicron RBD-hACE2复合物以及Delta RBD-hACE2复合物的晶体和冷冻电镜结构,Pengcheng Han等人揭示了Omicron变异株在RBD的受体结合基序(receptor-binding motif, RBM)存在着大量的突变,其中在E484和Q493位置的突变在Omicron变异株的免疫逃逸作用中起到了关键作用。
迄今为止,已有8种疫苗,包括灭活的全病毒疫苗(Coronavac、BBIBP-CorV 和Covaxin)、mRNA疫苗(BNT162b2和mRNA-1273)和腺病毒载体疫苗(Ad26.COV2.S、AZD1222、Covishield)已经被紧急批准上市。据报道,与之前的VOC相比,目前针对Omicron变异株的疫苗的保护效力下降,但它们可能仍能提供一定的保护。专家强调,两剂mRNA疫苗对于Omicron变异株的中和作用较差,而第三剂mRNA疫苗可以加强免疫以增加保护作用。与mRNA疫苗相比,用第三剂腺病毒载体疫苗(杨森/强生公司制造的Ad26.COV2.S)加强免疫后的所起的保护作用仍然存在争议。由于目前还缺乏相关数据,因此很难预测其他疫苗的第三剂加强免疫后的对抗Omicron变异株的活性。
目前,Omicron变异株的详细特征变得越来越清晰。鉴于在之前的VOC中的刺突蛋白中也观察到同样的突变,这表明了目前的公共卫生措施,包括保持通风、保持安全距离、勤洗手和戴口罩也能有效应对Omicron变异体。与以往的VOC类似,早期诊断和及时隔离对于切断Omicron变异株的传播也很重要。此外,接种第三剂疫苗加强免疫,开发Omicron特异性疫苗,针对Omicron变异株筛选和开发有效的药物和广谱中和抗体等举措被认为是行之有效的。
来自以色列和英国等几个高收入国家的真实数据证明,第三剂疫苗的接种的确可以大大降低患COVID-19的风险。鉴于基于mRNA的疫苗加强剂的接种确实可以恢复甚至提高疫苗的有效性,我们认为基于mRNA的疫苗加强剂的接种无疑可以帮助和控制Omicron变异株的传播和感染。
随着SARS-CoV-2的不断突变和进化,基于野生型病毒开发的疫苗的保护作用开始变得不那么有效。大量研究表明,目前的COVID-19疫苗不能像以前的VOCs那样有效地对抗Omicron变异株。因此,我们必须开发基于刺突突变的变异株的特异性疫苗,尤其是针对Omicron变异株的疫苗。
尽管Omicron变异株中有大量的突变,但研究已经证明,Omicron分离株对八种最重要的抗SARS-CoV-2药物和候选药物都表现出相似的敏感性,包括瑞德西韦、莫努匹韦和PF-07321332(paxlovid的活性成分)。Omicron变异株中RBD的大量突变引起了人们对抗体治疗有效性的担忧。令人乐观的是,研究已经表明,针对SARS-CoV-2变异株中保守表位的广谱中和单克隆抗体,如我国已上市的单克隆抗体BRII-196和BRII-198,是遏制和治疗Omicron变异株的关键。尽管关于针对Omicron变异株的药物和抗体治疗策略仍有许多地方待改善,但它们的治疗效果已在以往研究中得到证实。
综上所述,如果我们采取科学的预防和控制措施,我们可以赢得与COVID-19的战争。
作者 深圳市第三人民医院传染病科室,国家传染病临床研究中心 卢洪洲
查看更多