查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






最近笔者读了一篇题为"Controversies in the recent (2016) World Health Organization classification of acute myeloid leukemia"的文章。
文章阐述了世界卫生组织(WHO)分类中一些值得探讨的问题,不管是知识的更新,还是学习用于工作上指导骨髓形态学诊断都有一定意义。
WHO采用20%原始细胞界值作为诊断AML与治疗分界,即原始细胞≧20 %的AML常接受高强度的诱导治疗,而原始细胞<20%通常接受低强度治疗,如去甲基化药物。此外,临床试验也常将原始细胞%作为纳入或排除标准,并根据原始细胞数量高于或低于20%进入不同临床试验。
2001年WHO分类将AML 原始细胞百分比从30%降低到20%,一些研究发现20%-29%原始细胞的患者表现更类似于MDS,而不是高原始比例的AML。如20%-29%原始细胞的病例中VEGF和Caspase 3水平与MDS更为接近。
此外,低原始细胞<30%的AML(寡原始细胞性AML)较高原始细胞AML而言,具有不同的分子学特征(FLT3-ITD突变较低),且预后也比高原始细胞AML好。
一些研究表明,低原始细胞AML采用MDS方案(去甲基化药物)治疗有良好反应。
至少一些目前被归类为AML的病例在生物学上与MDS更为相似,这些患者可能受益于MDS治疗方案。
事实上目前NCCN指南中将原始细胞稳定在20%-29%范围的患者考虑为MDS。相反,另一些原始细胞<20%的髓系肿瘤在生物学上更类似AML,而非按当前分类为低级别类型肿瘤。
WHO对于AML具有明确定义的基因异常,不管原始细胞多少,都诊断为APL和CFB-AML。
另外最近研究发现对于低于20%原始细胞计数的患者,发现NPM1突变和inv(3)/t(3;3)遗传学异常也可确定为临床上侵袭性的一种血液疾病。
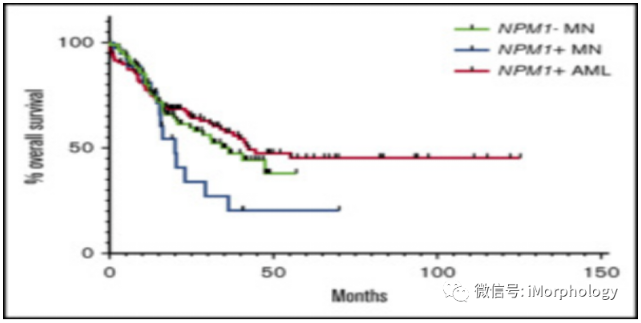
尽管MDS或CMML的原始细胞中NPM1突变少见,一项针对少数此类患者的研究表明,应该采用高强度AML治疗方案将会使这类患者受益。
很多情况下,AML发生与MDS/其他低级别髓系肿瘤是一个连续发展的过程,因为它们之间的克隆负荷和遗传特征相似,然而单纯采用20%原始细胞界值将AML与MDS分开,显然有点武断。
即使采用这个标准,原始细胞计数也会受到观察者之间的影响,导致MDS和AML诊断上的偏差。用原始细胞百分比作为AML诊断的界限,其本质上是有缺陷的。未来组合特定的遗传学信息将更有效地明确这一组临床表现与治疗同质的疾病。
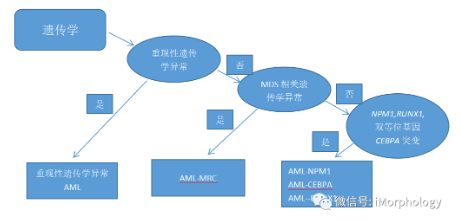
AML是一种异质性疾病,故应将AML分成生物学上彼此不同的AML亚型。下图(A,B,C)为根据WHO进行分类的“规则”。该规则根据临床病史、遗传学信息及形态学进行分类。最近,Papaemmanuil等人将1540例AML病例采用一种单纯以遗传特征分析算法进行分类,分成不同的遗传学组,得到基因组AML分型。
许多基因组分类与WHO AML亚型完全重叠,如NPM1突变的AML、CEBPA双等位基因突变的AML等亚型。
然而,有些类型与WHO分型有部分重叠,提示该分类法目前尚不能合理地用来分类。
如该分型提出一组TP53突变和/或非整倍体染色体类别,这组患者呈现一致性的不良预后,是一种生物学均一的类型。
但按照WHO分型包含了t-AML和AML-MRC两个类型,提示目前仅根据复杂细胞遗传学而将AML归为AML-MRC,和有治疗病史而将AML分为t-AML是不合适的。
事实上,许多临床试验或FDA针对CPX-351(Vyxeos)特异性治疗的适应症,将AML-MRC和t-AML合并归类为一个“继发性AML”组。
临床病史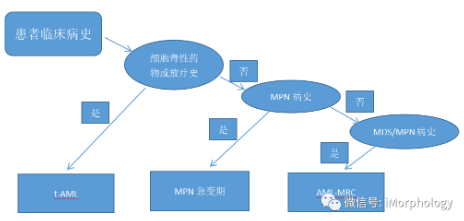
遗传学信息
形态学
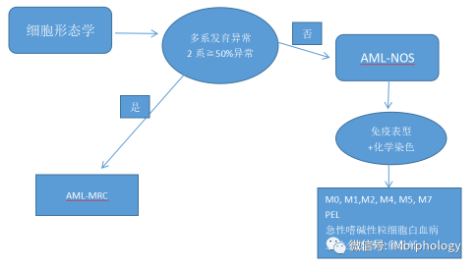
AML-MRC分类已被临床证实为一种侵袭性AML亚型,但对于来自临床病史(MDS或MDS/MPN)和形态学确定的AML-MRC亚型存在争议。
根据MDS或MDS/MPN病史来诊断AML-MRC时,需要患者有MDS或MDS/MPN病史,而部分患者在进展为AML前,根本没有完整的骨髓诊断结论证实MDS,所以其MDS病史也就无法判断。
事实上AML之前具有血细胞减少(但未明确MDS)患者的预后比无血细胞减少患者预后差。
因此,可能会将MDS发展而来的正常核型AML与复杂核型的初发AML的两个生物学上不同的实体归类为AML-MRC,而未采用相应的不同治疗方法。
AML-MRC诊断可能最具争议的是形态学标准(至少2系以上50%的细胞发育不良)。
有研究评估,争论在于细胞不良发育是不良独立预后,还是仅仅反映不良的细胞遗传学和/或突变。
2016年WHO分类,对NPM1突变或双等位基因CEBPA突变的AML进行分类时,不再考虑多系发育不良,但这种形态学标准仍然适用于缺乏明确遗传特征的AML分类。
另在一项研究发现巨核细胞发育异常对细胞遗传学正常的初发AML是独立的预后因素,而WHO中红系与粒系判断细胞发育异常标准遭到质疑。
此外,很大一部分AML中非原始细胞数量不够多,以至于无法评估细胞发育不良,使得该形态学判断标准在实践中较难运用。
t-AML是指之前有过化疗或放疗病史的患者发生AML。
t-AML病例有很大一部分携带TP53突变,细胞毒性损伤促进了骨髓中先前存在的突变克隆演变,时间延长,这些克隆可能演变为AML。而随着初发AML患者细胞遗传学和分子学检查的普遍开展,由此产生的问题是“治疗相关”所体现的价值是什么?
尽管目前尚不清楚初发AML患者(病因不明)TP53突变与已知细胞毒性治疗TP53突变AML患者预后是否不同,然而按照WHO,这2种类型应诊断为不同WHO亚型。
相反,NPM1和FLT3-ITD突变的正常核型AML病例(无其他致病性突变),即使其中1例先前接受过前列腺照射,可能生物学相似。
所以当考虑到遗传因素,以及其他患者和疾病相关的风险时,“治疗相关性”是否为AML的独立预后因素的结论是有争议的。
但目前WHO AML分类中,“治疗相关性”是优先级别,即使他们的遗传特征表明生物学上具有良好预后,也会因分类(t-AML)原因,将导致一些患者接受了不适当的“高危”治疗,或被排除在临床试验之外。
细胞毒性治疗的AML患者,其预后是由潜在的遗传学驱动的,所以对此类AML采用遗传学与突变信息进行分类比较合适,而“治疗相关”可以作为一种附加注解。
作者:朱建锋
来源:iMorphology
↑↑↑点击海报,进入专题
查看更多