查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






岁聿云暮,华章将启。当2025年的时间卷轴缓缓收束,消化内镜及消化系疾病领域在临床研究与实践探索中留下了诸多坚实足迹,新技术的涌现、新理念的更迭以及循证医学证据的不断累积,正在深刻重塑着我们对疾病的认知与临床实践决策。
为了帮助广大临床医生系统梳理学科脉络,准确把握前沿进展,《中国医学论坛报》年度盘点栏目特别邀请了消化领域各亚专业的领军专家,对2025年度的临床研究进展进行深度回顾与总结。
医院:首都医科大学附属北京友谊医院
作者:韩牧洲 程芮 李鹏 张澍田
张澍田 教授

首都医科大学附属北京友谊医院
主任医师 博士生导师
首都医科大学附属北京友谊医院 院长
国家杰出医师
国家临床医学研究创新战略联盟秘书长
消化系统疾病国家临床医学研究中心主任
消化健康全国重点实验室主任
中华医学会常务理事
中国医师协会常务理事
中国医师协会消化医师分会名誉会长
世界华人消化医师协会会长
世界消化内镜学会指导委员会委员
亚太消化内镜学会委员
李鹏 教授

首都医科大学附属北京友谊医院
主任医师、博士研究生导师
中华医学会消化病学分会常委
北京医师协会内镜超声分会主委
北京医学会消化病学分会副主委
消化道早癌起病隐匿,及时的精准识别与干预是提升患者生存率的关键。然而,早期病变的漏诊风险与风险评估的主观性仍是临床实践面临的严峻挑战。2025年,消化道早癌诊治领域取得了跨越式进展。随着多模态成像技术、人工智能基础模型以及非侵入性风险分层策略的协同演进,该领域涌现出一批里程碑式研究,深刻推动了诊疗体系向精准化与标准化转型。
《中国医学论坛报》特邀首都医科大学附属北京友谊医院张澍田教授、李鹏教授团队系统盘点2025年下一代内镜成像、AI诊断、液体活检及机器人治疗的最新突破,并展望其对临床路径的重塑价值。
2025年,消化内镜成像的一个重要趋势,是从二维表面观察迈向三维结构-血管一体化评估。随着消化内镜成像技术的不断发展,研究者们正探索更高精度的三维微结构与微血管成像方法,以进一步提升Barrett食管(Barrett’s esophagus,BE)等食管早期病变的检出率。
发表在Nature Biomedical Engineering的一项研究报道了一种融合光学相干断层扫描(OCT)与超宽带光声显像(OPAM)的新型胶囊内镜成像技术——O2E(Optoacoustic-OCT Endoscopy)。该系统采用直径约12.5 mm的旋转胶囊设计,无需外源性对比剂或染色剂即可在1~2.5 mm的探测深度内同步获取黏膜微结构与功能性微血管网络信息。技术参数显示,其OCT模式的横向与轴向分辨率分别达10µm和7µm,负责精准刻画黏膜层次,而OPAM模块在选用高频重构(40~110 MHz)条件下能以约30µm的横向分辨率捕捉血红蛋白富集的异常血管结构,实现了物理结构与生物功能信息的深度互补(图1)。
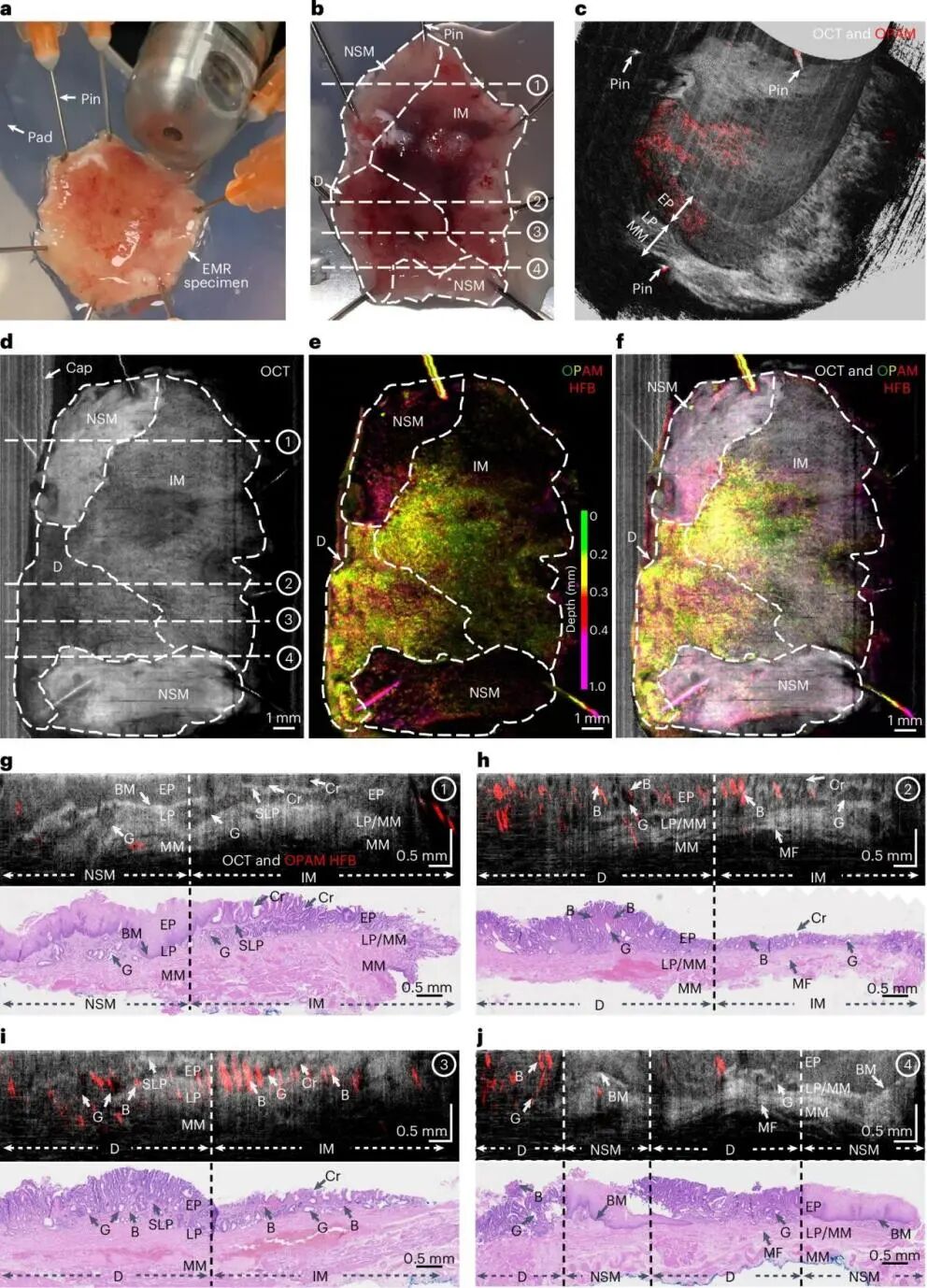
图1. O2E胶囊内镜对Barrett食管切除标本的多模态成像示例。
在对10例BE患者的14份切除标本进行验证时,研究者发现在单一使用OCT图像进行分类时,分辨高级别病变仍存在较低灵敏度,而融合OPAM后的O2E系统对肿瘤性病变的识别能力发生质变:其在ROI层面的灵敏度和特异性分别达到91%和94%,在患者层面更是高达94%和100%,该混合成像模式表现出的灵敏度与特异性均显著提升,显示出充分的潜力,但其临床验证数据尚不足以直接与现有指南推荐标准对比。通过同步捕捉黏膜微结构紊乱与肿瘤相关新生血管形态,该技术有望在未来大幅降低BE随访中的随机活检需求,推动早癌诊断从“经验性观察”向“定量化物理诊断”转型。
随着消化道早癌筛查需求的增加,内镜检查仍是诊断Barrett食管及食管胃交界腺癌的金标准,但其高成本、侵入性及对操作经验依赖大大限制了大规模筛查的可行性。近年来,研究者们开始探索结合人工智能的图像分析技术,以提高早期病变的检出率并优化内镜资源配置。
2025年,一项被接收至eClinicalMedicine的多中心研究首次提出了一种基于AI基础模型的内镜图像分析方法,用于识别和分期食管胃交界腺癌(EGJA)。该研究开发了一种结合AI基础视觉模型(DINOv2)与卷积神经网络(ResNet50)的创新诊断体系,旨在利用DINOv2的自监督全局特征提取能力与ResNet50的局部病灶捕捉优势,实现对EGJA的实时识别与精确分期(图2)。
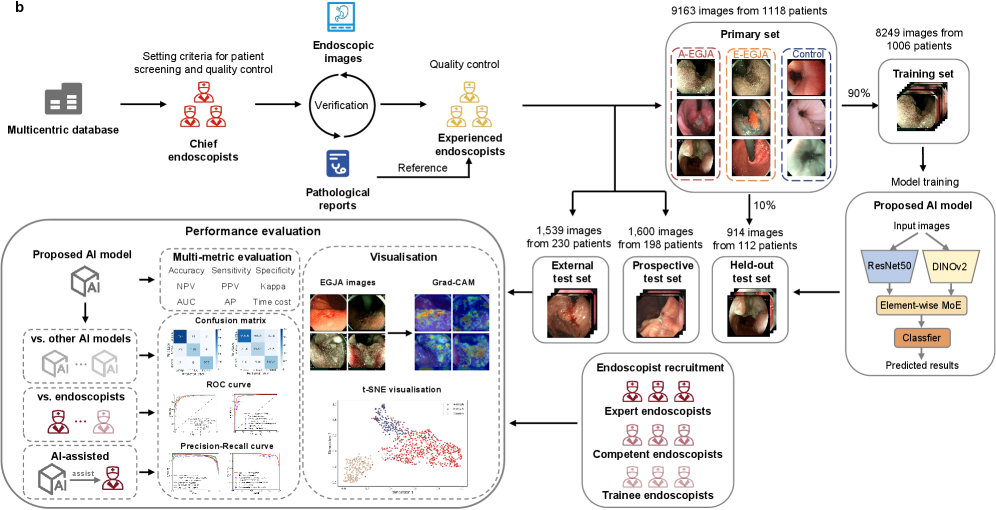
图2.用于实现食管胃交界腺癌(EGJA)的分期诊断的AI模型的开发与评估过程
在涵盖1,546例患者、12,302张图像的大规模训练基础上,该模型在独立外部验证集(准确率0.8895)与前瞻性临床测试(准确率0.8956)中均表现出极佳的鲁棒性,显著优于传统单一架构模型。更为关键的临床意义在于,该系统展现了强大的“专家级赋能”效应:在AI辅助下,初学者与中级内镜医师的诊断准确率分别从0.7035和0.7350跃升至0.8497和0.8521,显著缩小了不同年资医师间的诊断缺口。这表明,基于基础模型的AI体系不仅能够独立完成高精度的早癌筛查,更作为一种可靠的决策支持工具,为优化临床流程、提升基层检出效率提供了标准化的技术路径。
在深部成像诊断领域,胃肠间质瘤(GIST)的术前恶性风险评估对制定临床策略至关重要,但传统内镜超声(EUS)判读高度依赖经验判断,主观性强且难以精准区分不同风险等级。
2025年发表在Endoscopic Ultrasound的一项研究提出并验证了一种基于深度学习的风险预测模型(DLRPM),该模型与传统统计预测模型(TRPM)及二者融合的综合模型(CRPM)一同用于基于EUS图像的风险分层评估。本研究共回顾性分析了341例GIST患者的1019张线性EUS图像,用于模型开发及评估。结果显示,基于DenseNet‑121架构的DLRPM总体准确率达92.65%,显著优于TRPM(71.10%);融合模型CRPM也表现良好(90.32%)。在ROC曲线分析中,DLRPM的AUC可达0.932,明显高于TRPM(0.843),而CRPM的AUC为0.909。尽管不同模型间的AUC差异在统计学上未达到显著水平,但这些结果表明,深度学习方法在GIST风险分类任务中具有优异的判别能力。
这一AI辅助的EUS图像定量评估模式为术前风险预测提供了更为客观的信息基础,有望为GIST患者的个体化手术干预和随访策略制定提供高可信度的决策支持,但其在更大规模前瞻性队列中的稳定性仍需后续验证。
当内镜检查难以覆盖大规模普查人群时,无创分子检测成为连接公共卫生与精准医疗的关键桥梁。
2025年发表在Molecular Cancer上的一项多中心前瞻性队列研究(GUIDE研究)推出了一种名为GutSeer的血液检测方案。该方案的核心突破在于整合了cfDNA甲基化标记与片段组学(fragmentomics)特征,构建了针对五种主要消化道癌(结直肠、食管、胃、肝、胰腺)的双维度靶向测序面板(图3)。
图3. GutSeer研究的整体设计示意图
在独立验证队列中,GutSeer展示了卓越的检测性能,GutSeer在整体GI癌的分类识别中取得了AUC=0.950(95%CI 0.937~0.962)、82.8%敏感性及95.8%特异性的高检测性能。尤为突出的是,该方案对Ⅰ/Ⅱ期早癌的整体敏感性保持在81.5%的高位,并在结直肠癌(92.2%)与肝癌(92.9%)的检出率上表现优异。此外,该技术不仅限于“判别肿瘤存在”,更在独立测试集中展现了捕获食管及胃部高级别癌前病变的潜力。这一研究实证多维分子标志物在消化道早癌识别中的精准度与临床可行性,为将高精度血检纳入常规体检流程、优化内镜资源配置提供了坚实的循证支持。
在进一步提升筛查覆盖率的探索中,2025年发表在Journal of Advanced Research的一项研究推出了名为SPOGIT的cfDNA甲基化检测方案(图4)。该技术通过整合多种机器学习算法,不仅优化了早期胃肠道肿瘤的识别性能,更在病灶溯源与临床获益预测方面取得了重要突破。在多中心外部验证中,SPOGIT对胃肠道肿瘤整体的敏感性与特异性分别为88.1%和91.2%。值得关注的是,该模型对0–Ⅱ期早癌表现出极强的捕获能力(敏感性83.1%),并对高级别腺瘤及高危癌前病变实现了分别为56.5%和62.4%的预警。针对多癌种检测中“定位难”的挑战,该方案配套的CSO(Cancer Site Origin)模型实现了对结直肠癌(83%)与胃癌(71%)的来源定位。这一功能显著缩短了从“血检阳性”到“靶向内镜精查”的临床路径。模拟分析进一步表明,该无创筛查策略有望将晚期诊断比例从约57.1%降至4.4%,预计提升5年生存率约27%,从而为胃肠道癌症的精准筛查与临床决策提供创新性支持。
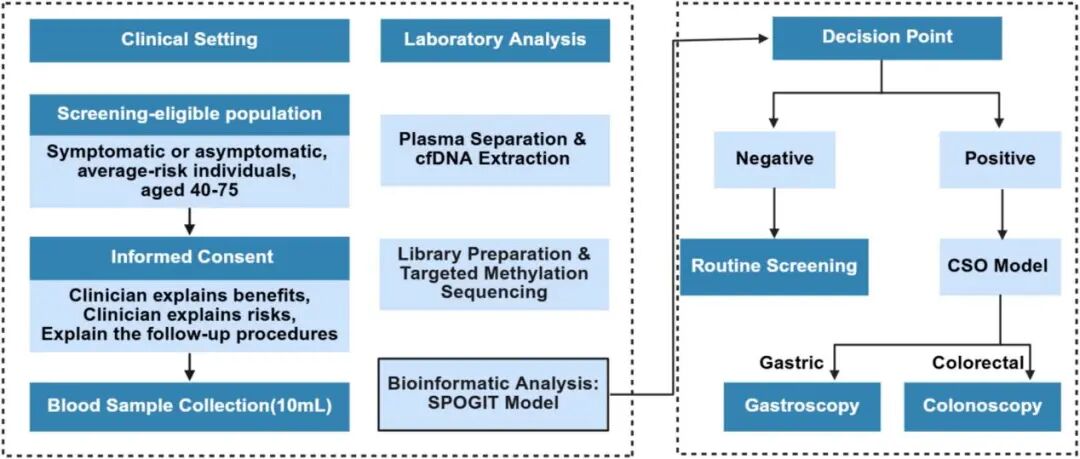
图4.SPOGIT/CSO检测的临床流程示意图
传统的Barrett食管(BE)检测高度依赖侵入性内镜及随机活检,这不仅给患者带来负担,也在医疗资源受限地区造成了严重的资源错配。如何精准识别高危进展人群、减少低危患者的过度随访,是2025年食管早癌管理的核心议题之一。随着非内镜取样技术与分子标志物检测的成熟,BE管理正逐步由“全员内镜检测”向“精准风险分层”转型。
2025年发表于《柳叶刀》(Lancet)的一项前瞻性多中心真实世界研究,为这一转型提供了关键证据。
该研究系统评估了基于胶囊海绵取样(Cytosponge)结合分子标志物检测的非内镜风险分层策略(图5),旨在通过非侵入性途径对Barrett食管患者进行精准风险分类,以优化内镜资源的配置、提高早期病变检出率并降低不必要的侵入性检查需求。
图5.基于胶囊海绵联合生物标志物的Barrett食管患者风险分层策略
在对910例非异型BE患者的随访中,该策略展现了极佳的预后预测价值:约54%的患者被归入低风险组,其疾病进展率仅为0.4%,阴性预测值(NPV)高达97.8%(95%CI 95.9~98.8),为延长随访间隔、减少过度医疗提供了坚实证据。
相比之下,仅占15%的高风险组患者展现了显著的病变富集效应,阳性预测值(PPV)达37.7%,(95%CI 29.7~46.4),且携带异常生物标志物特征(如p53异常表达或腺体结构异常)的患者发生高级别异型增生或癌变的风险显著高于低风险组,相对风险比高达135.8(95%CI 32.7~564.0),尽管置信区间较宽,但仍显示出显著的风险富集效应,突出了该风险分层工具在识别真正高危人群方面的临床价值。此外,数字病理与机器学习的深度集成使人工复核样本量优化至32%,显著提升了该方案在大规模人群筛查中的可扩展性。
整体而言,这一基于非内镜取样的风险分层策略能够在真实临床环境中有效区分低风险与高风险Barrett食管患者,为优化内镜资源配置、减少不必要检查并强化高危人群监测提供了切实可行的路径。目前,这一技术已突破研究阶段,通过英国NHS的Project COMPASS项目正式进入社区筛查体系;与此同时,国际指南亦开始强调风险分层理念,为全球范围内实现医疗资源的精准投放提供了重要的循证范例。尽管中国现行指南仍以内镜作为早癌诊断的金标准,但其建立的规范化内镜随访框架,已为高风险人群的管理奠定了基础,并为未来新技术的引入预留了空间。
在早期结直肠肿瘤的微创治疗中,内镜黏膜下剥离术(ESD)凭借其优越的整块切除率(En bloc resection)和极低的局部复发率,已成为临床诊疗的核心手段。然而,传统ESD操作对内镜医师的空间感知与双手协调能力要求极高,其陡峭的学习曲线严重制约了该技术在全球范围内的规范化推广。
2025年,发表于Gut的一项重磅研究展示了解决这一难题的技术曙光:美国Brigham and Women’s Hospital与哈佛医学院团队成功开发并评估了一种新型腔内机器人辅助ESD平台。该机器人辅助ESD平台是由EndoQuest Robotics开发的内腔机器人系统,包括柔性机器人内镜主机、医生控制台及可更换的内镜器械。
该研究采用随机交叉试验设计,邀请10名完全无ESD手术及机器人操作经验的初级医师参与评估。试验结果显示,在处理开放式ex‑vivo(离体)牛结肠模型病变时,机器人辅助组的整块切除率高达100%,而传统ESD组仅为40%(P=0.011);此外,机器人系统显著优化了手术效能,平均手术时间从85.1 min大幅缩短至32.3 min(P<0.001),且伴随更低的肌层损伤率与穿孔率。值得注意的是,操作者报告的身体与心理工作负荷评分在机器人组中显著下降,说明该系统不仅提升了手术效率和安全性,还减轻了操作负担。
该技术的成功应用,标志着内镜手术正由依赖个人经验的技术向高度标准化的“工程化操作”演进。尽管其在复杂活体环境中的表现仍有待进一步临床验证与长期评价,但机器人辅助ESD无疑是2025年内镜治疗领域最具潜力的突破之一。
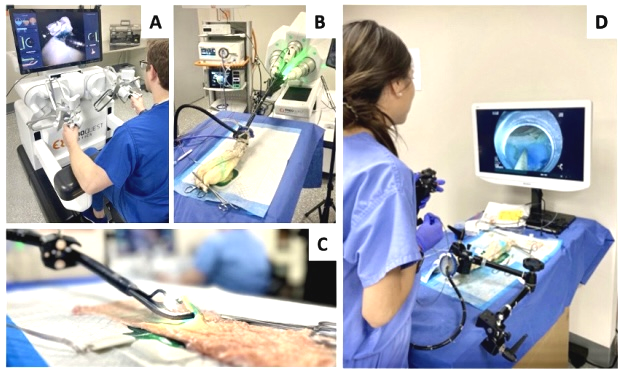
图6.机器人辅助内镜系统示意(A:医生操作台;B:患者端柔性内镜设备;C:可更换的内镜器械与摄像系统;D:传统ESD的手术操作示意)
本文全面盘点了2025年消化道早癌诊疗在成像、诊断、筛查及治疗方面的关键进展。多模态O2E成像与AI基础模型的深度集成,实现了病变从“肉眼识别”向“三维定量诊断”的跨越,显著提升了诊断的精度与鲁棒性。同时,多组学液体活检与非侵入性海绵检测的真实世界应用,为高风险人群的精准分层及内镜资源配置提供了高效路径。在治疗端,机器人辅助ESD的突破标志着内镜手术从“经验驱动”向“标准化工程”的演进,极大地降低了技术门槛。
展望未来,早癌诊治将加速构建“精准预筛-智能精查-机器人微创”的全链路闭环。随着新技术的持续下沉,该领域有望打破技术壁垒,实现更高质量的早癌早期发现与治愈性切除。
(本文版权属于中国医学论坛报社,转载须授权)
查看更多