查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





2022年2月,《临床药物治疗杂志》发表国家药品监督管理局、药品审评中心王欢和中国人民解放军总医院京南医疗区张铖关于奈玛特韦片/利托那韦片的综述。小编将其中临床前研究部分、临床研究和用法用量等内容节选分享给大家。

临床前研究

01
体外抗病毒活性研究
奈玛特韦在表达血管紧张素转化酶2(angiotensin-converting enzyme 2,ACE2)的猴肾细胞(Vero E6)、人肺腺癌细胞(A549)和人气道上皮细胞(dNHBE)中半最大效应浓度(EC50)分别为74.5、77.9、61.8 nmol/L,活性高于Molnupiravir的原药(研发代号:EIDD-1931;EC50=300 nmol/L,Vero 细胞)与瑞德西韦(EC50=770 nmol/L,Vero E6细胞)。Vangeel 等研究表明,奈玛特韦对SARS-CoV-2各种变异株保持相似活性,其对alpha、beta、gamma、delta和奥密克戎变异株的EC50分别为280、140、280、210和140 nmol/L。
02
临床前体内药效学研究
在小鼠适应性SARS-CoV-2感染(MA10)模型中评估奈玛特韦的体内抗病毒活性,给药剂量为 300 mg/kg和1000 mg/kg(bid)。感染4 d 后,发现2个治疗组的小鼠体质量均无下降,但对照组体质量下降约10%。与对照组相比,给予奈玛特韦治疗的小鼠病毒水平显著降低,300 mg/kg和1000 mg/kg组中病毒载量下降分别为 1.4×log10和1.9×log10。300 mg/kg组用药后最低血药浓度(Cmin)维持在约0.9倍90%最大效应浓度(EC90)以上,1000 mg/kg组Cmin维持在约 4倍EC90。
03
临床前药物代谢动力学研究
静脉注射奈玛特韦在大鼠和猴体内后半衰期 (t1/2)分别为5 h和<1 h。在大鼠体内口服生物利用度 为34%~50%,在猴体内由于胃肠道的P450酶首关代谢导致低生物利用度为8. 5%,奈玛特韦代谢主要受细胞色素P450 3A4(CYP3A4)影响,与CYP3A4 酶抑制剂利托那韦联用能延缓奈玛特韦代谢清除。
临床研究

目前Paxlovid在美国共有12项临床研究,其中7项临床研究已完成,2项正在进行中,2项正在招募受试者,1项撤回,具体见表1。
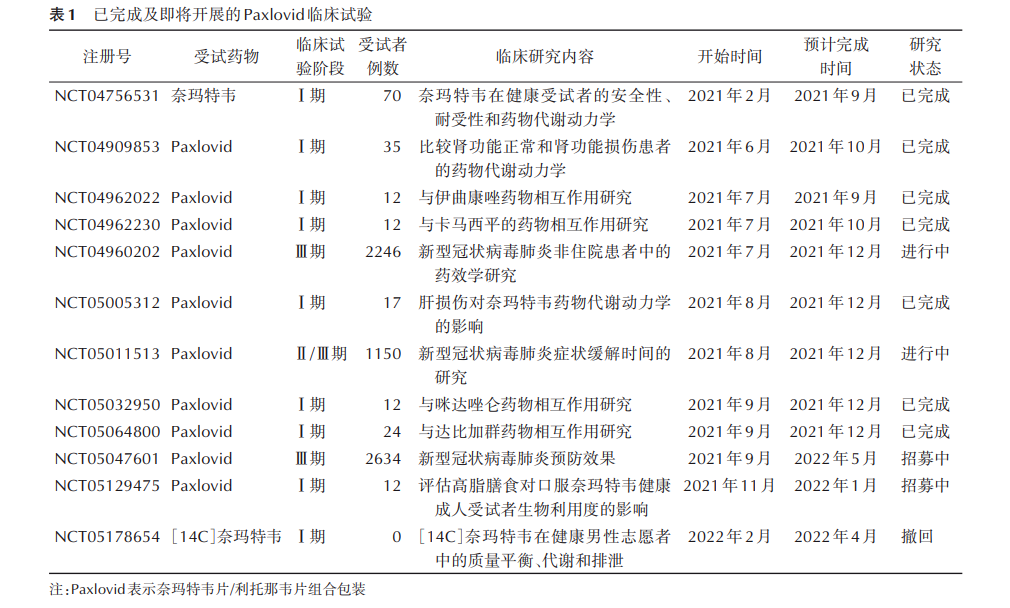
01
Ⅰ期临床研究
奈玛特韦单药或与利托那韦联用的临床药物代谢动力学研究(NTC04756531)共招募了4名健康受试者,健康受试者服用单剂量300 mg奈玛特韦和100 mg利托那韦。研究结果表明,奈玛特韦的最大血药浓度(Cmax)为2.21 μg/ml,血药浓度-时间曲线下面积(AUCinf)为23. 01 μg/ml·h,药物达峰时间(Tmax)为3.00 h,药物t1/2为(6.05±1.79)h。每日2次给药,持续超过10 d的多剂量药物代谢动力学研究表明,奈玛特韦/利托那韦在第2天药物浓度达到稳定,奈玛特韦的Tmax为3.00 h,利托那韦的Tmax为3. 98 h。奈玛特韦的血浆结合率为69%,利托那韦的血浆结合率为98%~99%。奈玛特韦主要通过肾脏消除,t1/2为6.05 h,利托那韦主要通过肝脏消除,t1/2为6.15 h。
02
Ⅲ期临床研究
支持Paxlovid的EUA主要数据来自Ⅲ期临床 (EPIC-HR,NCT04960202)。该研究评估了 Paxlovid在轻度至中度新冠肺炎伴有可能发展为严重疾病的风险因素非住院成年患者中的有效性 。该临床试验于今年7月开始入组,观察组给予Paxlovid,对照组给予安慰剂,主要终点为28 d内与新冠肺炎相关的住院率或病死率。2021年12月14日,辉瑞公司公开了EPIC-HR试验的最终数据,数据来源于该临床招募的全部2246例患者。在出现新冠肺炎症状3 d内用药的患者中,与对照组相比,观察组患者因新冠肺炎住院率及死亡风险下降了89%。观察组中0.7%的患者在随机分组后的第28天住院(5/697,无死亡),而对照组中有6.5%的患者住院(44/682,随后 有9例死亡);在出现新冠肺炎症状5 d内用药的患者中,与对照组相比,观察组患者因新冠肺炎住院率及死亡风险下降了88%。观察组中有0. 8%的患者住院(8/1039,无死亡),而对照组中有6.3%的患者住院(66/1046,随后有12例死亡)。值得注意的是,观察组中65岁或以上患者的相对风险降低94%,观察组中1.1%的患者在第28天住院(1/94,无死亡);而对照组患者中,16.3%的患者在第28天住院(16/98,6 例死亡)。在EPIC-HR试验的次要终点分析中,对499例患者评估了基线和第5天的SARS-CoV-2 载量。与对照组相比,观察组患者的病毒载量下降了约10倍(或0.93 log10 copies/ml),表明Paxlovid是目前报道的病毒载量下降最快治疗新冠肺炎口服药物。两组患者中出现的不良反应发生率接近(23%比24%),其中大多数症状较轻。与对照组相比,观察组患者严重不良反应发生率更少(1.6%比6.6%),因不良反应而停药发生率也更少(2.1%比4.2%)。
另一项Ⅲ期临床(EPIC-SR,NCT05011513)评估了Paxlovid在未接种疫苗成年人和接种疫苗但有1个以上可能发展为严重疾病的风险因素成年人中的有效性,观察组给予Paxlovid,对照组为安慰剂。初步结果表明,患者自我报告所有症状连续4 d持续缓解的主要临床终点未达到。在EPIC-SR试验的次要终点中期分析中,观察组0.6%患者住院(2/333,无死亡),而对照组患者中有2.4%住院(8/329,无死亡);在随后的随访分析中得到相似的结果,观察组0.7%患者住院(3/428,无死亡),而对照组2.4%患者住院(10/426,无死亡)。与EPIC-HR试验一样,观察组患者的病毒载量下降约10倍(或1log10 copies/ml)。两组患者中出现的不良反应发生率接近(22%比21%),其中大多数症状较轻。两组严重不良反应发生率(1.4%比1.9%)和因不良反应而停药发生率(2.1%比1.2%)接近。
03
其他临床研究
Paxlovid正在进行2项重要的临床试验。一项试验是面向普通人群,用来评估该药对无高危风险的一般人群的效果,包括接种疫苗后仍被感染 SARS-CoV-2的患者。随着疫苗接种率的不断提高,这部分患者会越来越多,所以研究这个人群有很大现实意义。这项Ⅱ/Ⅲ期临床试验(NCT05011513)已于2021年8月份启动,已招募受试者1150例。另一项Ⅲ期临床试验面向新冠肺炎患者的家属,在密切接触后立即服用药物,观察其预防效果,该试验已于2021年9月份 启动,预计招募受试者2634名。
用法用量

患者被诊断为新冠肺炎后,在症状出现后5 d内,应尽快开始治疗。Paxlovid的用药剂量为每次300 mg奈玛特韦片(150 mg/片)和100 mg 利托那韦片(100 mg/片),3片同时口服,每日2次,连续5 d。
轻度肾功能损害患者[60 ml/(min·1.732)≤估算肾小球滤过率(estimated glomerular filtration rate,eGFR)<90 ml/(min·1.732)]不需要调整剂量;对中度肾损害 [30 ml/(min·1. 732)≤eGFR<60 ml/(min·1. 732)]患 者,Paxlovid剂量调整为150 mg奈玛特韦片和100 mg利托那韦片,每日2次,连续5 d。目前不推荐严重肾损害患者(eGFR<30 ml/(min·1. 732)用药。轻度(Child-Pugh A级)或中度(Child-Pugh B 级)肝损害患者不需要调整剂量。目前不推荐严重肝损伤患者用药。
引用本文: |
王欢, 张铖. 口服新型冠状病毒肺炎治疗新药——Paxlovid[J]. 临床药物治疗杂志, 2022, 20(2): 13-17. |
查看更多