查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






在心衰中,肾素血管紧张素醛固酮系统(RAAS)与心血管事件链之间有着非常重要的联系。
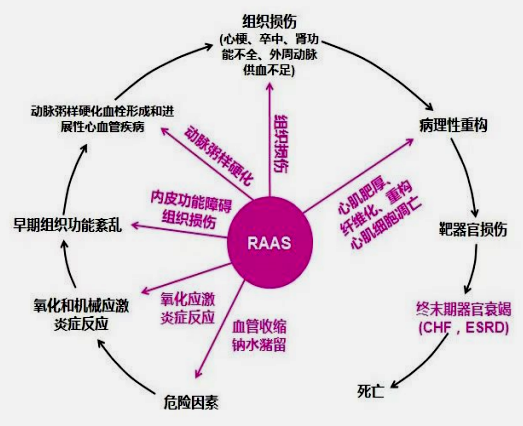
醛固酮作为RAAS的重要环节,可以通过4个方面促进心衰的发生发展:
①加强交感神经的活性
通过促进心肌释放去甲肾上腺素,阻断心肌儿茶酚胺的摄取,加剧儿茶酚胺所致的心律失常和促心肌缺血。
②促进心肌纤维化和心脏重构
通过增加胶原蛋白合成,促进氧化应激和炎症,导致心肌的纤维化和重构。
③血管收缩和功能损害
增加相关收缩,促进血压升高,高血压促进心衰发生发展;损害血管内皮功能,促进缺血。
④水钠潴留/低钾低镁
水钠潴留增加心脏的负荷,加重心衰;同时引起电解质紊乱,低钾和低镁,引起心肌缺血、冠脉收缩,导致室性心律失常和猝死。
醛固酮与醛固酮受体结合后,如果醛固酮受体过度活化会通过如下机制导致不良临床结局,引发心力衰竭、心律失常和心肌梗死:
促炎作用(慢性炎症状态):中性粒细胞/巨噬细胞/Th1&Th17细胞聚集,促炎因子表达增加,NF-κB通路活化;
促纤维化作用:TGF-β、内皮素1、PAI-1、CTGF等纤维化相关因子增加、成纤维细胞增加;
氧化应激损伤、促心肌凋亡、心肌离子通道改变(ICa↑,Ito↓)。
醛固酮与心衰的关系历经了70年的研究历程。20世纪50年代,研究者发现,醛固酮增多可以导致心衰;1957年,醛固酮受体拮抗剂螺内酯上市;1965年,研究证实醛固酮受体拮抗剂可以减轻水肿;1981年,研究者提出“醛固酮逃逸”的概念;1999年,里程碑式研究RALES研究评价了螺内酯治疗心衰的效果,此后,醛固酮受体拮抗剂治疗心衰正式进入了循证医学时代。
进入21世纪后,一系列临床研究的相继问世奠定了醛固酮受体拮抗剂治疗心衰的地位。

体内醛固酮的产生,除了经典RAAS途径外,还受非血管紧张素转换酶(ACE)途径合成的血管紧张素Ⅱ影响,即外周醛固酮系统,人体心肌细胞、内皮细胞、间质细胞及平滑肌细胞均存在醛固酮合成酶,可合成醛固酮,不受RAAS影响。
心力衰竭时,通过以下途径引起醛固酮水平升高:
因肝脏血流量减少,导致醛固酮清除率能力下降,使体内醛固酮水平增加;
其次,心钠肽、脑钠肽、高钾等因素也促进醛固酮合成分泌增多;
血管紧张素转换酶抑制剂(ACEI)或血管紧张素Ⅱ受体拮抗剂(ARB)治疗并不能完全阻断RAAS,随着ACEI或ARB治疗时间延长,部分患者会出现血浆醛固酮水平升高,即“醛固酮逃逸”现象。
“醛固酮逃逸”机制有以下6个方面:
①ACEI长期治疗时,Ang原在糜蛋白酶作用下(非ACE途径)跳过Ang I形成 AngⅡ,促进醛固酮分泌;
②组织蛋白酶G、组织纤溶酶原激活剂通过非肾素途径直接分解血管紧张素原形成AngⅡ;
③内皮素、血管升压素、儿茶酚胺、高钾、促肾上腺皮质激素、糖皮质激素、抗利尿激素、高脂血症和血浆高密度脂蛋白降低等非AngⅡ依赖的醛固酮刺激因子,促进醛固酮的分泌;
④心脏、大血管、脑部等器官组织存在独立于经典 RAAS 之外的外周醛固酮形成系统,并以自分泌与旁分泌的形式在局部发挥作用;
⑤长期ACEI治疗,生成的替代途径--胃促胰酶转化途径占优势,这样导致肾素升高;
⑥与ACE基因的多态性有关。
因此,即使ACEI/ARB应用充分,醛固酮受体拮抗剂的使用仍然非常有必要。多项试验表明,心衰患者在使用ACEI/ARB基础上,“醛固酮逃逸”的水平在10%~53%之间,很多患者都可能发生“醛固酮逃逸”。



1.活动页面签到7天,可领取1年数字报
2.活动页面签到10天,可领取黄峻教授2022心衰盘点文章PDF版
3.活动页面签到15天,可领取本次专题活动电子学习证书
4.评论区留言,可获得双肩背包抽奖机会
*活动最终解释权归中国医学论坛报社所有
中国医学论坛报版权所有,转载须授权
查看更多