查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





近日,首都医科大学附属北京胸科医院转化医学研究室褚洪迁团队在国际权威期刊《Advanced Science》(影响因子:14.3,中国科学院1区 TOP 期刊)上发表题为“A Spatiotemporally Controlled Gene-Regulation Strategy for Combined Tumor Therapy Based on Upconversion Hybrid Nanosystem”的研究论文。
本研究开发了一种时空可控的双激活纳米平台--URMT,URMT通过将负载光敏剂的上转换纳米颗粒(UCNP)与酶激活的反义寡核苷酸结合,并在其表面功能化了靶向线粒体的配体三苯基膦(TPP)构建而成。该平台能够通过近红外光激活光动力治疗(PDT),PDT可触发肿瘤中的酶激活的基因表达调控,实现高度时空可控的PDT联合基因治疗发挥抗肿瘤作用。北京胸科医院博士生研究生王芳为论文第一作者,中央民族大学刘蓓与北京胸科医院孙照刚、褚洪迁为文章的共同通讯作者。

光动力疗法(PDT)是一种具有高选择性和非侵入性的肿瘤治疗方式,其分子机制是光敏剂在特定波长的光照射下分解氧气(O2)产生以单线态氧(1O2)为主的活性氧(ROS)杀死肿瘤细胞。然而,由于目前光敏剂的激发光多为紫外可见光,因此穿透深度较浅,加上大部分实体瘤具有乏氧的特点,严重限制了PDT的效果。迫切需要探索新的策略提高PDT疗效,并实现高效的肿瘤联合治疗。
褚洪迁团队长期致力于肿瘤的光动力疗法研究。在前期研究中,褚洪迁团队构建了一系列的PDT及PDT联合其他治疗手段的抗肿瘤体系,如金属有机框架纳米材料负载药物的体系,但是所用激发光为640 nm,穿透深度较浅,阻碍了PDT作用的发挥,且不具有时空可控性。基于前期的研究基础,该研究引入稀土掺杂的上转换纳米材料(UCNPs),UCNPs可将两个或多个近红外低能光子转换为波长较短的高能量光子,即在近红外光激发下,能够发出短波高能的可见光或者紫外光,展现出独特的上转换发光性质,可有效解决PDT激发光穿透深度低的瓶颈。通过在UCNPs表面包覆介孔硅,可利用孔道高效的装载光敏剂。
miR21作为一种致癌基因,与肿瘤的恶性程度相关,是肿瘤基因治疗的靶标。抑制或沉默miR21可降低Bcl-2蛋白的表达水平,激活线粒体凋亡通路,进而促进肿瘤细胞凋亡。由于核酸带负电不易进入细胞且易被核酸酶降解,并且传统的基因递送系统缺乏时空特异性,无法激活特定病变部位的基因治疗,严重阻碍了基因治疗的疗效。UCNPs递送双链anti-miR21的策略,既可以提高核酸链的细胞摄取,也可增加其稳定性。
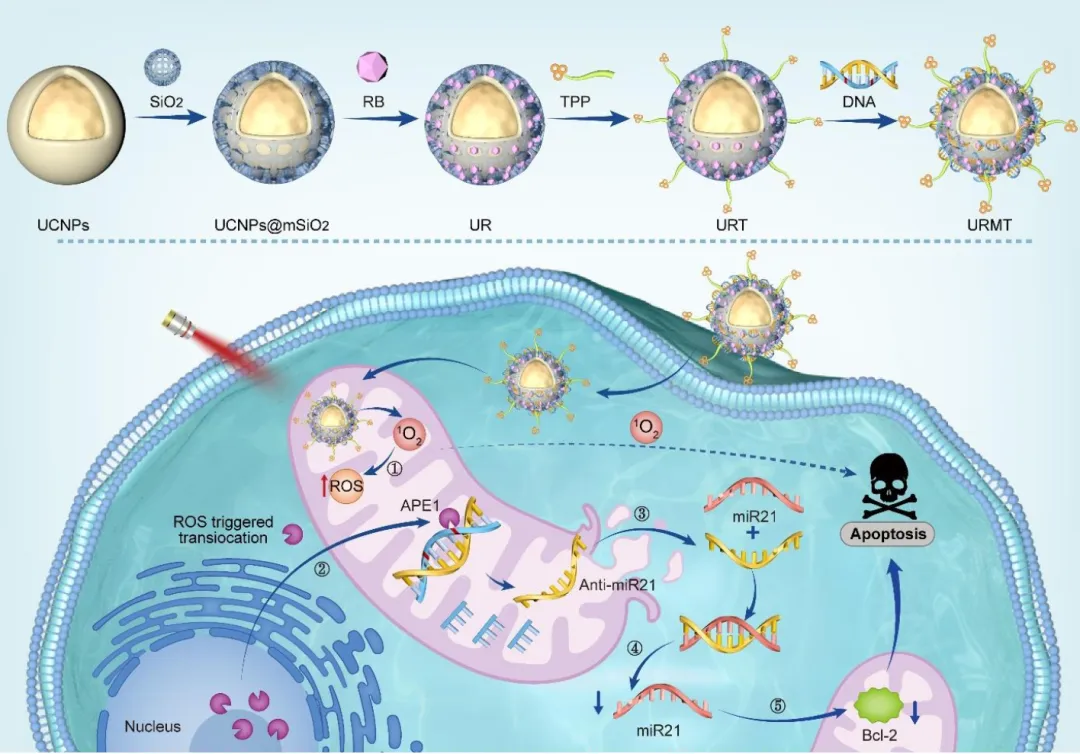
图 基于光动力激活APE1易位的线粒体靶向肿瘤基因治疗纳米系统的工作原理示意图
该研究构建复合纳米材料UCNP@mSiO2-RB-TPP-DNA (URMT),递送至肿瘤细胞后可在TPP的作用下靶向至线粒体,经近红外光(980 nm)照射后,光敏剂被激发产生ROS,发挥PDT作用。ROS升高可导致限制性核酸内切酶1(APE1)从细胞核迁移至线粒体,在线粒体内识别并切割anti-miR21互补链的AP位点,释放anti-miR21至细胞质,在细胞质内沉默miR21,通过Bcl-2蛋白启动线粒体凋亡通路,实现PDT激活的基因治疗共同作用于线粒体凋亡通路发挥协同抗肿瘤作用。
本研究通过将近红外光激活的PDT与酶激活的基因调控相结合,实现了对肿瘤联合疗法的精确空间和时间控制,同时确保了高度的安全性。该策略可以极大地扩展用于开发高精度肿瘤联合治疗的技术。
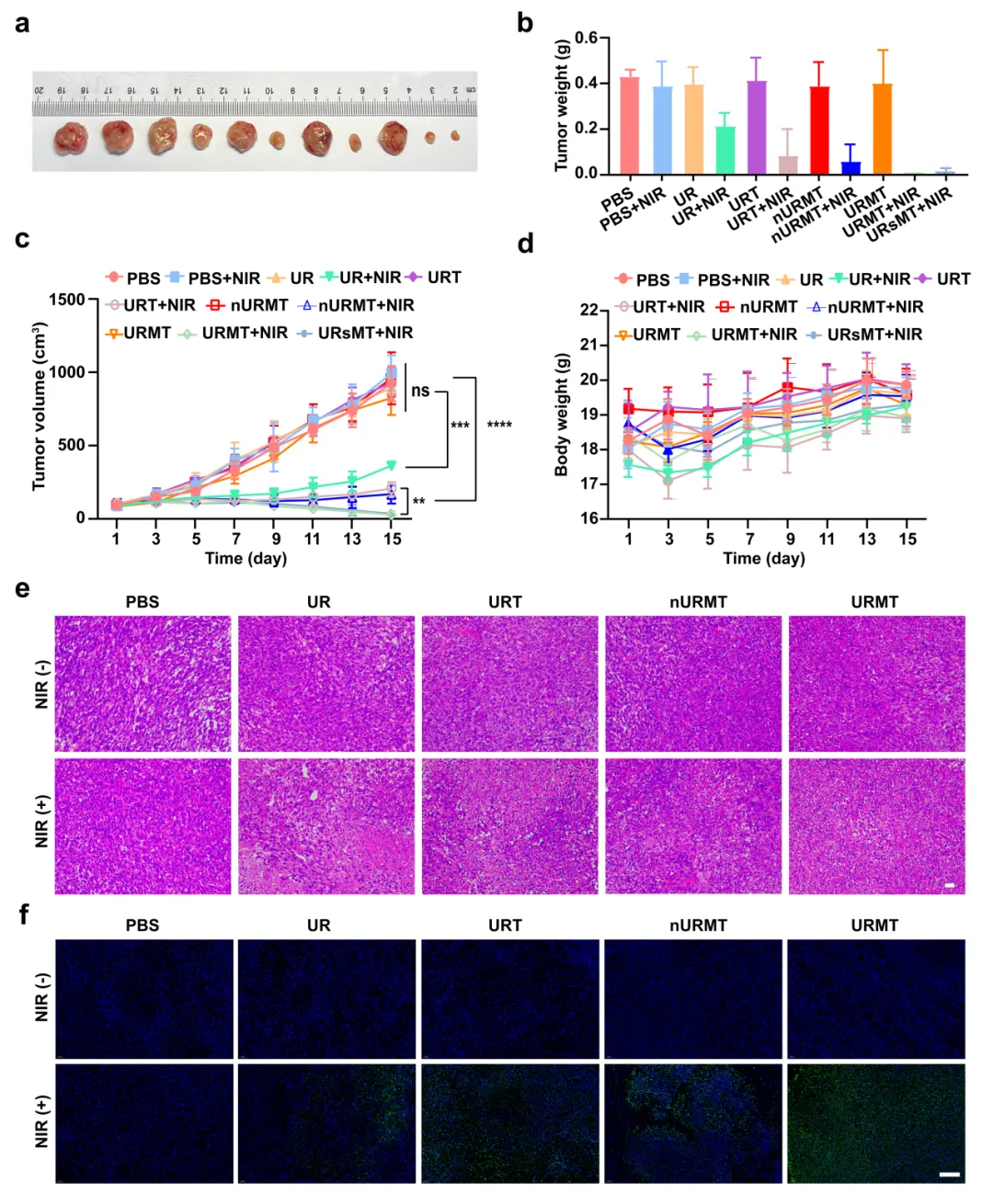
图 URMT的联合抗肿瘤效果评价
该项研究得到国家自然科学基金(82001946)、北京市医院管理中心培育计划(PX2021061)和北京市医院管理中心青苗计划(QML20231601)的资助。
医学博士,现任首都医科大学附属北京胸科医院转化医学研究室副研究员,硕士生导师,首都医科大学副教授,北京工商大学研究生实践导师。
研究方向为基于复合纳米材料的肿瘤诊疗纳米体系构建及纳米毒理学。利用纳米材料作为工具解决实际的临床问题,并在使用前进行毒理学评价。主持国家自然科学基金、北京市自然科学基金、北京市医管中心培育项目、通州区科委项目等课题8项。入选北京市医管中心“青苗计划”。以第一及通讯作者在Angewandte Chemie、Nature Communications、Advanced Science、Analytical Chemistry、Chemical Engineering Journal等期刊发表论文30余篇。
社会任职方面,担任中国环境诱变剂学会第八届理事会理事;北京肿瘤防治研究会癌症早筛早诊早治分委会委员;北京预防医学会第八届卫生毒理专业委员会委员;中国研究型医院学会医工转化与健康产业融合分会委员;中国医药教育协会医学基因组学与生物信息学专业委员会委员;Military Medical Research青年科学编辑;Acta Materia Medica青年编委。
来源:北京胸科医院
查看更多