查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:江苏省人民医院肾内科 杨光 邢昌赢
继发性甲状旁腺功能亢进症(SHPT)是慢性肾脏病(CKD)的常见并发症,其发病率随CKD分期的进展及透析龄的增长而增加。其致病因素包括高血磷、低血钙、活性维生素D水平下降,以及甲状旁腺细胞膜上维生素D受体(VDR)、钙受体(CaR)和FGFR1-klotho等受体表达下降。SHPT发病率高,临床表现和治疗选择多样化,相关并发症危害重,使其临床管理具有一定难度。
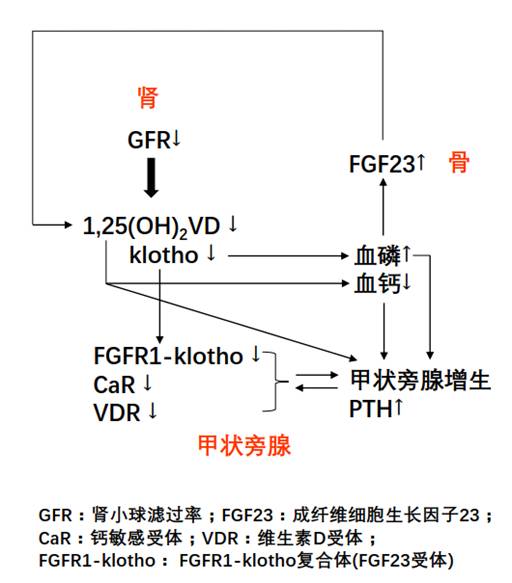 图 慢性肾脏病继发性甲状旁腺功能亢进症的发病机制
图 慢性肾脏病继发性甲状旁腺功能亢进症的发病机制
1.SHPT的临床特点
SHPT的临床表现呈现多样化,可表现为慢性肾脏病矿物质与骨异常(CKD-MBD)临床表现中的一个或数个。
1.1 血清甲状旁腺激素(PTH)水平增高
KDOQI和KDIGO分别建议CKD 5D期患者血清PTH水平应控制在150~300 pg/ml和正常值2~9倍,PTH升高可在CKD合并SHPT患者常规血液检测时发现。
PTH 是由84个氨基酸残基构成的单直链多肽,目前临床实验室多采用第二代检测技术,其检测结果称为“全段甲状旁腺激素(intact PTH)”,第二代检测技术联合采用C端抗原表位和N端抗原表位,检测成分主要是完整 PTH(1-84 PTH)和非完整的PTH[主要是7-84 PTH以及C末端PTH残段(即33-84 PTH)],由于1-84 PTH是SHPT患者的致病因素,而7-84 PTH具有1-84PTH的生理学拮抗作用,因此第二代检测技术对SHPT患者PTH生物有效性评估具有缺陷。
部分实验室已采用第三代检测技术,即使用氨基端1-4氨基酸残基作为抗原表位,其检测成分包括1-84 PTH和N末端PTH残段,不再包括7-84 PTH,其检测结果称为“生物全段甲状旁腺激素(bio-intact PTH或whole PTH)”。第三代检测技术在评价甲状旁腺功能时优于第二代方法。
1.2 骨病
SHPT早期以对称性承重骨疼痛起病,如双侧膝关节、足跟骨疼痛,进展期可出现骨骼畸形和非暴力性骨折等。SHPT导致的骨病大多数是高转换性骨病,源于血清高水平的PTH可作用于成骨细胞,被激活的成骨细胞进一步激活破骨细胞,导致骨形成和骨吸收均上调,但以骨吸收现象更显著(此过程称为成骨-破骨细胞的偶联激活),从而导致高转换性肾病,患者骨骼中的矿物质(主要是钙、磷)被吸收入血,可造成骨源性的高钙血症和高磷血症,是促发和加重骨外钙化(异位钙化)的重要原因之一。因此,防治SHPT相关性骨病应积极控制过高的PTH水平。
辅助检查可见血清骨形成标志物[如碱性磷酸酶(ALP)、骨特异性碱性磷酸酶(bALP)、Ⅰ型前胶原氨基端前肽(PINP)等]和血清骨吸收标志物[如抗酒石酸抑制酸性磷酸酶5b(TRACP-5b)、Ⅰ型胶原C端肽(CTX)、Ⅰ型胶原N端肽(NTX)、吡啶啉(Pyr)与脱氧吡啶啉(D-Pyr)等]同时增高;双能X线骨密度检测可呈现低骨密度或骨质疏松症,双能X线骨密度可作为非暴力性骨折的风险预测。

图 “狮面脸”、骨骼畸形等
1.3 骨外钙化
骨外钙化包括血管钙化、心脏瓣膜钙化、钙化性尿毒症性小动脉病(钙化防御病)和皮肤软组织钙盐沉积症等。
血管钙化和心脏瓣膜钙化可导致严重致死性心血管并发症,降低CKD患者生活质量和生存期。
钙化性尿毒症性小动脉病发病率低于血管钙化和心脏瓣膜钙化,主要侵犯皮肤或皮下组织小血管致血管钙化或闭塞,并由此导致局部缺血和感染,该病致死率较高。
皮肤软组织钙盐沉积症是不溶性钙盐沉积于皮肤软组织导致的疾病,以皮下或肌内钙盐性肿块为主要表现。
上述各种骨化钙化都可以在X线(如侧位腹平片观察腹主动脉钙化)或CT等放射性检查中被发现,脉搏波传导速度(PWV)和心脏超声可以分别为血管钙化和瓣膜钙化提供诊断依据。高水平的血清磷、钙和PTH是骨外钙化发生发展的危险因素。因此,防治骨外钙化应针对血磷、血钙和血PTH水平进行调整和控制。
1.4 其他
SHPT患者还可表现为皮肤瘙痒、球结膜充血等症状,与钙盐沉积于皮肤和球结膜微血管产生的刺激效应有关。少见的症状还有肌无力、肌痛和腹痛等,应警惕。
2.SHPT患者的日常管理
2.1 饮食管理
鉴于高磷血症在SHPT和骨外钙化发病机制中具有重要作用,CKD患者应积极防治高磷血症。
磷的主要来源是饮食,控制饮食中磷的摄入对预防和治疗高磷血症非常重要。限制磷摄入的措施包括:适当限制摄入蛋白质的总量,但不可过度限制,以免导致营养不良;选择磷吸收率低、磷/蛋白质比值低的食物;限制含磷的食物添加剂和某些高磷食物的摄入。CKD 3~5 期非透析患者,血磷超过正常范围者,建议限制饮食磷摄入(800~1000 mg/d);CKD 5D期患者,血磷超过目标值者,建议限制饮食磷摄入(800~1000 mg/d)。
高钙血症与骨外钙化关系密切,建议每日元素钙总量不超过2000 mg。对于没有接受活性维生素D及其类似物治疗、或低钙血症、或正在接受拟钙剂治疗的患者,其钙的摄入量可稍高。
2.2 指标监测
CKD患者自3期开始,钙、磷、PTH和维生素D异常的发生率增高,应与此期开始监测。KDIGO指南建议CKD 5D期患者每1~3个月监测钙、磷,每6个月监测PTH和ALP(有条件的单位可以同时监测其他骨形成标志物和骨吸收标志物)。对于存在上述指标异常或接受相关药物治疗的患者,上述频率可以适当增加。
应重视对ALP的监测,因为ALP是反映成骨细胞活性的指标,对于SHPT患者则反映成骨-破骨细胞偶联活化程度,即高转换性骨病的严重程度。排除肝胆系统疾病的ALP增高可以提示高PTH水平诱发高转换性骨病的启动和进展,该情况是积极降低血清高PTH水平的标志。25羟基维生素D水平根据基线情况和治疗措施决定监测频率。
2.3 透析方案调整
可以通过调整透析方案控制SHPT患者的高钙和高磷血症,以减少骨外钙化风险。CKD 5D期合并SHPT的患者,如无低钙血症,建议使用钙离子浓度为1.25 mmol/L的血液或腹膜透析液。血液透析患者可以通过增加透析频率和透析时间,以更有效地清除血磷,从而降低PTH水平或提高药物治疗SHPT的效果。
3.SHPT的药物治疗
SHPT的治疗药物包括磷结合剂、维生素D受体激动剂、钙敏感受体激动剂(拟钙剂)。具体用药策略在以下文章中详细介绍。
陈晓农教授介绍CKD患者继发性甲旁亢的药物治疗(附治疗案例)
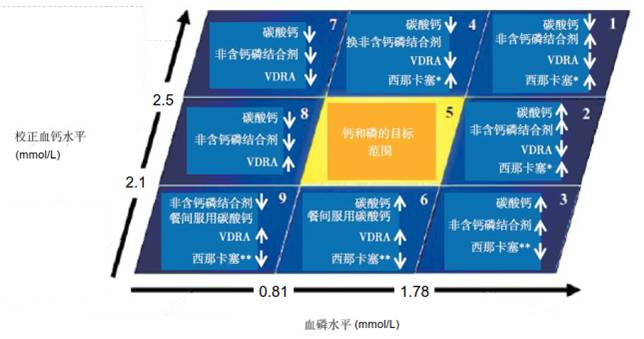
图 磷结合剂和SHPT治疗药物的选择理念
↑:建议使用或加量,↓:建议减量或停用,VDRA:维生素D受体激动剂
4.SHPT的手术治疗
难治性SHPT指患者药物治疗无效,持续高磷或高钙血症、持续高 PTH,通常需要行甲状旁腺切除术(PTX)。PTX可以有效降低PTH、血钙和血磷水平,改善患者生存质量。据日本透析医学会报道,透析龄>10年的患者接受PTX的比率约为10%,而透析龄>20年接受PTX的比率约30%。
笔者所在医院(南京医科大学第一附属医院/江苏省人民医院)接收来自全国10余个省市自治区的难治性SHPT患者,近10余年来完成PTX手术1500余例。目前该手术正在向基层医院普及,江苏省内大部分三级医院已经能够独立完成该手术及围手术期管理。
当出现下列情况之一,建议择期行PTX手术:
① 血清全段PTH(iPTH)大于800 pg/ml,同时伴有高钙或高磷血症,且药物治疗无效;
②有SHPT导致的严重的骨痛、皮肤瘙痒、骨外钙化及畸形等临床表现;
③PTH≥1500 pg/ml;
④影像学检查,包括甲状旁腺超声及同位素(99mTc-MIBI,甲氧基异丁基乙腈),扫描发现至少1枚增大的甲状旁腺。
术前应及时调整合并症,要特别重视有严重合并症(如严重胸廓、骨骼畸形或心血管并发症、其他可能导致的手术风险大的情况)和高龄患者,必要时请相关科室会诊评估麻醉手术风险。
目前临床常用的手术方式包括甲状旁腺全切除术和甲状旁腺全切除术联合前臂自体移植术,后者较前者出现术后持续性甲状旁腺功能减退症的风险减少。
术后,患者因骨饥饿综合征出现低钙血症,不及时补钙将导致低血压趋势,因此应注意评估动静脉内瘘功能。此外应观察患者有无饮水呛咳、声音嘶哑、出血、呼吸困难等颈部手术常见并发症。颈部出血易血肿压迫气道引起窒息,应特别注意。
术后应密切监测电解质,警惕低钙血症和高钾血症。如有高钾需安排透析,如低钙则视情况选择口服或静脉补钙。手术24小时后应检查移植物侧PTH和非移植物侧PTH,评估手术效果。
综上所述,随着我国国民经济水平的不断发展以及CKD长期生存患者的与日俱增,SHPT的临床诊疗正逐渐为肾内科医务工作者日趋庞大的工作任务。由于SHPT可能导致CKD-MBD的各方面并发症,严重威胁CKD患者的生活质量和生存时限,因此值得医务工作者重视和加强临床诊疗技术水平。
相关链接:
陈晓农教授介绍CKD患者继发性甲旁亢的药物治疗(附治疗案例)
本文来自中国医学论坛报“壹生”APP专题报道,如需转载,请联系授权。
查看更多