查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:上海交通大学医学院附属瑞金医院肾脏内科 高琛妮 陈晓农
继发性甲状旁腺功能亢进(SHPT)是慢性肾脏病(CKD)常见的并发症,临床表现以甲状旁腺激素(PTH)水平升高、甲状旁腺腺体增生或腺瘤形成、矿物质代谢紊乱为特点。SHPT往往随着CKD进展而加重,进入终末期肾脏病(ESRD)的患者几乎均伴随不同程度的SHPT。
SHPT常累及多系统,包括骨骼系统受损、内分泌代谢异常、心血管钙化、软组织钙化、骨髓纤维化等等,严重降低CKD患者的生活质量,导致死亡率升高。
国内外多项研究均证实了有效控制PTH水平可以降低CKD患者的死亡率、心血管事件及骨折风险。治疗SHPT,主要手段是控制高磷血症,维持血清钙水平达标;可行的措施包括给予活性维生素D及其类似物、拟钙剂或实施甲状旁腺切术手术。本文将针对SHPT的药物治疗进行介绍。
PTH的控制目标
CKD不同分期患者的PTH控制目标有所不同。根据全球改善肾脏病预后组织(KIDGO)的指南以及《中国慢性肾脏病矿物质和骨异常诊治指南》推荐,对于CKD3a~5D期患者,目前尚无具体PTH靶目标数值,但对于PTH持续升高的患者建议干预治疗。对于开始透析的终末期肾功能衰竭患者,PTH靶目标为正常上限的2~9倍。
1.磷结合剂
血磷是矿物质骨代谢异常(MBD)的关键环节,也是诱导血管钙化的始动因素。研究表明,CKD患者血磷每升高1 mg/dl,其冠状动脉、降主动脉和二尖瓣的钙化发生率分别显著增加21%、33%和62%。控制CKD患者血磷水平应掌握3D原则,即饮食控制(diet)、透析治疗(dialysis)及药物治疗(drugs)。
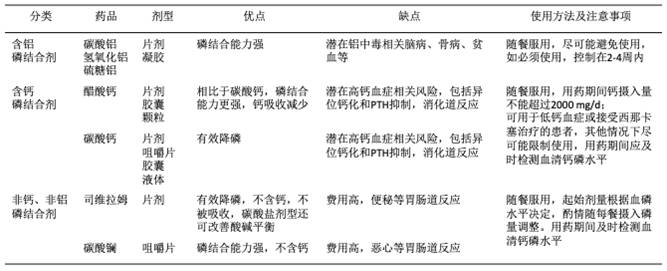
磷结合剂分为含钙磷结合剂(碳酸钙、醋酸钙)、非含钙磷结合剂(司维拉姆、碳酸镧)及含铝磷结合剂。临床医生可根据血钙水平、是否存在异位钙化等来选择磷结合剂类型。
含钙磷结合剂的优点是有效、价格便宜,是目前临床使用的主要磷结合剂。
非含钙磷结合剂主要有:①司维拉姆,包括盐酸司维拉姆和碳酸司维拉姆,通过离子交换和氧化结合肠道中的磷,随餐服用可有效降低透析患者血磷,对血钙影响较小;②碳酸镧,组织吸收少,毒性较小,随餐、咀嚼服用可有效控制血磷和钙磷乘积。非含钙磷结合剂通常价格较昂贵,初次使用应从小剂量开始,根据血清磷水平调整,每1~2周监测钙磷直到稳定。
对于血磷持续超过2.26 mmol/L的患者,可考虑短期(最多4周)使用含铝磷结合剂,禁止反复长期使用,以免发生铝中毒。
表1. 不同磷结合剂的特点
2.维生素D
活性维生素D,即维生素D受体激动剂(VDRA),目前仍然是治疗SHPT应用最广泛的药物。根据是否激活除甲状旁腺以外的维生素D受体(VDR),可将其分为选择性VDRA(如帕立骨化醇和马沙骨化醇)和非选择性VDRA(如骨化三醇和阿法骨化醇)。
VDRA有口服和静脉两种给药方法,给药剂量分为每日给药和大剂量间断给药。
非选择性VDRA的小剂量维持疗法主要用于轻度SHPT或中重度SHPT的维持治疗阶段,大剂量间歇疗法(冲击疗法)主要用于控制不佳的中重度SHPT患者。大剂量治疗容易并发高钙、高磷等电解质异常,需要增加电解质监测频率,必要时配合低钙透析。选择性VDRA不激活全身其他脏器VDR(如肠道VDR),所以对血钙和血磷的影响较小,抑制PTH分泌效果更明显。
使用VDRA期间要定期复查PTH、血钙及血磷,根据指标变化来调整药物的用法和剂量。在初始治疗及剂量调整期间,每周检测1~2次血清钙磷浓度;剂量稳定后,建议每月复查1次。同时,需要监控钙磷乘积维持在<65 mg²/dl²,如有超出则应当立即减低剂量或暂停治疗。PTH水平至少每3月检测一次。正确及时的VDRA治疗和充分的血液透析可以避免甲状旁腺异常增生和手术切除,预防患者进入高转运骨病,延缓异位钙化发生。
3.拟钙剂
拟钙剂的药理作用是增加甲状旁腺细胞膜上的钙敏感受体的敏感性,达到模拟高钙血症的环境,使PTH分泌减少,同时也有降低血钙浓度的作用,故常常需要与VDRA联合应用。如果使用传统治疗方法(即上文所述纠正低钙、控制高血磷、使用VDRA等)无法将iPTH控制在目标范围时,建议CKD 5D期的患者可使用拟钙剂。由于拟钙剂有降低血钙的风险,因此当血清钙<2.1 mmol/L时不推荐使用。对于未透析的患者,指南未推荐使用拟钙剂。
拟钙剂的代表药物为2008年上市的西那卡塞(Cinacalcet)。EVOLVE研究证实,西那卡塞能够改善心血管事件的全因死亡率,发生猝死和心衰的心血管事件概率降低;ADVANCE研究则证实了西那卡塞能够有效阻止心血管钙化的进展。除了心血管保护作用外,西那卡塞还能够减少甲状旁腺切除的需求,被称为“药物性甲状旁腺切除”。
西那卡塞的起始剂量为25 mg/d,根据钙磷及PTH水平变化调整剂量,可每3~4周增加一次,最大剂量为100 mg/d,直到达到目标。其主要不良反应为恶心和呕吐,低钙血症以及Q-T间期延长等。
目前,静脉拟钙剂etelcalcetide已经问世。研究表明,etelcalcetide使PTH水平降低30%以上的能力优于西那卡塞,且静脉使用可能会改善患者的依从性。但使用etelcalcetide的低血钙发生率高于西那卡塞。
病例介绍
这里介绍我科一例SHPT患者的治疗情况:
女性患者,40岁,原发病为慢性肾小球肾炎,维持性血液透析12年,每周3次透析(两次HD,一次HDF),每次时长4小时。患者主诉“身高缩短(较开始透析前缩短4 cm)伴骨痛1年”入院。除2007年右上臂行动静脉内瘘成形术外,否认其他手术史。
患者血钙长期波动于2.3~2.8 mmol/L;曾使用过碳酸镧等降磷药物,因胃肠道副作用较大而停用,血磷控制于1.6~1.9 mmol/L,PTH波动于1500~2000 pg/ml。入院后查血钙2.41 mmol/L,血磷1.63 mmol/L,PTH 2109 pg/ml,口服骨化三醇(250 ng,qd,po)治疗SHPT。
评估患者异位钙化情况:冠状动脉及主动脉可见钙化(图1),同时患者有身高缩短、骨痛等症状,PTH控制不理想,需要调整SHPT药物。
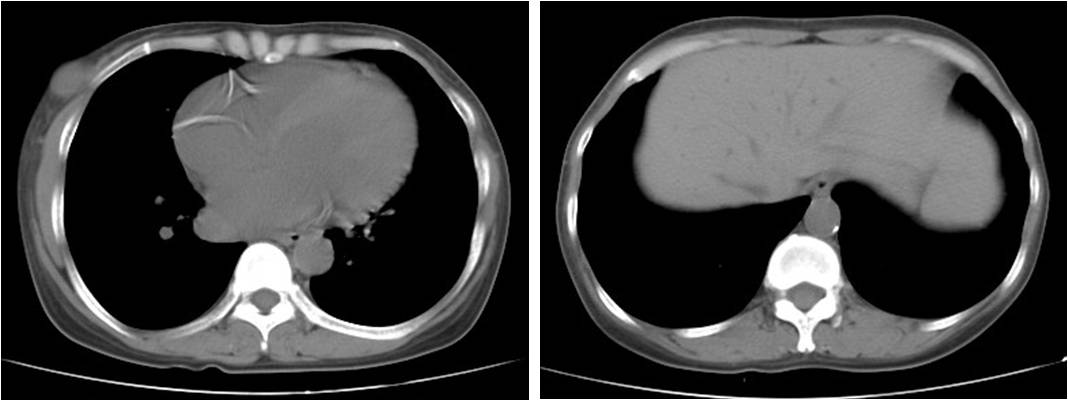
图1 患者胸部CT平扫提示冠状动脉钙化(左图)以及腹主动脉(右图)钙化
考虑患者血钙、血磷偏高,使用VDRA效果不明显,故给予患者拟钙剂西那卡塞控制SHPT。起始剂量为25 mg/d口服,密切监测电解质及PTH变化后加量至50 mg/天。加用西那卡塞半年后,患者的PTH下降至708 pg/ml,无明显低钙血症,骨痛症状明显好转,故将西那卡塞减量至25 mg/d并长期维持。患者钙、磷及PTH变化见图2。西那卡塞的应用改善了患者的SHPT症状及实验室指标,将PTH控制在较为合理水平。
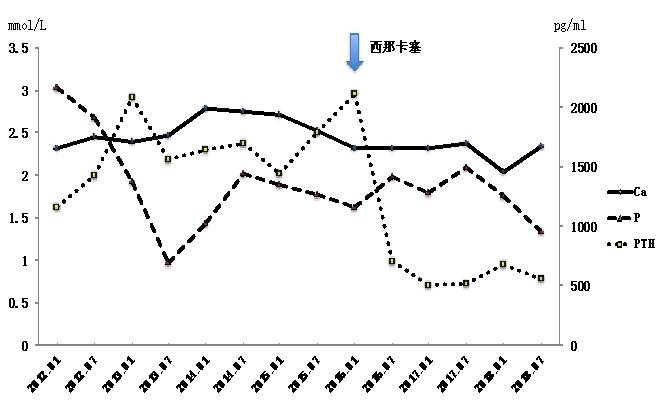
图2. 患者服用西那卡塞前后钙、磷及PTH水平变化
总结
SHPT是CKD患者的常见并发症,严重影响CKD患者的生活质量及生存预后,需要及早干预。药物治疗是SHPT的主要管理方法,临床医生需要对CKD3期及以上的患者定期进行血钙、血磷及PTH的检测,根据结果给予相应磷结合剂、活性维生素D等药物治疗。对于常规药物治疗无效的SHPT患者可考虑西那卡塞。除了药物治疗外,饮食控制、透析方式改良、甲状旁腺外科手术、射频消融等也是控制SHPT的有效手段。
相关链接:
本文来自中国医学论坛报“壹生”APP专题报道,如需转载,请联系授权。
查看更多