查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:复旦大学附属华山医院神经内科 颜庭梦 程忻
再灌注治疗已成为目前缺血性卒中的主要疗法。瑞替普酶的出现为静脉溶栓的药物提供新选择。相较于阿替普酶,瑞替普酶血浆半衰期更长,使用更方便(适合团注,而非静脉滴注),且价格更经济。瑞替普酶对纤维蛋白结合的特异度更高,在提高再灌注的同时,也增加了脑出血的风险。虽然已有研究表明瑞替普酶对心肌梗死的治疗效果优于阿替普酶,但在卒中领域尚缺乏相关循证证据。为此,首都医科大学附属北京天坛医院开展相关研究,并在2024 ISC大会上公布了相关的研究成果。

关于瑞替普酶安全剂量的探索
首先王拥军教授团队开展了一项II期RCT研究,探讨瑞替普酶的安全剂量。该研究是一项多中心、随机化、开放标签、平行对照、终点盲法的RCT研究。
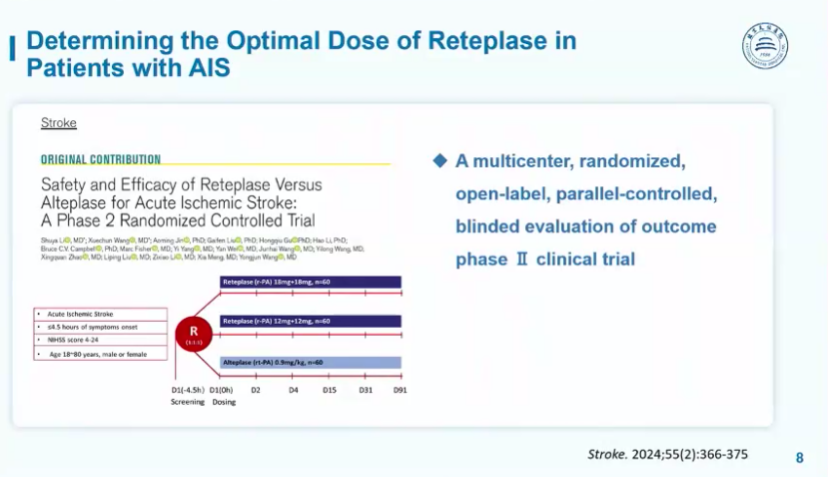
主要纳入符合以下标准的患者:
1.年龄18~80岁
2.诊断为急性缺血性卒中的患者
3.符合溶栓条件且发病4.5小时内
4.发病前mRS评分≤1分
5.NIHSS评分 4~24分
主要排除标准:
1.接受动脉取栓的患者
2.NIHSS意识评分≥2分
3.体重>120kg或<45kg
干预组根据不同剂量分为两组:
1.首次团注瑞替普酶12mg,30分钟后,再次团注12mg,即 (12+12mg)组
2.首次团注瑞替普酶18mg,30分钟后,再次团注18mg,即 (18+18mg)组
对照组:静脉滴注阿替普酶0.9mg/kg
从2019年8月至2021年5月,研究共纳入180例患者,最终共176例患者纳入分析。
其中瑞替普酶(12+12mg)组60例,瑞替普酶(18+18mg)组66例,阿替普酶组50例。
有效性方面,3组患者90天mRS的分布无明显差异,但(18+18mg)组的患者mRS 0~2的比例更高。
主要安全性终点上,无论采用SITS,NINDS,ECASS-II哪种标准,三组患者脑出血发生率均无明显差别。
II期RCT研究证明了瑞替普酶的安全性,并提示(18+18mg)组可能有更好的治疗效果。

RAISE研究
在此研究的基础上,王拥军教授团队开展了III期临床试验,即RAISE研究(Reteplase versus Alteplase for acute ISchaemic strokE within 4.5 hours),进一步证明瑞替普酶相较于阿替普酶的安全性及优效性。
III期RCT试验的纳入和排除标准同之前的II期研究。
干预组:静脉注射瑞替普酶(18+18)mg
对照组:静脉注射阿替普酶0.9mg/kg
研究指标:
有效性:
主要终点:90天mRS 0~1
次要终点:
1.90天mRS 0~2
2.90天mRS的分布差异 (ordinal distribution)
3.24小时NIHSS≤1或与基线相比NIHSS评分下降≥4分
4.7天NIHSS≤1或与基线相比NIHSS评分下降≥4分
5.90天Barthel 评分≥95分
安全性:主要终点指标:
根据SITS标准,发生症状性脑出血的患者
根据ECASS III标准,发生症状性脑出血的患者
研究在全国62个多中心纳入1412例患者,瑞替普酶组707例,阿替普酶组705例。两组患者的基线数据无明显差异。
有效性方面,瑞替普酶组和阿替普酶组分别有80.1%和71.1%的患者达到主要终点,[RR 1.13(95% CI 1.03~1.23),RD 9.4(95% CI 3.2~15.6)]。且符合所有次要终点指标,提示瑞替普酶的优效性。
安全性方面,两组患者36小时内症状性脑出血的发生率无明显差异[RR 1.21(95%CI 0.54~2.75),P=0.64],提示瑞替普酶的安全性。其余次要安全性终点方面,瑞替普酶组90天内发生任何ICH的比例更高[RR 1.59(95% CI 1.00~2.51)],90天内发生非大面积血肿的可能更大[RR 2.23(95% CI 1.03~4.84)]。
RAISE研究为瑞替普酶的安全性和有效性提供了临床证据。特别是该研究的安全终点提示,瑞替普酶的使用虽然增加总体脑出血的风险,但对症状性脑出血的发生并无太大影响。这对后续的临床应用将有重要的意义。同时该研究主要纳入时间窗内不接受动脉取栓的患者,对于部分超窗或者桥接取栓的患者,瑞替普酶是否增加出血风险,还值得进一步探究。
更多精彩内容,请持续关注壹生华山特约专题!
查看更多