查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






近年来,胰腺癌的发病率在国内外均呈显著的增高趋势,2021年中国国家癌症中心统计数据表明,胰腺癌位居我国男性恶性肿瘤发生率的第7位,女性第11位,占恶性肿瘤相关死亡率的第6位[1]。2018年最新的全球癌症数据库GLOBOCAN统计,胰腺癌占全球新发癌症的2.5%,死亡率占所有癌症死亡的4.5%[2]。其致死率与发病率几乎一致,5年总生存率仅约9%[3]。胰腺癌具有恶性程度高、病情隐匿、死亡率高等特点,同时由于在其早期诊断治疗中缺乏有效的手段,导致手术R0切除率相对较低,患者预后欠佳。目前,有关胰腺癌的发病机制尚不明确,其发病为多步骤、多因素、多基因变异的生物学演变过程。随着细胞生物学、分子生物学及免疫技术的不断发展,临床上开展了许多对胰腺癌分子水平上致病机制的研究[4]。转化生长因子β(TGFβ)是一种广泛表达的细胞因子,介导或调节生物过程,包括胚胎发育、细胞内稳态维持、血管生成和免疫调节。其在肿瘤的发生发展过程中可提供适宜的微环境。另有研究表明,TGFβ的高度表达与癌症的不良预后有关。现就TGFβ在胰腺癌中发挥的作用作一综述,希望对今后胰腺癌的靶向药物治疗提供理论依据。
1.TGFβ概述
TGFβ是由112个氨基酸构成的多肽,被位于19号染色体长臂上的基因编码。TGFβ有5种同分异构体形式存在,被人为标记为β1~β5,同源性为60%~80%[5]。TGFβ1~3主要在人类、哺乳动物和鸟类中表达,而TGFβ4~5在鸟类和两栖动物中表达。在人体中,其主要的存在亚型是TGFβ1,几乎能被体内所有的细胞合成。TGFβ2在胶质瘤细胞和角质形成细胞中合成。TGFβ3主要出现在胚胎心脏和肺组织中,在肝、脾和肾中少量表达[5]。TGFβ1主要由血小板、巨噬细胞/单核细胞、淋巴细胞、成纤维细胞、上皮细胞和树突状细胞等合成。在体外,TGFβ亚型对组织发挥着类似的生物学效应,但在体内的各个亚型发挥的作用是不尽相同的。在体内,这些亚型表现出不同的生物学效应,主要由它们在不同的组织中的分布以及靶细胞分化的程度决定[6]。在正常组织中TGFβ通过抑制肿瘤细胞增殖、维持组织结构、抑制基因不稳定性和诱导肿瘤细胞的衰老和凋亡,发挥肿瘤抑制剂的作用。随着肿瘤进展至晚期阶段时,TGFβ会过度表达,并且通过抑制免疫监视、促进血管生成、诱导上皮-间质转化(epithelial-to-mesenchymal transition,EMT)来起到促进肿瘤生长的作用[7]。
TGFβ在人体内一些重要细胞中均表达,并在其正常发育和体内稳态中起到关键性作用。TGFβ在人体中的表达主要有3种形式(TGFβ1、2和3),它们是受体配体,有着类似的生物活性,在调节细胞的增殖、迁移、分化和凋亡等过程中发挥重要作用。TGFβ受体也有3种,分别为转化生长因子β受体1(TGFBR1)、转化生长因子β受体2(TGFBR2)、转化生长因子β受体3(TGFBR3),这3种受体几乎存在于所有非转化细胞的细胞膜上。
TGFBR1蛋白与TGFβ结合后活化,激活下游信号通路,促使细胞增殖、迁移。研究表明,在肿瘤组织中TGFBR1存在异常高表达[8-9],其miRNA在核内经过RNA聚合酶Ⅱ转录后,通过切割产生有茎环结构的前体miRNA,经Dicer酶降解为成熟miRNA,加入到RNA诱导的沉默复合物中,与靶基因mRNA结合后调控靶基因mRNA,阻遏其转录后翻译进程。miRNA的表达失去调控后,影响肿瘤细胞的增殖、分化和凋亡,在肿瘤的发生、发展中发挥显著作用。
TGFBR2与TGFβ结合,然后TGFBR2招募TGFBR1,该受体通过丝氨酸/苏氨酸激酶结构域,磷酸化SMAD2和SMAD3蛋白[10-11],TGFBR1磷酸化后,SMAD2和SMAD3与SMAD4形成异聚体,然后转运到细胞核[10-11],最终引起核内TGFβ靶基因的改变。在肿瘤发展过程中,TGFβ信号通路通过机制改变肿瘤微环境,抑制机体免疫应答反应、刺激肿瘤血管形成等方式,加速肿瘤的产生、浸润与转移[12]。Guo等[13]研究表明,TGFBR2启动子区G-875A的多态性能提高上皮细胞中TGFBR2转录活性,降低食管癌及胃癌的发病风险。胰腺癌晚期,可通过检测TGFBR2表达水平,预估患者生存期长短[14]。
TGFBR3是一种广泛表达的TGFβ超家族受体,编码基因由16个外显子所构成,在胚胎发育中发挥重要作用[15]。TGFBR3通过细胞外结构域与TGFβ结合,并由糖胺聚糖侧链位点与bFGF2结合[16]。在胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)发展过程中,TGFBR3表达受到巨噬细胞源性外泌体microRNA-501-3的调控,最终促使肿瘤细胞迁移,以及血管的形成[17]。
2.TGFβ信号通路在胰腺癌微环境表达及与免疫的关系
在哺乳动物中共存在9种SMAD蛋白(SMAD1~9)。根据其在TGFβ信号转导中作用差异,被分为三类:包括受体调控型SMAD,共同通路型SMAD,抑制型SMAD。其中受体调控型SMAD又包括两类,即由激活剂TGFβ激活的AR-SMAD(SMAD2/3),和由BMP等激活的BR-SMAD(SMAD1/5/9)[18]。在典型的TGFβ/SMAD信号通路中,TGFβ先与TGFBR2结合,然后TGFBR2招募TGFBR1,受体通过丝氨酸/苏氨酸激酶结构域,磷酸化SMAD2和SMAD3蛋白[11-12],TGFBR1磷酸化后,SMAD2和SMAD3与SMAD4形成异聚体,最后转运到细胞核内发挥生物学效应[11-12](图 1),细胞核内,SMAD4通过MH1结构域与CAGAC基序关联,并以特定方式改变基因表达[19]。在恶性胰腺上皮细胞内,该通路对细胞周期蛋白依赖性激酶(CDK)抑制剂转录上调来阻断细胞周期,且通过抑制细胞周期蛋白CDK复合物,阻断G1期到S期的转变。在Principe等[20]研究中证实胰腺特异性敲除TGFBR2或SMAD4基因的小鼠出现肿瘤形成和早期死亡率增加,故不少研究者认为,SMAD介导的TGFβ信号通路中部分信号传导是抑制肿瘤发生发展的。
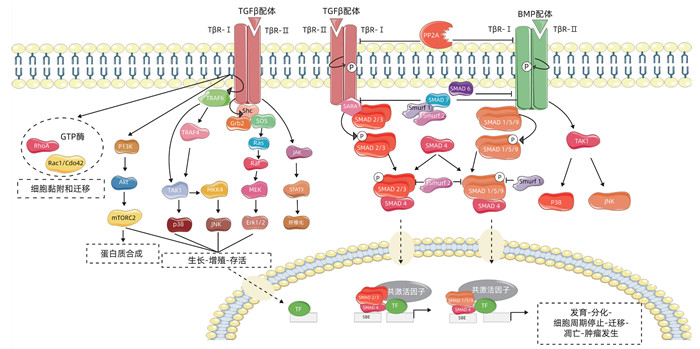
图 1 胰腺癌微环境中TGFβ信号通路
按照目前的人类TCGA数据库,在食道、胃、结直肠和胰腺腺癌25%~50%的病例中,均存在SMAD基因和TGFβ受体基因的突变。头颈部、子宫内膜腺癌、肺鳞癌在10%到20%的病例也存在这种突变过程。总的来说,这种功能失调的突变,为研究TGFβ途径对胰腺肿瘤抑制作用提供了依据。PDAC和结直肠癌的基因工程小鼠模型已经证实,TGFβ可以通过抑制恶性肿瘤前期细胞向更恶性表型的转化,来实现对其的抑制作用。SMAD4是PDAC中最容易突变的基因之一,SMAD4基因的缺失会导致PDAC中信号发生改变,具体表现为诱导的细胞周期阻滞破坏、肿瘤细胞迁移能力增强以及对放化疗敏感性的降低[21]。Shugang等[22]研究表明,SMAD4缺失或功能失活,可能与患者生存率下降、淋巴结累及、远处转移率增加及临床治疗失败率的增高有着显著相关性,故临床中SMAD4表达与缺失可作为预后独立的生物标志物。尽管多项研究表明SMAD4与不良预后之间存在临床相关性[22-24],但目前关于SMAD4信号丢失促进PDAC发生的机制尚未完全明确。
TGFβ/SMAD通路还是公认的EMT、肿瘤细胞转移的介质。胰腺导管上皮细胞中,SMAD4基因敲除或缺失后,影响TGFβ诱导的肿瘤迁移和侵袭[25]。Leung等[26]体外研究表明,SMAD4基因完全缺失,能够增加胰腺导管上皮细胞恶性程度、提升肿瘤转移概率,而对SMAD4基因进行修复后,胰腺导管上皮细胞恶性程度以及肿瘤转移概率均相对下降。最后,最新的证据表明SMAD通路和昼夜节律之间存在相互作用,SMAD通路对时钟蛋白基因DEC1、DEC2和CRY1进行转录控制,通路激活使得时钟改变,从而导致细胞周期阻滞、细胞凋亡增加、免疫逃避和对吉西他滨的敏感性增强[27]。
TGFβ信号通路还涉及几个非SMAD信号通路,包括MAPK、PI3K-Akt、NF-κB、JAK-STAT、Rho-GTPase等,通过这些通路的激活,介导肿瘤细胞的增殖、迁移。非TGFβ/SMAD信号通路是高度复杂的,受到其他几个信号级联干扰。TGFβ信号通路途经就是通过直接磷酸化ShcA启动了ERK/MAPK通路[28]。研究[29]表明,ERK信号通路具有促进肿瘤发生发展的作用,主要表现在ERK信号通路通过增强细胞的增殖、EMT、迁移和侵袭来加速肿瘤的形成。在非小细胞肺癌、结肠癌上皮细胞中,通过抑制ERK通路激活,进而诱导多种上皮表型生成,从而阻遏了TGFβ诱导EMT[30]。在非恶性的胰腺导管上皮细胞中,ERK是TGFβ诱导的p21表达所必需的,药物抑制ERK的激活可以防止TGFβ诱导的p21和CDK2的复合物的形成[31]。但在表达SMAD4的PDAC细胞中,ERK的激活对TGFβ诱导的p21表达没有影响。
除了上述ERK/MAPK途径,PDAC中的TGFβ信号还涉及到其他信号级联干扰,并且许多已在TGFβ诱导的EMT中得到相关研究。最新研究[32-33]表明,TGFβ诱导EMT相关的活性氧(reactive oxygen species,ROS)的改变,TGFβ在EMT期间通过改变肿瘤线粒体功能,增加ROS的产生。敲除TGFβ配体的PDAC细胞显示出NOX4依赖的ROS产生增加,以及包括p38和JNK在内的几个应激激活蛋白激酶的激活。上述数据表明,TGFβ信号传导和氧化还原系统之间交集复杂,并涉及到其他效应器,值得今后再进一步研究。
TGFβ是免疫平衡和耐受的主要执行者,可以控制免疫系统组成部分的功能,信号传递的障碍是炎症性病变的关键,从而促使了癌症的发生。TGFβ同时也是肿瘤微环境中免疫抑制的关键,最近研究表明其在肿瘤免疫逃避和肿瘤免疫治疗反应不佳中起到关键作用。TGFβ可以控制多种免疫细胞产生和效应功能[34],通过直接诱导调节性T淋巴细胞的扩增,以及抑制效应性T淋巴细胞和抗原呈递树突状细胞的生成和功能,来调控机体适应性免疫。同时TGFβ也可以通过抑制自然杀伤(NK)细胞和调节巨噬细胞及中性粒细胞的复杂活动来控制先天性免疫,并由此建立一个负性免疫调节输入网络。TGFβ在免疫调节中的作用,属于细胞因子及家族成员在发育、平衡和组织再生中更广泛的作用。这一途径出现问题后会导致先天性缺陷、纤维化疾病、免疫失调和癌症的发生。TGFβ通过对恶性肿瘤前期细胞的生长抑制和凋亡,产生了有效的肿瘤抑制作用[35]。去除TGFβ途径或使其与细胞凋亡脱钩的突变,不仅使细胞转化为完全的恶性,而且同时它们能够利用TGFβ创造一个免疫抑制的肿瘤微环境,形成额外的基质修饰物,促进肿瘤的生长和转移。
TGFβ作为肿瘤抑制因子,可诱发恶性肿瘤前期细胞的凋亡,从而阻止癌细胞的生长。但是,TGFβ途径失活或与肿瘤抑制作用脱钩的癌细胞克隆可利用TGFβ促进肿瘤的发展。在这种改变背景下,肿瘤衍生的TGFβ可以诱导癌细胞和基质中致瘤和促转移反应,包括形成免疫抑制的肿瘤微环境[36]。在肿瘤发生最初阶段,TGFβ作为主要的肿瘤抑制因子发挥作用,在肿瘤细胞中实施细胞抑制和凋亡程序,促使炎症的环境产生,使得肿瘤发生。
3.TGFβ药物治疗进展
基于抑制TGFβ途径的治疗方法的开发进展缓慢,其在制药业中的低优先级可能是有以下两个原因:第一,长期以来有证据支持TGFβ途径在一些情况下具有肿瘤抑制作用,这引发了人们对抑制TGFβ信号传导可能恶化而非治愈肿瘤的担忧;第二,发现第一代TGFBR1抑制剂在实验模型中出现了明显的心脏毒性[37]。在过去的几年中,TGFβ信号通路成分在不同的免疫细胞类型(包括CD4+、CD8+T淋巴细胞、NK细胞或树突状细胞)中的遗传消融,在肿瘤的临床前模型中引发了强大的抗肿瘤反应。以上研究,加上大量证据表明晚期肿瘤利用TGFβ进行侵袭和转移,引发了旨在阻断肿瘤中TGFβ信号的多种方案的发展。其中测试最广泛的化合物是Galunisertib(LY2157299),一种抑制TGFBR1激酶活性的小分子。Galunisertib联合吉西他滨在一项针对胰腺癌的Ⅱ期临床试验中显示出明显的治疗活性[38]。另一项Ⅱ期临床试验表明,用Galunisertib作为单药治疗的一部分肝细胞癌患者有治疗反应[39]。值得注意的是,Galunisertib在各种临床试验中显示出安全特征,并没有出现明显的心脏毒性[40]。
4.结语
综上所述,TGFβ家族作为功能最广泛的调节因子,不仅在控制胚胎发育、细胞增殖、分化、迁移、血管生成,以及免疫调控等方面发挥着生物学效应,而且在晚期PDAC的发生发展中通过促进肿瘤转移、促进肿瘤细胞免疫逃避,以及促进血管的生成来发挥其促癌作用。但是,目前关于TGFβ信号对肿瘤的双重效应机制研究不完全,通路中相关因子的表达产生的影响也尚有待进一步研究。不管最终机制如何,由于TGFβ家族表达与晚期胰腺肿瘤的增殖及侵袭能力增强都存在着明显的相关性,而且TGFβ家族的表达与晚期胰腺肿瘤细胞的免疫逃避也有着一定的关联性。上述研究成果均证明将TGFβ家族作为一个重要的抗胰腺肿瘤治疗靶点是一个不错的选择,故TGFβ家族活性调节剂在临床上作为抗胰腺肿瘤细胞异常增殖研究有着十分重要的应用前景。
"
张浩, 刘林勋, 赵占学, 等. 转化生长因子β在胰腺癌发生发展中的作用[J]. 临床肝胆病杂志, 2022, 38(12): 2892-2896.
"
查看更多