查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





引言

《胃肠病学》(Gastroenterology)是美国胃肠病学会(American Gastroenterology Association,AGA)的官方杂志,是国际消化病学领域的顶级学术期刊,提供了胃肠病学基础和临床研究的最新和权威报道。首都医科大学附属北京友谊医院是国家消化系统疾病临床医学研究中心和消化健康全国重点实验室依托单位,是AGA在中国唯一官方指定授权发布《胃肠病学》杂志翻译的单位。
本期为大家带来《α1,3岩藻糖基转移酶Ⅶ通过增强调节性T细胞肠道归巢和免疫抑制改善炎症性肠病的肠道免疫稳态》,敬请关注!


<第52期>

α1,3岩藻糖基转移酶Ⅶ通过增强调节性T细胞肠道归巢和免疫抑制改善炎症性肠病的肠道免疫稳态
通讯作者:
谈高,南方医科大学南方医院,消化内科
智发朝,南方医科大学南方医院,消化内科
任玥欣,南方医科大学南方医院,消化内科

背景与目的
调节性T细胞(Tregs)在维持免疫稳态中发挥关键作用,但在炎症性肠病(IBD)患者的肠道炎症黏膜中,其数量显著减少。目前,关于Tregs归巢至肠道的分子机制尚不明确。

方法
通过RNA测序分析活动性IBD患者Treg细胞中α1,3-岩藻糖基转移酶Ⅶ(Fut7)的表达水平。构建Treg细胞特异性Fut7敲除(CKO)小鼠,并建立葡聚糖硫酸钠(DSS)诱导的结肠炎模型,以评估Fut7在Tregs肠道归巢中的作用。进一步设计靶向Tregs的纳米载体(CD4-LDP-Fut7),将Fut7过表达质粒特异性导入Treg细胞,并在IBD模型中评估其治疗潜力。同时,采用质谱流式细胞术分析Fut7对Tregs功能的调控机制。

结果
与健康对照相比,活动性IBD患者Treg细胞中Fut7表达显著下调。在IBD模型中,Fut7缺失小鼠结肠中Tregs比例及结肠/脾脏Tregs比值均降低,表明其肠道归巢能力受损,并伴有更严重的结肠炎。相反,CD4-LDP-Fut7治疗显著缓解了肠道炎症。机制研究显示,Fut7通过竞争Fut8的底物GDP-岩藻糖,下调Tregs中PD1的表达,从而增强其免疫抑制功能。
结论

Fut7可促进Tregs向肠道的归巢并增强其免疫抑制效应。靶向提高Tregs中Fut7的表达有望成为IBD治疗的新策略。
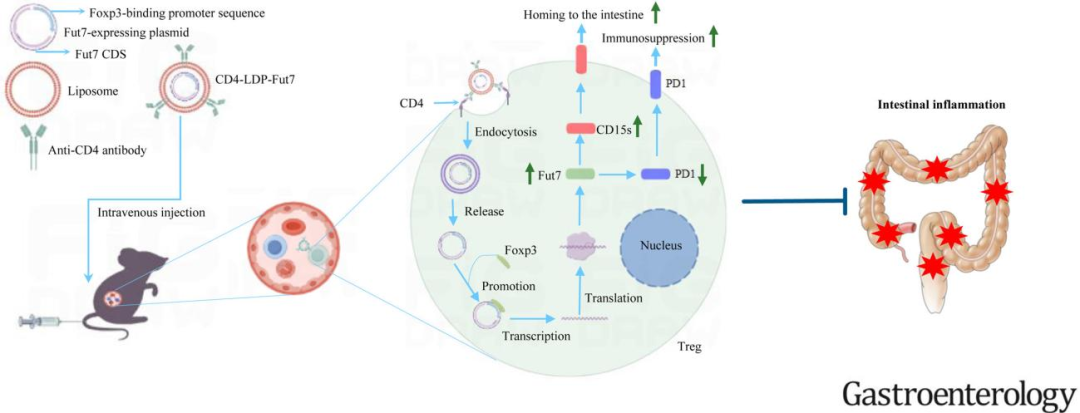
图文摘要
通过CD4-LDP-Fut7纳米载体特异性上调Fut7在Tregs中的表达,促进Tregs产生CD15s并降低PD1水平。该过程增强了Tregs的肠道归巢和免疫抑制功能,从而有效缓解肠道炎症。
研究者说
本研究围绕IBD中Tregs的数量不足和功能受限这一长期悬而未解的问题展开,首次揭示了Fut7在Tregs归巢及免疫抑制功能中的关键作用。研究发现,活动期IBD患者的Treg细胞中Fut7表达显著下降,导致CD15s阳性Tregs减少,限制了其向炎症肠黏膜的迁移。同时,Fut7缺失的小鼠模型表现出结肠炎加重和Tregs局部浸润减少,进一步验证了Fut7对维持肠道免疫稳态的重要性。这为理解IBD发病机制提供了全新视角,即疾病不仅源于炎症因子的过度活化,更与免疫耐受细胞的迁移障碍和功能缺陷密切相关。
机制层面的深入探讨显示,Fut7不仅通过催化CD15s合成促进Tregs定向迁移,还可与Fut8竞争GDP-岩藻糖,从而下调PD1的表达,增强Tregs的免疫抑制活性。实验结果表明,Fut7缺失的小鼠Tregs表现出PD1水平上升、抑制功能减弱,伴随肠炎症状显著加重。这一双重调控机制凸显了Fut7在“迁移—功能”两方面的独特作用,揭示了Tregs数量不足与效力下降的内在联系,也为长期以来关于Tregs功能失衡的研究提供了新的分子基础。
在应用层面,研究团队设计并验证了一种新型纳米载体CD4-LDP-Fut7,能够特异性靶向Tregs并上调其Fut7表达。小鼠实验显示,该载体显著改善了结肠炎症,降低炎症因子表达,并在病理学上减轻了组织损伤。这一成果展示了将分子机制研究成果转化为潜在治疗手段的可能性,为IBD治疗提供了新思路。与传统的抗TNF-α、抗IL-12/23或抗整合素治疗不同,这一策略通过恢复免疫稳态而非单纯阻断炎症通路,具有更贴近病理本质的优势。
本研究的启示在于,IBD的治疗策略不应仅局限于“对抗炎症”,更应着眼于“重建平衡”。通过改善Tregs归巢及增强其功能,有望突破现有生物制剂疗法耐药和副作用的局限。纳米医学与免疫调控的结合为精准治疗打开了新路径,不仅对IBD,而且对其他自身免疫性疾病、移植排斥甚至肿瘤免疫治疗都具有潜在借鉴意义。当然,本研究的实验仍以动物模型为主,其在人体中的安全性和有效性有待临床进一步验证,但这一探索无疑为未来转化研究奠定了坚实基础。
综上所述,本研究系统揭示了Fut7在Tregs迁移和功能调控中的核心地位,并通过纳米载体策略验证了其治疗潜力。该成果深化了对IBD发病机制的理解,提出了以恢复免疫稳态为核心的新型治疗方向,标志着从“炎症抑制”向“免疫平衡重建”的研究和临床转变。这不仅为IBD患者提供了新的希望,也为免疫相关疾病的机制研究和干预手段开辟了新思路。
译者简介
译者
柳珂
医学博士
消化内科医师
首都医科大学附属北京友谊医院消化内科医师,医学博士;热心肠智库学术专家,Journal of Translational Internal Medicine青年编委。主持一项国家自然科学基金,近5年以第一作者身份发表SCI论文多篇,如Gastroenterology、Science Bulletin、Microbiome等。主要研究方向:肠道免疫、上皮屏障及菌群互作。
审核
施海韵
医学博士、主任医师
副教授、青年博导
医学博士,首都医科大学附属北京友谊医院消化内科主任医师,副教授,青年博导。中华医学会消化病学分会胃肠微生态学组委员,北京医学会消化病学分会肠道疾病专业副召集人,北京医学会消化病学分会青年论坛副召集人。入选北京市优秀青年人才、北京市科技新星计划等多项人才计划。主持国家自然科学基金、首都临床特色应用研究等多项科研课题。在国际、国内学术期刊发表论文30余篇,多次在DDW、APDW等国际国内学术会议做汇报交流并获青年研究者奖。主要研究方向:炎症性肠病、结直肠肿瘤与肠道微生态。
总审核
张澍田
主任医师、教授
博士生导师
首都医科大学附属北京友谊医院院长,消化健康全国重点实验室主任,国家消化系统疾病临床医学研究中心主任,国家临床医学协同研究创新联盟秘书长,中国医院协会第三、四届副会长,中华医学会消化内镜学分会第七届主任委员,中华医学会消化病学分会第九届副主任委员,北京医学会消化内镜学分会第六届主任委员,北京医学会消化病学分会第十届主任委员,中国医师协会消化医师分会第四、五届会长,亚太消化内镜学会第六、七届委员,世界华人消化医师协会第一届会长,中华消化内镜杂志主编,中华消化杂志副主编,中华医学杂志(英文版)副主编。
首都医科大学附属北京友谊医院
消化中心简介


西城院区

通州院区

顺义院区
西城院区:位于首都核心区(前门南、天坛西)
通州院区:位于北京城市副中心
顺义院区:位于首都机场附近的后沙峪
查看更多