查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





肺癌是全球范围内发病率和死亡率最高的恶性肿瘤之一。近年来,免疫治疗的探索与突破点燃了晚期NSCLC治疗的希望。百济神州自主研发的创新PD-1抑制剂替雷利珠单抗以独特的结构优势实现了晚期NSCLC一、二线治疗的全人群获益。本期将分享1例肺腺癌与1例肺鳞癌病例,分别通过替雷利珠单抗联合治疗实现了持久缓解,见证了免疫治疗在晚期NSCLC治疗实践中的价值,为临床诊疗提供思路和参考。(病例点评专家:郭金栋副主任医师;病例分享专家:赵蕾主治医师)
郭金栋
副主任医师
上海交通大学附属胸科医院 放疗科
中国抗癌协会肿瘤防治科普专业委员会青委
中国医药教育协会肺部肿瘤专业委员会委员
中国医药教育协会肿瘤免疫治疗专业委员会委员
中国医药教育协会肿瘤转移专业委员会委员
华人肿瘤放疗协作组放射免疫工作委员会委员
中国医师协会会员
上海医师协会会员
赵蕾
主治医师
上海交通大学附属胸科医院 放疗科
毕业于复旦大学上海医学院
中国医药教育协会肺部肿瘤专业委员会青年委员
一般资料:患者男性,43岁,于2020年6月就诊。
主诉:咳嗽一月余,发现双肺占位伴胸腔积液。
现病史:患者于2020年4月无明显诱因出现刺激性咳嗽,无咳痰咳血,无畏寒发热;于外院行胸部CT示双肺占位伴左侧胸腔积液;外院B超示左侧中至大量胸腔积液,行胸水穿刺;胸水涂片(外院,2020年5月28日)少量异型细胞,考虑腺癌。
既往史:无特殊。
个人史:吸烟史20支×25年。
CT检查(2020年6月,初诊):前纵隔恶性病变可能大;两肺多发结节影及粟粒影,两侧锁骨上及两侧肺门、纵隔肿大淋巴结,心包积液,两侧局部胸膜增厚,左侧胸水;两侧锁骨上淋巴结肿大,考虑转移性病变。如图1-1所示。
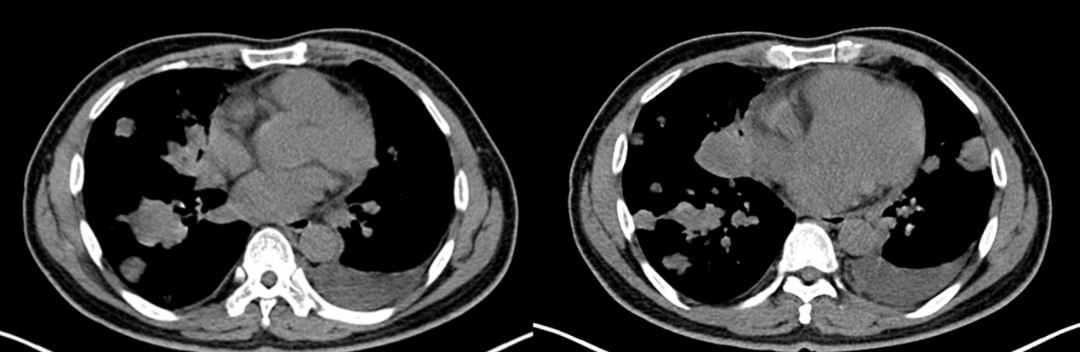 图1-1 治疗基线胸部CT
图1-1 治疗基线胸部CT
B超:双侧锁骨上淋巴结肿大。
头MRI示:脑内多发转移瘤,双侧额顶叶缺血灶。如图1-2所示。
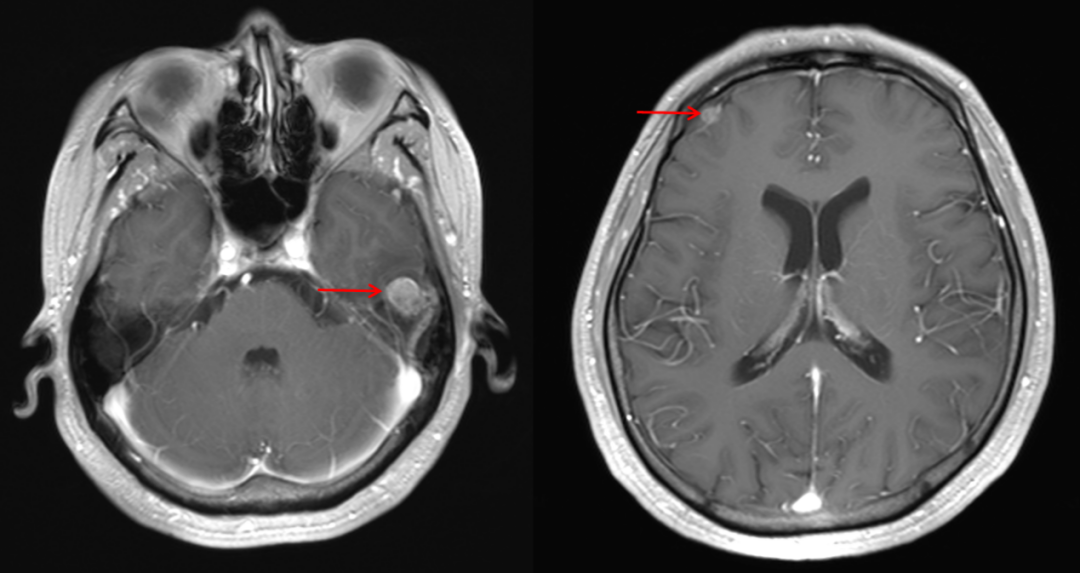
图1-2 治疗基线头MRI
PET-CT示:1.前纵隔内团块影侵犯胸骨和右侧胸大肌,FDG代谢增高,考虑恶性病变;2.双肺野内可见多枚大小不等结节和团块影,FDG代谢增高,考虑恶性病变伴双肺转移性病变;3.颈部(左侧V区)、双侧锁骨上、左侧锁骨下、纵隔、双肺门、左侧横膈上和腹膜后多枚淋巴结肿大,FDG代谢增高,考虑转移性病变;4.双侧肋胸膜和左7侧横膈多枚结节状增厚,FDG代谢增高,考虑转移性病变;5.左侧颞叶内结节伴周围水肿,结节FDG代谢增高,考虑转移性病变,建议MR随访复查;6.左侧肩胛骨和T12椎体骨质密度欠均匀,FDG代谢增高,考虑转移性病变;余无代谢异常。如图1-3所示。
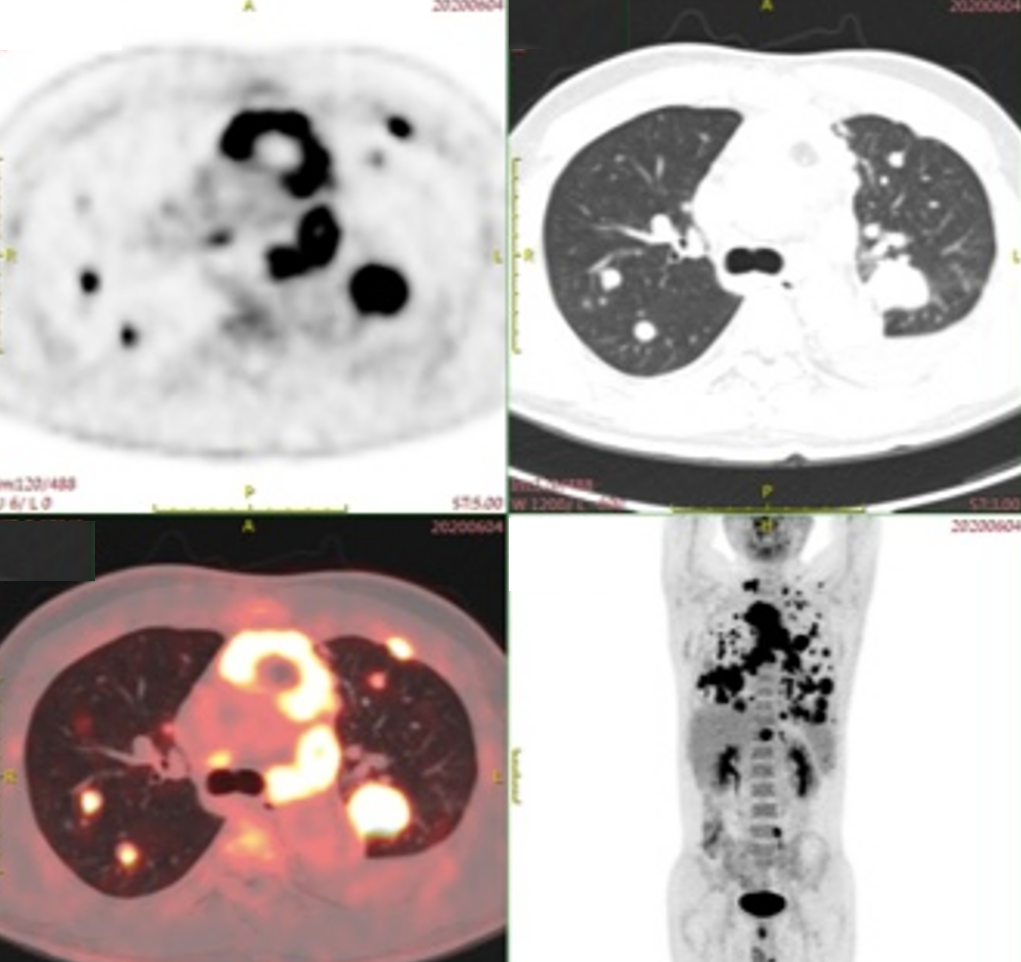
图1-3 治疗基线PET-CT
肿瘤标志物(2020年6月,初诊):癌胚抗原(CEA)174.23ng/mL;细胞角蛋白19片段(CYFRA21-1)17.51ng/mL;糖类抗原125(CA125)238.05U/ml。
病理:(锁骨上淋巴结活检)恶性肿瘤,倾向低分化癌;结合免疫组化结果,考虑腺癌。
基因表达:EGFR、ALK、ROS1、KRAS、BRAF、MET、RET等常见基因均(-);PD-L1表达2%。
诊断:支气管肺癌;原发性、周围型、左肺腺癌 C-T2N3M1(肺、胸膜、骨、脑、心包);基因阴性,PD-L1 2%;PS1分。
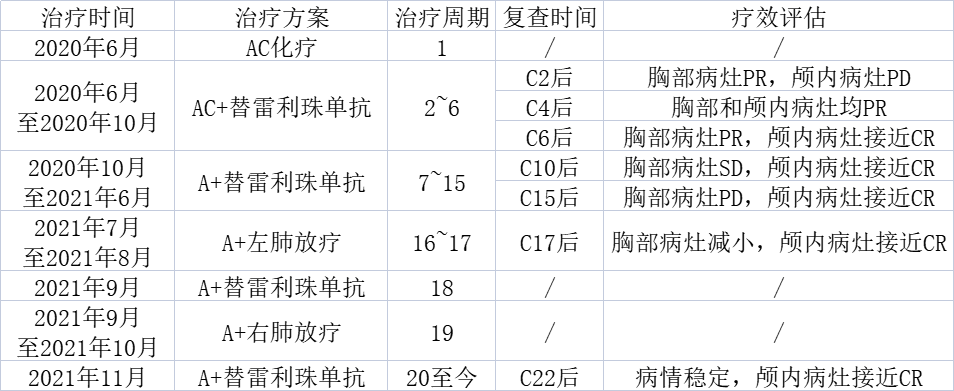
表1-1 患者治疗方案及复查情况汇总
一线治疗:免疫联合化疗
治疗方案:由于基因及PD-L1检测结果未出,患者年轻且肿瘤负荷较大,根据初步病理结果,2020年6月先予阿霉素类药物加上环磷酰胺(AC)方案化疗1周期(C1)。后因基因表达(-),PD-L1表达2%,自2020年6月至2020年9月予AC+替雷利珠单抗联合治疗5周期(C2-C6)自2020年10月至2021年6月调整为A+替雷利珠单抗联合治疗,共9周期(C7-C15)。
影像学及疗效评价:患者于C2治疗后复查胸部CT示原发灶范围不变,双肺转移灶较前缩小好转,左侧胸水吸收;胸部病灶疗效评估为PR,颅内病灶疗效评估为疾病进展(PD)。
C6治疗后复查胸部CT见原发灶及肺内转移灶较前缩小;复查头MRI见脑内转移瘤较前明显缩小;复查肿瘤标志物(-);胸部病灶疗效为PR,颅内病灶疗效接近完全缓解(CR)。
C10治疗后复查胸部CT示原发灶变化不著;复查肿瘤标志物示CEA轻度升高(8.51ng/mL);胸部病灶疗效为疾病稳定(SD),颅内病灶疗效仍接近CR。
C15治疗后复查胸部CT示原发灶及淋巴结变化不著,肺内转移灶部分增大;复查肿瘤标志物示CEA及CYFRA21-1略高。胸部病灶疗效为PD(增大),颅内病灶疗效接近CR。如图1-4所示。
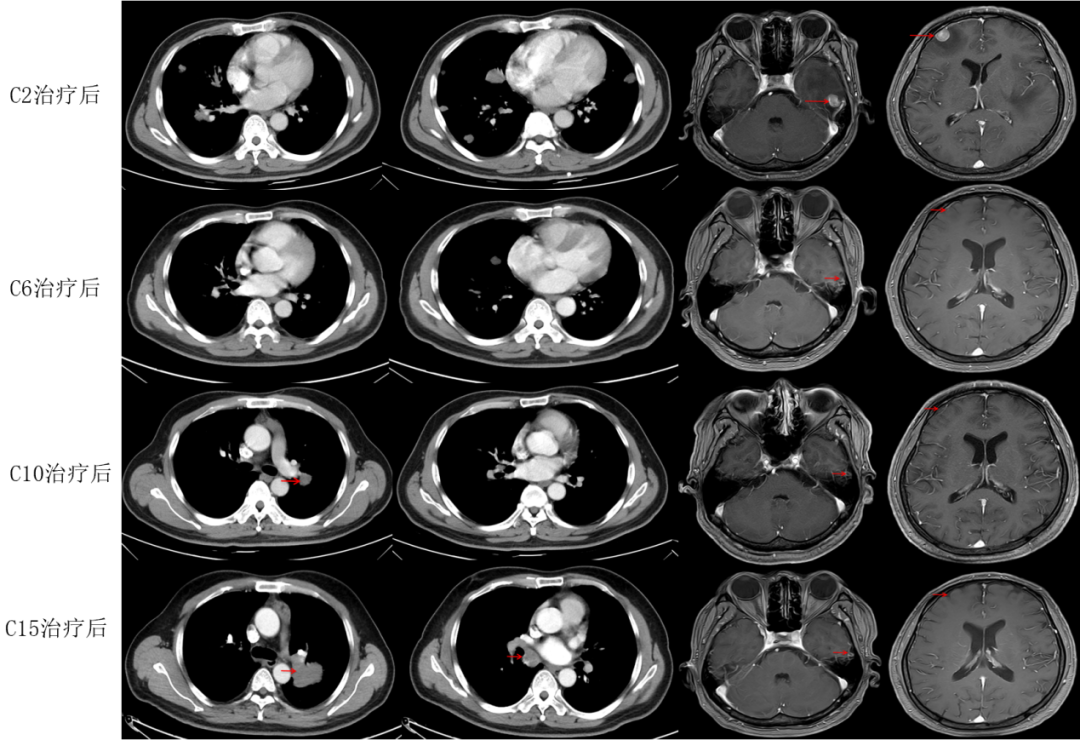
图1-4 一线治疗期间胸部CT及头MRI动态变化
第二阶段:放疗+化疗及维持治疗
治疗方案:2021年7月至8月期间行左肺病灶放疗、IMRT,DT:5000cgy/20fx;放疗期间暂停免疫治疗,同步A单药维持化疗2周期(C16-C17)。2021年9月给予患者A+替雷利珠单抗维持治疗(C18)。2021年9月至10月期间行右肺病灶放疗,IMRT,DT:3750cgy/15fx;放疗期间暂停免疫治疗,同步A单药维持化疗1周期(C19)。后继续A+替雷利珠单抗维持治疗至今(2022年8月)。
影像学及疗效评价:患者于左肺放疗后(C17)复查胸部CT见右肺上叶部分病灶较前增大,左肺门病灶较前缩小。右肺放疗后(C19)复查胸部CT示双肺转移灶较前缩小。维持治疗后(C22)复查胸部CT见左肺上、下叶实变,考虑为放射性肺损伤,予对症处理。胸部病灶疗效评估为PR。如图1-5所示。治疗期间多次复查头MRI示未见明确强化灶,疗效评估接近CR。
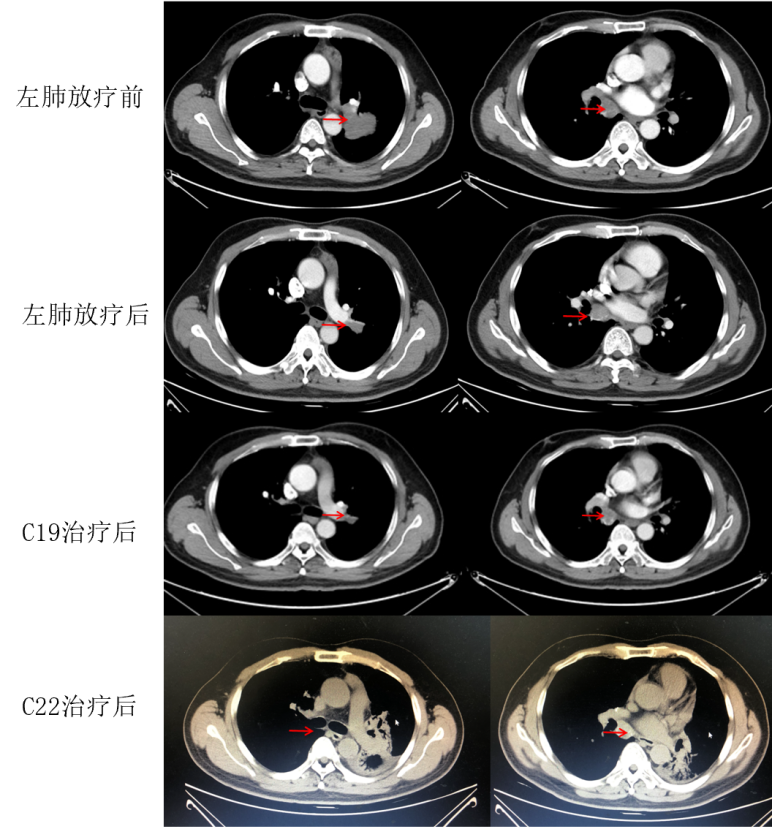
安全性评价:治疗期间未见免疫相关不良反应。
本例患者为中年男性,因“咳嗽一月余,发现双肺占位伴胸腔积液”就诊,结合症状、影像学及活检病理等检查结果,诊断为肺腺癌伴全身多发转移灶(C-T2N3M1),驱动基因阴性,PD-L1 2%。先予AC化疗1周期,后给予AC联合替雷利珠单抗治疗5周期,复查胸部病灶缩小,颅内病灶疗效接近CR并保持接近24个月(至2022年8月)。继续A+替雷利珠单抗联合治疗9周期后,复查胸部转移灶较前增大。先后行左肺及右肺放疗同步A单药维持化疗,后给予A+替雷利珠单抗维持治疗至今(2022年8月),复查胸部病灶缩小,疗效评估为PR,后续至2022年7月电话随访,患者病情保持稳定至今已达10个月以上。
一般资料:患者男性,69岁,于2019年4月就诊。
主诉:发现右肺占位伴右侧胸腔积液。
现病史:患者于2019年3月因高血压就诊于外院,无胸闷、胸痛,无头晕、头痛,无畏寒、发热等症状。胸部CT示右肺占位伴右侧胸腔积液,气管镜(-),CEA1.9ng/ml,予祛痰、平喘,中药抗肿瘤治疗。
既往史:高血压病史3年。
个人史:无特殊。
PET-CT检查(2019年4月2日):1.右肺上叶结节,FDG代谢增高,考虑恶性病变,建议病理学明确。2.右侧第5肋软骨周围软组织增厚,FDG代谢增高,需警惕转移性病变。3.左肺下叶条索样斑片影,FDG代谢不高,考虑炎性病变。4.双肺慢性炎症。双肺肺泡性肺气肿。5.双侧胸膜局部增厚。6.右侧头下斜肌局部FDG代谢增高,多见于肌紧张所致。7.右侧胸腔积液。余无异常。如图2-1所示。
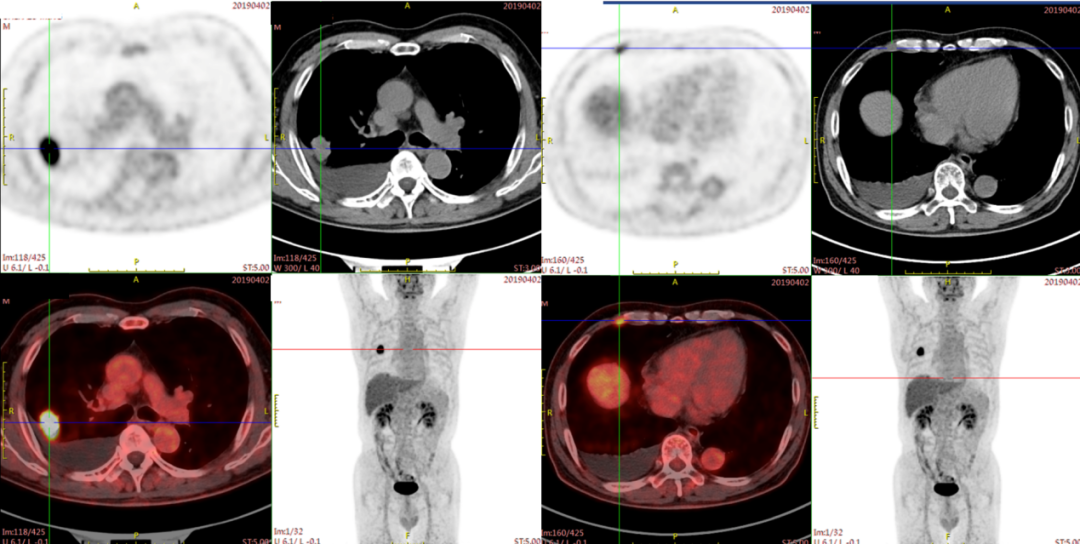
图2-1 治疗基线PET-CT
胸腔穿刺引流(2019年4月9日):胸水细胞学:找到恶性肿瘤细胞,建议活检明确。胸水包埋:镜检见恶性肿瘤细胞,结合免疫组化符合非小细胞癌,部分腺型表达,部分鳞型表达,请结合临床。
酶标:TTF-1(部分+) P40(部+) CK(+) CD56(灶+) NapsinA(-)。
CT引导下肺穿刺活检病理(2019年4月10日):镜检:右肺上叶活检结果提示鳞状细胞癌,伴局部神经内分泌分化。
酶标:CK(+) TTF-1(-) P40(+) CD56(部分+) NapsinA(-)。
头颅MRI(2019年4月15日):左侧顶叶缺血灶。老年脑。
诊断:支气管肺癌 原发性 周围型 右肺 鳞癌伴局部神经内分泌分化,C-T1cN0M1(骨),寡转移;PS1分。
一线治疗:化疗+放疗
治疗方案:患者自2019年4月19日至2019年11月5日期间给予紫杉醇联合铂类药物(TP)方案化疗,共6周期。
2019年6月14日起针对右肺病灶行放疗,SBRT,DT:7.5Gy×8fx。
2019年12月11日起针对第5肋骨行骨放疗,SBRT,DT:4Gy×10fx。
影像学及疗效评价:患者于2周期化疗后复查胸部CT示右上肺野胸膜下结节较前缩小。疗效评估为PR。继续同方案化疗4周期+右肺病灶行放疗后复查胸部CT原发灶持续缩小,疗效评估仍为PR(接近CR)。如图2-2所示。
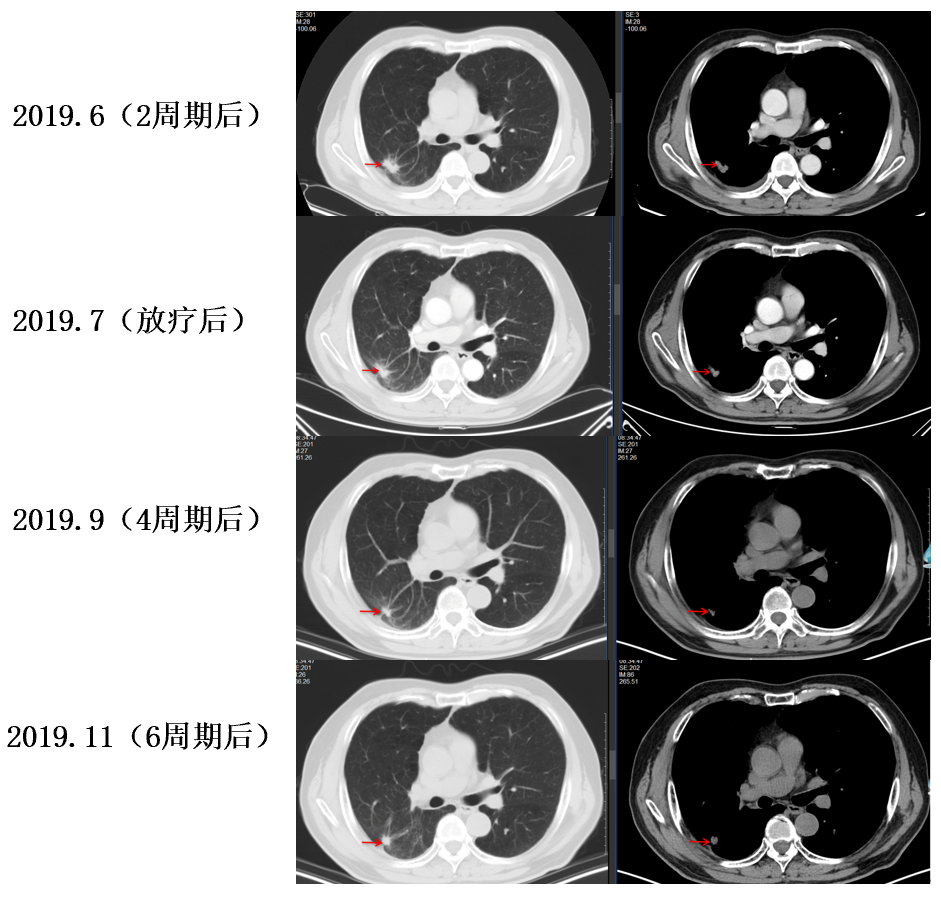
图2-2 一线治疗期间胸部CT动态变化
安全性评价:化疗期间出现I-II度骨髓抑制。
定期随访:患者自2019年12月至2021年8月期间定期随访复查,右侧胸腔积液持续增多,如图2-3所示。
2021年8月13日行胸腔积液引流:
(镜检)(右侧胸水包埋)找见恶性肿瘤细胞,结合病史、形态学及酶标,符合非小细胞癌。
(酶标)TTF1-/+,NapsinA-,CK+,P40少+,CD56少+。疗效评估为PD。

图2-3 随访期间胸部CT动态变化
二线治疗:免疫联合化疗及免疫维持
治疗方案:患者自2021年8月13日至2022年1月21日行TP+替雷利珠单抗治疗6周期,随后至今每3-4周行替雷利珠单抗维持治疗。
影像学及疗效评价:患者于联合治疗3周期后复查胸部CT示右上肺野胸膜下肿块影形态较前片改变,右侧胸腔积液较前明显减少,疗效评估为SD。患者于联合治疗5周期后复查胸部CT示右上肺野胸膜下肿块影较前缩小,右侧胸腔积液较前减少,疗效评估为PR。后续免疫维持期间评估疗效PR,如图2-4所示。
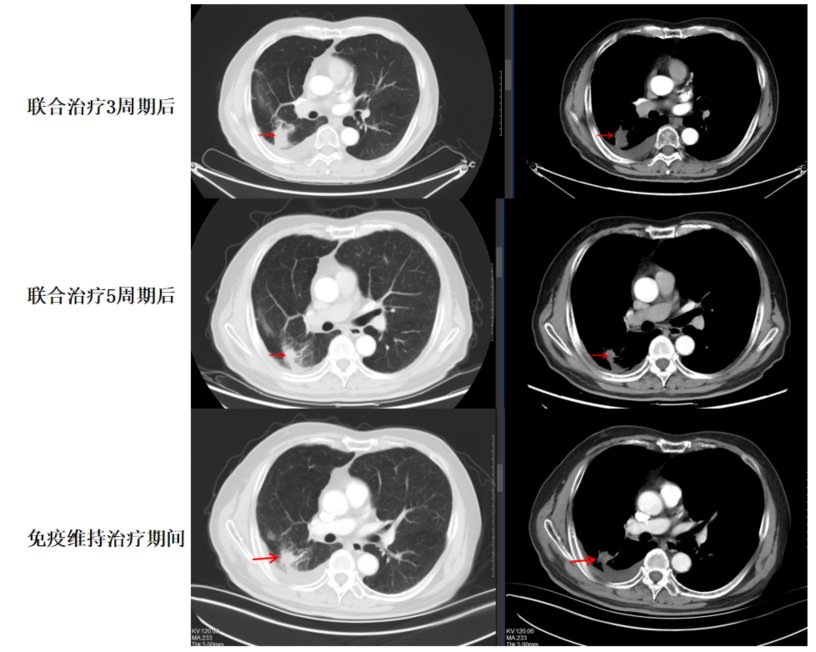
图2-4二线治疗期间胸部CT动态变化
安全性评价:联合治疗期间出现化疗相关II度骨髓抑制,未见免疫相关不良反应。
本例患者为老年男性,因“发现右肺占位伴右侧胸腔积液”就诊,结合临床、影像检查及病理活检,明确诊断为右肺鳞癌伴局部神经内分泌分化C-T1cN0M1,骨转移。患者无化疗禁忌,一线治疗采用TP化疗6周期,并分别针对右肺病灶及第5肋骨放疗,胸部病灶缩小,疗效评估为PR(接近CR)。后续定期随访期间发现右侧胸腔积液持续增多且肿瘤标志物持续升高,提示疾病进展。二线治疗采用TP+替雷利珠单抗治疗6周期,胸部病灶缩小,胸水明显减少,疗效评估为PR。后续予以替雷利珠单抗单药维持治疗至今(2022年8月),疗效评估持续PR。
肺癌作为我国发生率和死亡率最高的恶性肿瘤[1],一直是药物研究的攻克重点。近年来,精准治疗模式的飞速发展为患者带来切实的临床获益,在经历靶向治疗和免疫治疗两个重要的分水岭后,非小细胞肺癌(NSCLC)的死亡率大大降低[2]。特别是,免疫检查点抑制剂(ICIs)中的PD-1/PD-L1单抗在晚期NSCLC治疗领域取得了突破性的进展,为患者带了生存获益,并逐渐改写了NSCLC的整体治疗格局。
替雷利珠单抗是一款我国自主研发的PD-1抑制剂,因Fc段改构带来的独特结构优势,其在晚期NSCLC一线及后线治疗领域均有着出色的表现。其中,RATIONALE 304研究[3]和RATIONALE 307研究[4]分别证实了替雷利珠单抗联合化疗一线治疗晚期非鳞状和鳞状NSCLC的可靠疗效和可控安全性。基于RATIONALE系列研究的可靠循证证据,替雷利珠单抗联合化疗方案成功获得了《中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南》Ⅳ期无驱动基因NSCLC一线治疗的Ⅰ级推荐。在2022年更新版本中,替雷利珠单抗用于Ⅳ期无驱动基因NSCLC二线治疗的推荐等级也提升至I级。
病例一患者为中年男性,诊断为肺腺癌伴全身多发转移(C-T2N3M1),驱动基因阴性。根据COSO指南推荐,一线治疗给予替雷利珠单抗联合化疗,胸部病灶持续缩小,疗效评估达到PR。更令人欣喜的是,颅内多发转移病灶疗效评估接近CR,这提示我们,替雷利珠单抗联合化疗的协同作用机制,该联合方案实现了颅内病灶的有效控制,且CR状态持续接近24个月(至2022年8月)。在胸部病灶进展后,给予局部放疗和全身化疗,胸部病灶成功缩小。后续继续采用替雷利珠单抗联合化疗维持治疗至今(2022年8月),疗效评估为PR,并在10个月期间(至2022年8月)保持病情稳定。
病例二患者为老年男性,确诊为右肺鳞癌伴局部神经内分泌分化并伴有骨转移(C-T1cN0M1)。由于患者为寡转移,一线治疗采用全身化疗,同时针对原发灶及转移灶进行局部放疗,疗效评估接近CR,但在随访中发现右侧胸水持续增多且肿瘤标志物持续升高,提示疾病发生进展。二线治疗采用TP+替雷利珠单抗治疗,胸部病灶持续缩小,胸水明显减少。后续予以替雷利珠单抗单药维持治疗至今(2022年8月),疗效评估持续PR。
本期分享的两个病例反映了替雷利珠单抗联合化疗在真实世界中的应用,验证了替雷利珠单抗联合方案在不同病理类型晚期NSCLC治疗中的可靠疗效和安全性。同时,这两例临床实践也提示我们要根据患者的机体状况、肺癌的病理学类型(包括分子病理诊断)、侵及范围(临床分期),为患者制定个体化的治疗策略,合理应用免疫、放疗、化疗、靶向等多种治疗手段,以期达到根治或最大程度控制肿瘤,提高治愈率,改善患者的生活质量,延长患者生存期。
参考文献:
[1] Zhang S, Sun K, Zheng R, et al. Cancer incidence and mortality in China, 2015. Journal of the National Cancer Center, 2021, 1(1): 2-11.
[2] Howlader N, Forjaz G, Mooradian MJ, et al. The effect of advances in lung-cancer treatment on population mortality. N Engl J Med, 2020, 383(7): 640-649.
[3] Lu S, et al. J Thorac Oncol. 2021, 16(9):1512-1522
[4] Jie Wang , Shun Lu, et al. JAMA Oncol, 2021, 7(5):709-717.
查看更多