查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





什么是耐药性?耐药性从何而来?
细菌耐药危机日趋严峻,已经成为全球范围的重大公共安全问题,严重危害人类、动物的健康和生态环境。
中国细菌耐药性监测网(CHINET)数据及全国血流感染细菌耐药监测(BRICS)报告显示,血流感染病原体以革兰阴性菌为主,呈逐年上升的趋势,且耐药菌的检出率呈逐年上升趋势,其中万古霉素耐药肠球菌及碳青霉烯耐药肠杆菌呈低水平流行,而耐碳青霉烯肺炎克雷伯菌处于高水平流行状态。多重耐药和广泛耐药菌的流行,给临床抗感染治疗带来了严峻挑战,并给患者造成了沉重的经济负担。
因此,提升全民细菌耐药意识刻不容缓,了解细菌耐药知识对我们每个人而言都极其重要。
细菌耐药性是指细菌对抗菌药物不敏感的现象,是细菌自身生存过程中的一种特殊表现形式。细菌耐药可分为内源性耐药和获得性耐药。
① 内源性耐药指的是由于细菌本身的特殊结构而对某种抗菌药物具有天然耐药性。
② 获得性耐药主要是细菌通过染色体突变或外源可移动遗传元件的水平转移两大途径引起药物灭活/改变、药物结合位点/靶点的改变、细胞内药物蓄积的减少和生物膜形成等,避免自身被药物抑制或杀灭而产生耐药。
一、细菌对抗菌药物灭活或修饰
许多细菌能产生不可逆地修饰和/或灭活抗菌药物的酶,如β-内酰胺酶、氨基糖苷修饰酶、红霉素酯化酶及氯霉素乙酰转移酶等,这些酶能水解或修饰相应的抗菌药物的结构,使其失去抗菌活性。
β-内酰胺酶是临床最常见的抗菌药物灭活酶,其作用于β-内酰胺类抗菌药物所共有的β-内酰胺环,通过切断内肽键,使内酰胺环被打开,从而使抗菌药物失活,是革兰阴性菌对β-内酰胺类抗菌药物耐药的主要机制。β-内酰胺酶可以由染色体、质粒或转座子编码,既可固有表达,也可诱导表达。
根据氨基酸序列的相似度,可将β-内酰胺酶分为A、B、C、D四类。其中,A类、C类和D类酶属于丝氨酸β-内酰胺酶,活性部位包含丝氨酸残基;B类酶是金属β-内酰胺酶,需要依赖其活性部位的Zn2+与β-内酰胺相互作用。一般来说,β-内酰胺酶被革兰阴性菌分泌释放到质周间隙或由革兰阳性菌分泌到细胞外发挥作用。临床常见的TEM、SHV、CTX-M和KPC型β-内酰胺酶属于A类酶;IMP、VIM和NDM型β-内酰胺酶属于B类酶;AmpC型β-内酰胺酶属于C类酶;OXA型β-内酰胺酶属于D类酶。
氨基糖苷修饰酶通过共价修饰特定的药物氨基或羟基,导致氨基糖苷不能与核糖体正常结合从而导致耐药,是临床氨基糖苷类药物耐药最重要的机制,包括乙酰化酶、核苷酶和磷酸化酶三类。
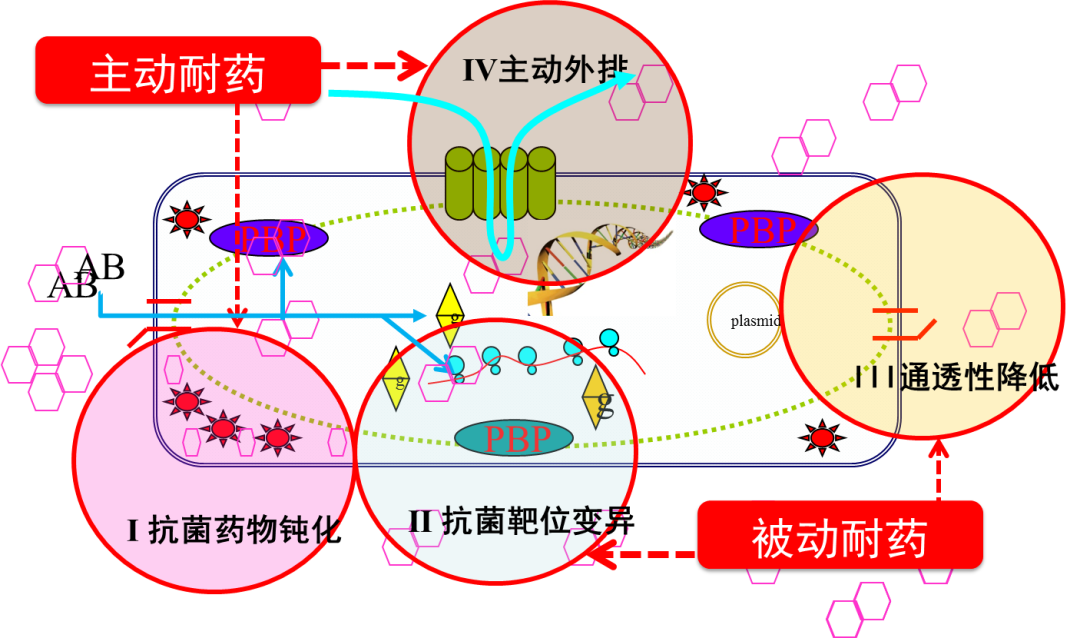
细菌耐药机制示意图
注:图中六边形代表抗菌药物,PBP(青霉素结合蛋白)和菱形代表抗菌药物靶点,太阳星代表药物水解酶,plasmid为耐药质粒。
二、抗菌药物结合位点/靶点改变
抗菌药物与细菌靶点的作用通常是特异的,细菌可以通过改变靶位或保护靶位,导致其与抗菌药物亲和力降低而产生耐药。
青霉素结合蛋白(PBPs)的修饰可影响其与β-内酰胺类抗菌药物的亲和力,是革兰阳性菌对β-内酰胺抗菌药物耐药的主要机制。如MRSA的耐药机制主要与细菌获得mecA基因并大量表达产生特殊青霉素结合蛋白PBP2a有关;VRE耐药机制是由耐药基因修饰细菌中万古霉素结合靶位有关;还有如大环内酯类、林可霉素、链阳霉素、四环素类、氨基糖苷类药物的作用靶位为核糖体的亚基,利福霉素类的作用靶位为依赖于DNA的RNA聚合酶,喹诺酮类的作用靶位为拓扑异构酶,这些作用靶位结构的改变都可能使细菌对相应的抗菌药物产生耐药。
三、减少细胞内抗菌药物积蓄
抗菌药物需要进入细菌体内并达到一定的浓度,才能作用于靶位发挥其杀菌作用。细菌膜通透性的改变和主动外排机制都会减少细胞内的药物浓度,从而产生耐药。
① 细菌膜通透性降低:脂多糖是革兰阴性菌外膜的主要组成成分,对细菌的渗透障碍起着一定的作用。脂多糖被修饰或减少会导致某些药物无法进入细胞内而发生耐药。如多黏菌素是通过作用于外膜表面携带负电荷的脂质A发挥抗菌效果,当脂多糖被修饰后多黏菌素不能与其结合无法发挥抗菌活性。
革兰阴性菌的外膜含有称为孔蛋白的蛋白质,形成孔道允许包括抗菌药物等许多亲水性物质通过,孔蛋白的丢失将导致进入细胞内的抗菌药物减少。如铜绿假单胞菌外膜孔蛋白OprD2的基因突变或缺失致使OprD2功能缺失或表达下调,使药物不能到达细胞内,这是铜绿假单胞菌对亚胺培南等碳青霉烯类耐药的重要机制。多重耐药性肺炎克雷伯菌外膜蛋白OmpK35和OmpK36丢失会导致对β-内酰胺类药物的敏感性降低,这种机制往往与β-内酰胺酶协同导致高水平耐药。
② 细菌主动外排泵:细菌外膜存在多种主动外排泵,可以分为五类,易化子超家族、耐药结节化细胞分化家族、ATP结合盒超家族、多重药物和毒性化合物外排家族和小多重性耐药家族五个超家族,这些外排泵类似菌体排泄通道,可以排出细菌代谢产物、毒素、信息素等,也可以排出进入菌体的抗菌药物,其中耐药结节化细胞分化家族与碳青霉烯抗菌药物的耐药有关,也是最早发现的外排泵系统,主要分布在革兰阴性菌,参与多种抗菌药物的排出。铜绿假单胞菌含有大量外排泵,其中MexAB-OprM和MexCD-OprJ的过度表达会导致碳青霉烯类、氟喹诺酮类和氨基糖苷类等多种抗菌药物耐药。在临床菌株中,这类机制往往表现为低水平耐药,当与其他耐药机制协同(如外膜蛋白、水解酶等)时才能产生高水平的耐药。
四、形成生物膜
细菌生物膜的主要成分由细菌分泌的多糖物、藻酸盐等组成,易在惰性物体或生物物体表面如医疗设备、留置导管、坏死的组织上产生,细菌在生物膜内代谢缓慢,对抗菌药物等杀菌剂、恶劣环境及宿主免疫防御机制有很强的抗性。生物膜虽然不是细菌耐药的主要机制,但其可能减弱药物发挥活性所必需的条件;且当细菌经历营养缺乏后可能会对抗菌药物产生耐受,这也是导致这些细菌性疾病难以根治的主要原因,主要见于金黄色葡萄球菌、铜绿假单胞菌,鲍曼不动杆菌和肺炎克雷伯菌。
细菌的耐药机制往往不是孤立存在的,而是相互作用影响细菌的耐药性。如碳青霉烯类耐药铜绿假单胞菌最常见机制是产AmpC酶合并孔蛋白的变化。低水平的AmpC酶不会导致高水平的碳青霉烯类耐药,但高产AmpC合并其他因素导致的膜孔蛋白渗透性减少和/或外排泵过表达往往产生高水平耐药。
作者:方睿童
本文转发自HEALTH细菌耐药暑期调研
往期推荐
查看更多