查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





“我有严重的异动症,我吃饭的时候会把桌上所有的玻璃杯都打翻。”
—— 一位帕金森病患者1
左旋多巴是一种对帕金森病(PD)患者具有着重要意义的治疗药物,但随着对疾病认识的加深和研究的不断深入,人们发现左旋多巴治疗PD存在一定的局限性2。随着疾病进展和左旋多巴的长期使用,大多数PD患者会出现运动并发症3。发表于Mov Disord的一项队列研究对141名PD患者进行了长达13年的随访,研究结果显示,应用左旋多巴治疗5年的患者,症状波动和异动症的发生率分别为54.3%和14.5%;应用左旋多巴治疗10年的患者,运动波动和异动症发生率分别为100%和55.7%4。综上所述,PD的临床治疗仍存在巨大的未被满足的需求,运动并发症是PD治疗的重点与难点,重视PD运动并发症的治疗和管理对PD患者至关重要2。
PD运动并发症严重危害患者生活质量
几乎所有患者在PD确诊后15至20年内都会出现运动并发症,严重威胁着患者的身心健康,运动并发症所造成的残疾有时比PD本身的运动症状更为严重5,6。一项研究纳入了143例PD患者,探索了PD运动并发症对患者的影响,结果显示,PD运动并发症会影响患者的行动能力、日常生活活动、羞耻感和沟通,帕金森病生活质量问卷(PDQ-39)中对应领域评分均显著降低(P<0.01)7,为临床管理带来挑战。此外,一项对法国门诊PD患者的调查通过PDQ-39和生活质量评定量表(SF-36)评估了683名患者的生活质量,结果显示,运动并发症使得患者的PDQ-39评分和SF-36评分显著降低(P<0.01)8。由此可见,PD运动并发症对患者生活质量产生严重负面影响9。
防治PD运动并发症是PD治疗中的重要一环,但PD运动并发症的临床表现复杂,受到多种因素影响(包括药物使用的起始时间、种类、方式,患者的年龄,性别和临床亚型等),其病理生理机制尚未阐明,限制了防治策略的开发2。研究表明,间歇性口服左旋多巴、黑质纹状体神经末梢的持续丧失和内源性多巴胺储存/释放能力的降低是PD运动并发症出现的决定性因素,多巴胺受体功能的改变与PD运动并发症的发生密切相关3,10。
未雨绸缪,关注PD运动并发症的预防
2018年国际帕金森病与运动障碍大会(MDS)循证医学指南指出,早期PD患者治疗运动症状时,也应注重预防/延缓运动并发症11。在PD病程早期,及时有效预防、延缓和控制PD运动并发症是改善PD患者预后,提高生活质量的关键举措。《中国帕金森病治疗指南(第四版)》指出,为预防高剂量左旋多巴诱发运动并发症,早期添加DAs有助于推迟异动症的发生;普拉克索等多巴胺受体激动剂(DAs)可提供持续性多巴胺能刺激,延缓运动并发症的发生12。
添加DAs治疗可延缓PD运动并发症的发生
一项纳入10项随机对照试验、2223例PD患者的荟萃分析评估了DAs单药治疗(包括普拉克索、罗匹尼罗等)、左旋多巴单药治疗和DAs联合左旋多巴治疗下异动症的发生比例。研究结果显示,DAs单药治疗(n=771)和DAs联合左旋多巴治疗(n=400)相比左旋多巴单药治疗(n=1052),发生异动症的患者比例降低(2.9% vs. 8.9% vs. 28.3%)(图1)13。该研究结果提示,添加DAs(如普拉克索)治疗可延缓PD运动并发症的发生。
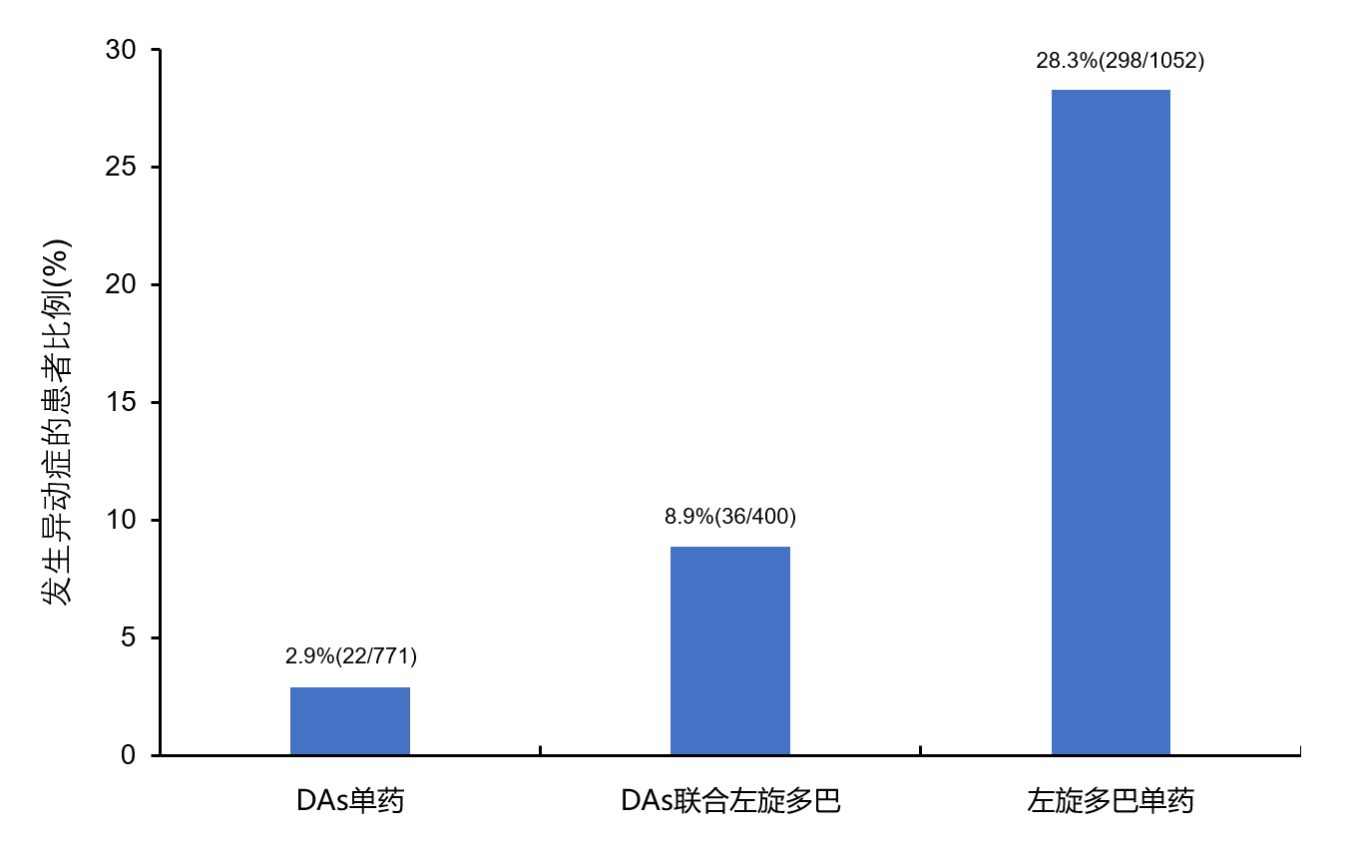
图1. 不同治疗类型发生异动症的患者比例
普拉克索初始治疗可降低PD运动并发症发生风险
一项荟萃分析纳入了9项随机对照试验,涉及2112例PD患者。该研究分析了左旋多巴和4种DAs(普拉克索、罗匹尼罗、溴隐亭和培高利特)早期PD单药治疗的运动并发症发生风险,通过计算累积排名曲线下面积(SUCRA)评估各药物治疗下运动并发症的发生风险,SUCRA值越大,运动并发症发生风险越高。研究结果显示,与其他药物相比,普拉克索起始治疗可降低PD运动并发症发生风险(图2)14。
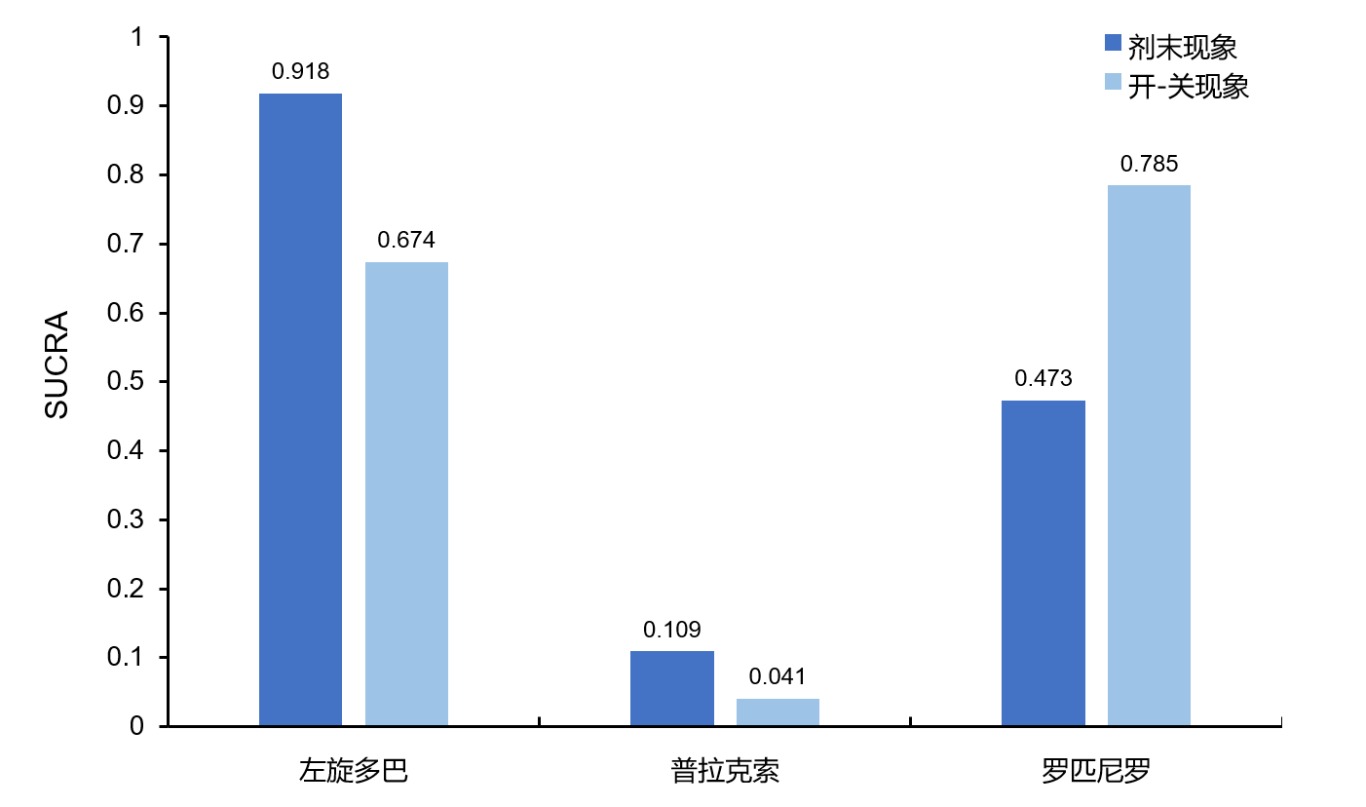
图2. 不同药物起始治疗PD剂末现象和开-关现象的发生风险
重视治疗,普拉克索显著改善PD运动并发症
PD运动并发症的治疗是一个长期、艰巨的过程,是医护人员、患者及其家庭共同的挑战。对于PD运动并发症,应采用“防治并举”的理念,改善疾病预后,提高患者生活质量2。关于PD的治疗,《中国帕金森病治疗指南(第四版)》指出,通过提供持续性多巴胺能刺激的药物或手段可以对运动并发症起到治疗的作用,推荐PD患者加用对纹状体产生持续性多巴胺能刺激的长半衰期DAs12。普拉克索是PD的主要治疗药物之一,可提供持续稳定的多巴胺能刺激,并获国内外多部指南推荐,可用于治疗PD患者的运动并发症2,11,12。
联合普拉克索治疗显著改善PD运动并发症
一项纳入20项随机对照试验、6560例PD患者的大型荟萃分析旨在评估普拉克索等DAs对晚期PD患者运动波动的疗效。研究结果显示,对于有运动波动的晚期PD患者,左旋多巴联合普拉克索治疗可增加“开”期时间,改善UPDRS III评分,并最终改善UPDRS II评分,从而使患者获益最大化15。
另有一项荟萃分析纳入了44项试验,8436例PD患者,评估了左旋多巴联合DAs、儿茶酚-O-甲基转移酶(COMT)抑制剂、单胺氧化酶-B(MAO-B)抑制剂对中晚期且已经发生运动并发症的PD患者的风险获益情况。数据显示,晚期PD患者联合DAs治疗可显著改善症状波动,减少“关”期时间(P=0.0003)(图3)。其中,普拉克索组的“关”期时间减少最多(1.81h/天),其余依次为溴隐亭(1.78 h/天)、培高利特(1.60 h/天)、卡麦角林(1.29 h/天)、罗匹尼罗(0.93 h/天)(图4)。该研究进一步证实,普拉克索是治疗PD运动并发症的有效选择16。
图3. 左旋多巴联合不同药物治疗PD患者“关”期时间变化
图4. 左旋多巴联合不同DAs治疗PD患者“关”期时间变化
此外,调整服药次数、剂量或添加药物也可能改善运动并发症,手术治疗如脑深部电刺激(DBS)等亦有效12。临床上应结合患者实际情况,制定不同的治疗方案。
总结
运动并发症是PD中晚期阶段的常见症状,严重影响患者的生活质量,给临床治疗带来了棘手的难题,但目前PD运动并发症的防治策略仍不完善。为实现患者获益最大化,临床上在治疗运动和非运动症状的同时,需更加重视运动并发症的预防和治疗。DAs是预防/治疗PD运动并发症的良好选择,其中,普拉克索受到国内外多部指南推荐,在预防和治疗PD运动并发症上均表现出色,能够帮助实现有效临床管理。

肖勤 教授
博士、主任医师、博士生导师
上海交通大学医学院附属瑞金医院神经内科副主任
中华医学会神经病学分会帕金森病及运动障碍学组委员
国际帕金森病及运动障碍协会亚太分会教育委员会前委员
中国老年学学会老年医学委员会老年神经病学专家委员会常委
中国康复医学会帕金森病与运动障碍专业委员会会常务委员
曾先后赴美国贝勒医学院、康奈尔大学威尔医学院Methodist医院作为博士后工作三年,对帕金森病和原发性震颤的发病机制及治疗有较深入的研究。
1. Center for Drug Evaluation and Research, U.S. Food and Drug Administration. The Voice of the Patient. 2016 May.
2. 刘振国, 等. 帕金森病运动并发症中西医结合诊治专家共识(2020)[J]. 中国神经免疫学和神经病学杂志,2020,27(04):247-252.
3. Cabreira V, et al. Contemporary Options for the Management of Motor Complications in Parkinson's Disease: Updated Clinical Review. Drugs. 2019 Apr;79(6):593-608.
4. Kim HJ, et al. Motor complications in Parkinson's disease: 13-year follow-up of the CamPaIGN cohort. Mov Disord. 2020 Jan;35(1):185-190.
5. Aradi SD, et al. Medical Management and Prevention of Motor Complications in Parkinson's Disease. Neurotherapeutics. 2020 Oct;17(4):1339-1365.
6. 陈生弟, 等. 帕金森病的昨天、今天和明天[J]. 中华神经科杂志,2006,(06):361-363.
7. Chapuis S, et al. Impact of the motor complications of Parkinson's disease on the quality of life. Mov Disord. 2005 Feb;20(2):224-30.
8. Perez-Lloret S, et al. L-DOPA-induced dyskinesias, motor fluctuations and health-related quality of life: the COPARK survey. Eur J Neurol. 2017 Dec;24(12):1532-1538.
9. Cenci MA, et al. Dyskinesia matters. Mov Disord. 2020 Mar;35(3):392-396.
10. 刘振国,等. 帕金森病运动并发症干预策略与思考[J]. 中华神经科杂志,2017,50(9):641-645.
11. Fox SH, et al. International Parkinson and movement disorder society evidence-based medicine review: Update on treatments for the motor symptoms of Parkinson's disease. Mov Disord. 2018 Aug;33(8):1248-1266.
12. 中华医学会神经病学分会帕金森病及运动障碍学组, 等.中国帕金森病治疗指南(第四版)[J].中华神经科杂志,2020,53(12):973-986.
13. Chondrogiorgi M, et al. Dopamine agonist monotherapy in Parkinson's disease and potential risk factors for dyskinesia: a meta-analysis of levodopa-controlled trials. Eur J Neurol. 2014 Mar;21(3):433-40.
14. Zhang Q, et al. Dopamine agonists versus levodopa monotherapy in early Parkinson's disease for the potential risks of motor complications: A network meta-analysis. Eur J Pharmacol. 2023 Sep 5;954:175884.
15. Ruan X, et al. Comparative Efficacy and Safety of Dopamine Agonists in Advanced Parkinson's Disease With Motor Fluctuations: A Systematic Review and Network Meta-Analysis of Double-Blind Randomized Controlled Trials. Front Neurosci. 2021 Oct 29;15:728083.
16. Stowe R, et al. Evaluation of the efficacy and safety of adjuvant treatment to levodopa therapy in Parkinson s disease patients with motor complications. Cochrane Database Syst Rev. 2010 Jul 7;(7):CD007166.
3. Cabreira V, et al. Contemporary Options for the Management of Motor Complications in Parkinson's Disease: Updated Clinical Review. Drugs. 2019 Apr;79(6):593-608.
4. Kim HJ, et al. Motor complications in Parkinson's disease: 13-year follow-up of the CamPaIGN cohort. Mov Disord. 2020 Jan;35(1):185-190.
5. Aradi SD, et al. Medical Management and Prevention of Motor Complications in Parkinson's Disease. Neurotherapeutics. 2020 Oct;17(4):1339-1365.
6. 陈生弟, 等. 帕金森病的昨天、今天和明天[J]. 中华神经科杂志,2006,(06):361-363.
7. Chapuis S, et al. Impact of the motor complications of Parkinson's disease on the quality of life. Mov Disord. 2005 Feb;20(2):224-30.
8. Perez-Lloret S, et al. L-DOPA-induced dyskinesias, motor fluctuations and health-related quality of life: the COPARK survey. Eur J Neurol. 2017 Dec;24(12):1532-1538.
9. Cenci MA, et al. Dyskinesia matters. Mov Disord. 2020 Mar;35(3):392-396.
10. 刘振国,等. 帕金森病运动并发症干预策略与思考[J]. 中华神经科杂志,2017,50(9):641-645.
11. Fox SH, et al. International Parkinson and movement disorder society evidence-based medicine review: Update on treatments for the motor symptoms of Parkinson's disease. Mov Disord. 2018 Aug;33(8):1248-1266.
12. 中华医学会神经病学分会帕金森病及运动障碍学组, 等.中国帕金森病治疗指南(第四版)[J].中华神经科杂志,2020,53(12):973-986.
13. Chondrogiorgi M, et al. Dopamine agonist monotherapy in Parkinson's disease and potential risk factors for dyskinesia: a meta-analysis of levodopa-controlled trials. Eur J Neurol. 2014 Mar;21(3):433-40.
14. Zhang Q, et al. Dopamine agonists versus levodopa monotherapy in early Parkinson's disease for the potential risks of motor complications: A network meta-analysis. Eur J Pharmacol. 2023 Sep 5;954:175884.
15. Ruan X, et al. Comparative Efficacy and Safety of Dopamine Agonists in Advanced Parkinson's Disease With Motor Fluctuations: A Systematic Review and Network Meta-Analysis of Double-Blind Randomized Controlled Trials. Front Neurosci. 2021 Oct 29;15:728083.
16. Stowe R, et al. Evaluation of the efficacy and safety of adjuvant treatment to levodopa therapy in Parkinson s disease patients with motor complications. Cochrane Database Syst Rev. 2010 Jul 7;(7):CD007166.
审批编号:SC-CN-15571
有效期至:2025年7月1日
仅供医学人士阅读参考
↓↓↓
查看更多