查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





南京大学医学院附属鼓楼医院消化科
丁希伟
活检是内镜医生临床工作中最常规最普通的工作之一,规范化的活检对我们的诊断及后续治疗至关重要,能够正确地理解病理报告及做好与病理医生的沟通也是正确诊断的重要一环。
1)规范化留图:活检前、中、后应该留下清晰的图片。
2)准确描述活检部位,不能仅描述胃体胃窦等,太过笼统,需要更具体一点有利于准确定位,比如胃窦小弯侧,胃体中部大弯侧等。
3)不同活检标本要分开放置。
4)活检后标本要及时放福尔马林溶液固定。
1)考虑良性与恶性病变,先活检良性病变再活检恶性病变,如果先活检恶性病变,则更换活检钳后再活检良性病变。
2)如果活检部位接近,要考虑血流的方向,优先活检重力低位病变。
3)溃疡性病变尽量活检溃疡边缘,避开溃疡中央活检
1)怀疑胃早癌且符合ESD适应证的患者,一般可取2块,通常不超过3块。较小的病变不建议取较多活检。十二指肠及结肠可行内镜下切除的小病变如腺瘤或早期癌等,不建议活检,直接内镜下切除。
2)在有高清NBI+放大内镜且诊断有信心的情况下,活检块数可以减少,比如1块甚至不取。
3)研究显示NBI+ME对胃褪色调病变诊断存在明显不足的情况,需要重视胃褪色调病变的活检。
4)重视病变的第一块活检,因为第一块活检出血后会影响视野,对后续的活检会有影响。
1)活检钳尽可能垂直于病变活检,切线位可以通过旋转镜身调整大小旋钮来与病变处于垂直位活检,困难的部位可以透明帽辅助调整方向后活检(图1)。
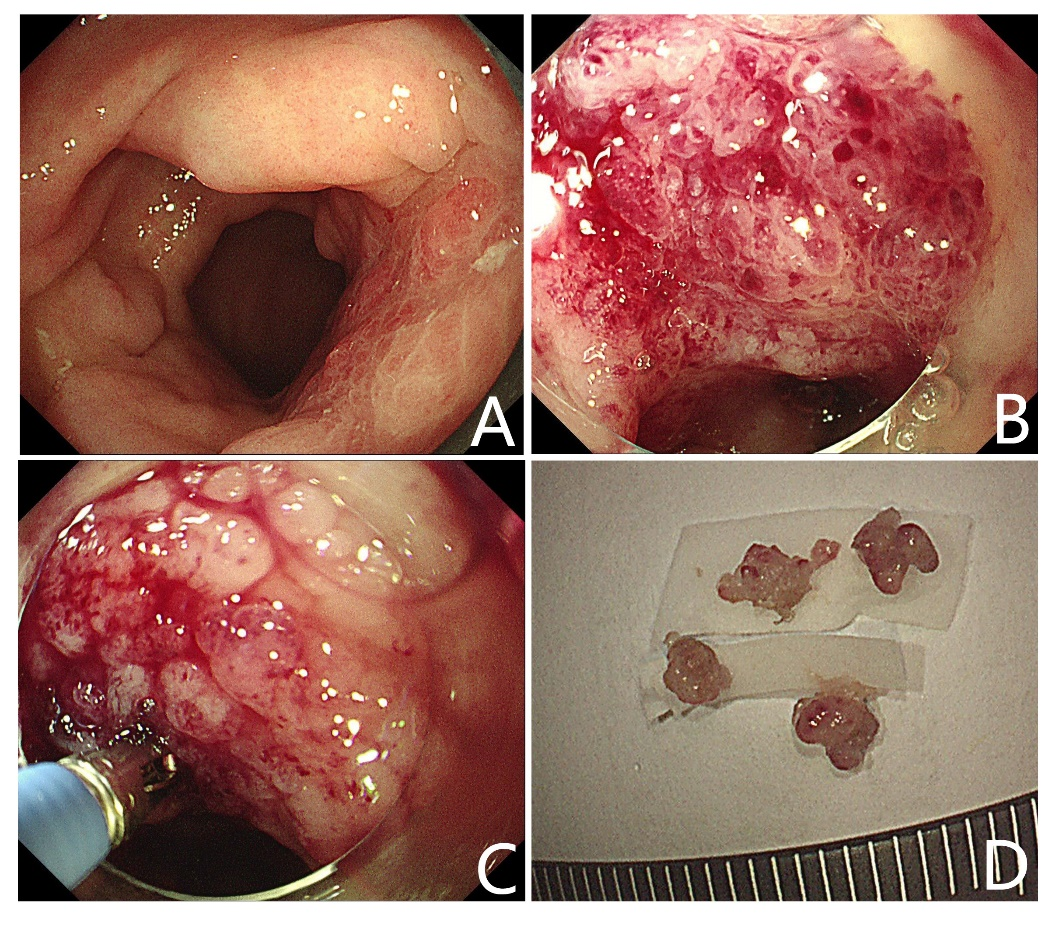
图1 (A)肠镜示直肠僵硬增厚充血,提示浸润性病变可能,外院肠镜活检未见恶性依据。病变呈切线位,常规活检可能取到的组织量较小不够诊断。(B)戴上透明帽,旋转内镜使病变处于12点方向。(C)透明帽轻轻抵住肛侧黏膜,大钮up到底,可以使活检钳垂直于病变活检。(D)垂直活检后的标本有3mm~4mm,活检量比较充足,病理示高中分化的腺癌。
2)大黏膜活检(诊断性EMR)等。部分肿瘤性病变利用常规活检较难取到肿瘤,可以尝试诊断性EMR(图2)。
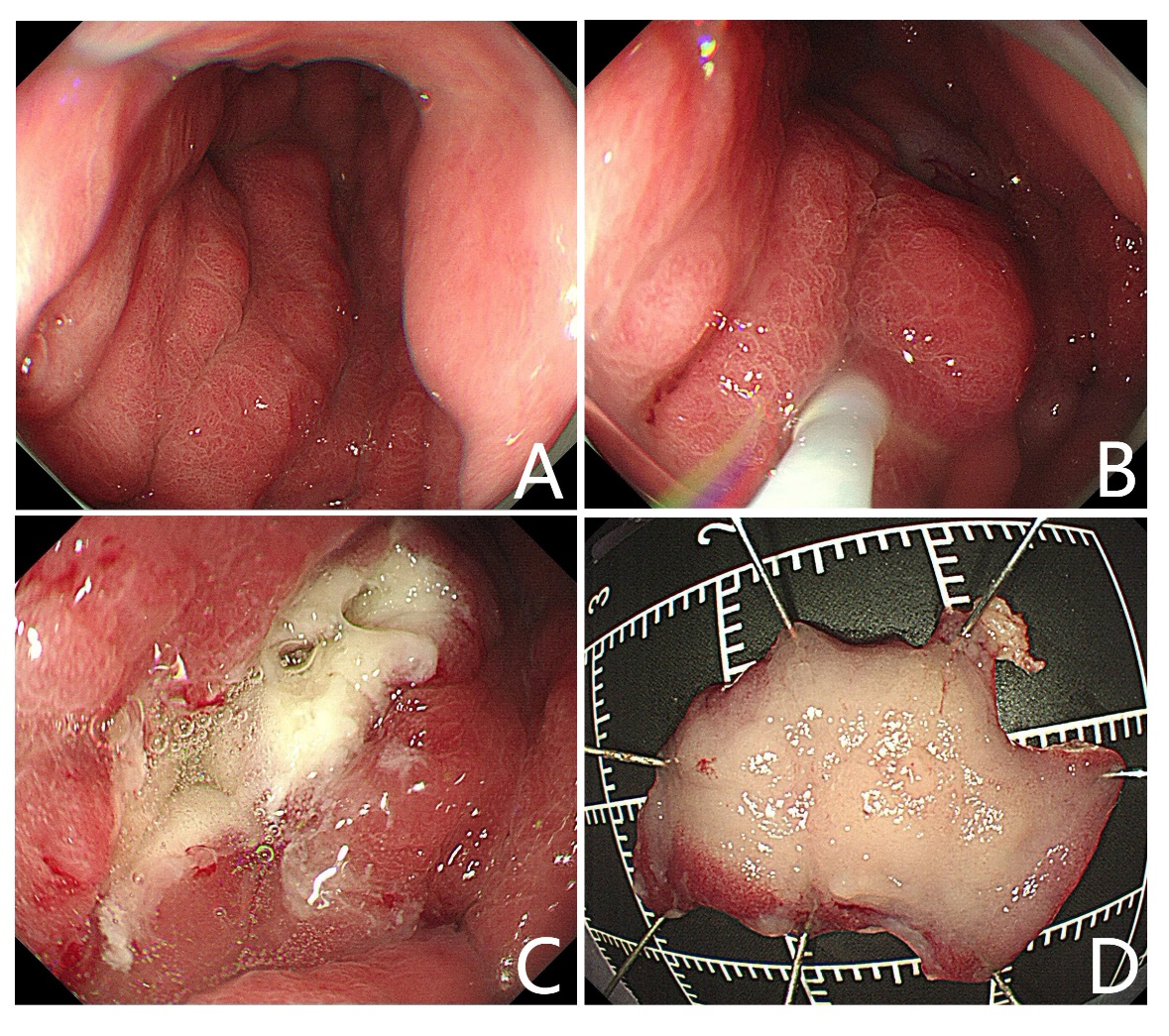
图2 (A)胃镜示胃体黏膜增厚僵硬,考虑Borrmann IV型胃癌,但患者门诊常规内镜胃体大弯侧活检3块仅提示非萎缩性胃炎。胃壁僵硬无法撑开,反复观察未能找到可疑露头的地方;(B)对大弯侧僵硬增厚的地方使用圈套器套取大块黏膜通电切除;(C)切除后创面无明显渗血;(D)标本展开固定,大小约1.5cm×2.5cm。最终在局灶区域黏膜固有层及黏膜下层散在异型上皮细胞浸润,结合免疫组化检查结果(CK+)考虑低黏附性癌。
1)国内胃黏膜的活检病理基本参照WHO的标准,但早癌的内镜学习我们基本参考的是日本标准,使我们会经常困惑。其实不用太纠结,因为WHO的标准与日本的标准越来越近。能够正确掌握好WHO的标准,并知道与日本标准的对应关系就行。比如WHO标准里低级别异型增生对应日本的腺瘤或低异型度的分化型癌,高级别异型增生对应日本的分化型早癌。当然对应的前提是病理医生能正确的区分肿瘤与非肿瘤病变。
2)目前国内的现状是低级别上皮内瘤变/低级别异型增生的病理报告较多,很多不典型的炎性改变被纳入低瘤/低级别异型增生,还有很多高级别异型增生由于诊断信心不足或诊断标准掌握不熟也会给出低瘤/低级别异型增生的诊断,给内镜医生的判断带来很多困惑。因此需要与放大内镜精查结合起来判断,放大内镜下典型早癌表现的(符合VS诊断体系),病理是低瘤/低级别异型增生,倾向于按照早癌处理,内镜不典型的或者自信度不高的可以密切随访复查,如果病变不消失,仍要警惕肿瘤的可能。
3)重视病理报告中的建议,如病理报告中看到一些非典型改变,建议治疗后复查,需要重视复查。如果炎症比较重,需要根除幽门螺杆菌等治疗后复查并活检;如果病理报告建议加做免疫组化协助诊断,建议完善免疫组化。
4)对于病理结果不能全信,需要结合内镜。我们常说病理是金标准,但病理报告和病理医生也有出错的时候,病理诊断上的漏诊、误诊也不少见。全国大部分医院病理科没有消化及早癌亚专业,因此普通的病理医生不一定能给出最专业的诊断。分化比较好的细胞异型度比较低的胃癌、除菌后的胃癌、特殊类型的胃癌(如EB相关性胃癌)、炎症背景比较重的胃癌等通常病理上诊断比较难,没有足够的经验很难准确判断。
对于内镜高度怀疑有问题病理报不出来的情况,需要跟病理科沟通,必要时深切及加做免疫组化(p53,ki67, CK及EBER等),或重取活检,或科内讨论,或拿出去请专家会诊,仍然没有答案的,治疗后密切复查,“让子弹飞一会儿”。
1、规范化的活检取材及取得足够的组织量是病理诊断的关键;
2、正确理解病理报告,病理结合内镜一起做出判断会更加准确,特殊病例做好与病理医生的沟通。
查看更多